乙型肝炎病毒感染对外周血单个核细胞分泌功能的影响*
邵华卿 张春蕾 陈旭东 王 磊
1.上海中医药大学附属龙华医院检验科 (上海, 200032) 2.上海中医药大学附属龙华医院急诊科 3.上海中医药大学附属龙华医院肝病科
慢性乙型病毒性肝炎(CHB)是我国传染病重大传染病之一,乙型肝炎病毒(HBV)持续感染是导致本病发生的关键[1,2]。外周血单个核细胞(PBMC)包含淋巴细胞和单核细胞等,在HBV的清除过程中发挥着重要的作用,除能够提呈抗原、直接清除感染病毒的肝细胞外,还可以分泌大量细胞因子参与病毒的清除[3,4]。血液中的各类细胞因子具有强大免疫调节功能,能够激活或抑制机体细胞免疫和体液免疫从而影响HBV的清除,研究显示细胞因子平衡的紊乱、关键因子的缺乏可能是导致HBV慢性感染的重要因素[5-9]。了解病毒刺激后细胞因子的分泌时间变化规律有助于选择恰当实验时机提高实验研究的准确性。
1 资料与方法
1.1 试剂 用于分离PBMC的血液样本全部来自龙华医院招募的健康志愿者。乙型肝炎病毒取自HepG 2.2.15细胞浓缩上清液。CBA检测试剂盒:IL-2、IL-4、IL-6、IL-10、IL-17A、TNF-α、IFN-γ等细胞因子捕获微球、CBA Human Soluble Protein Master Buffer Kit均购自BD公司。Amicon Ultra-15(100 kd)超滤离心管购自Millipore公司。
1.2 方法
1.2.1 PBMC的分离 无菌条件下采集各组患者及健康志愿者外周血10 ml后PBS等倍稀释混匀;50 ml的离心管中加入2倍血液的淋巴细胞分离液,将混匀的血液缓慢加入在含有淋巴细胞分离液的离心管中,室温1 500 rpm/min离心20 min;离心后离心管内分为3层:上层为血清和PBS液,下层主要为红细胞,中层为淋巴细胞分离液。在上、中层界面处以单个核细胞为主的灰白色云雾带;轻轻抽取灰白色云雾层的细胞加2倍PBS悬浮,依次1 200 rcf/min、1 000 rcf/min各10 min、5 min洗涤两次;洗涤结束加入适量含血清RPMI 1640培养基重悬,加入6孔板培养每孔加入1.5 ml培养基,调整细胞浓度为5×105个/孔,置于37℃ 5% CO2培养箱中。
1.2.2 乙型肝炎病毒对PBMC的干预 以含血清及G418(0.2 μg/ml)的DMEM高糖培养基常规培养HepG 2.2.15细胞,3 d后收集培养上清液,Millipore-Amicon Ultra-15(100 kd)离心管,2 500 rpm离心25 min,调整HBV DNA含量>5×106IU/ml。对照组以全血清培养基加入培养4 h的PBMC中共培养;病毒组将含有乙型肝炎病毒的HepG2.2.15培养上清,以每孔病毒浓度为5×105IU/ml加入培养4 h的PBMC中共培养;分别在共培养4 h、8 h、12 h、24 h、36 h、48 h后收集培养上清进行细胞因子检测。
1.2.3 细胞因子检测 细胞因子检测采用流式多因子检测技术(CBA)。
1.3 统计学方法 数据统计分析采用SPSS 19.0 软件,计量资料以均值±标准差表示。同一时间点组间比较采用独立样本t检验;同组不同时间点比较采用单因素方差分析,如方差不齐采用Games-Howell。P<0.05为差异有统计学意义。
2 结果
2.1 空白对照组各细胞因子动态变化结果 空白对照组各细胞因子含量变化曲线较为平缓,IL-2、IL-17A含量随时间变化呈上升趋势48 h内未达到峰值;IL-4、IL-6含量达峰时间为36 h,IL-10为12 h,TNF-ɑ为8 h,IFN-γ为4 h;各因子各时间点含量较4 h均有不同程度差异(均P<0.05)。
2.2 病毒干预组各细胞因子动态变化 病毒干预组IL-2的含量随时间变化呈上升趋势48 h内未达到峰值;IL-4、IL-6、IL-10、IL-17A、IFN-γ、TNF-ɑ含量随时间变化呈先上升后下降趋势,其中IL-4、IL-17A、IFN-、TNF-ɑ含量达峰时间为8 h,IL-10为24 h,IL-6为36 h;各因子各时间点含量较4 h均有不同程度差异(均P<0.05)。
2.3 两组细胞因子变化 见表1~7。
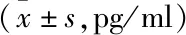
表1 IL-2检测结果
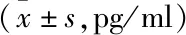
表2 IL-4检测结果
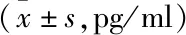
表3 IL-6检测结果
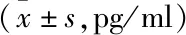
表4 IL-10检测结果
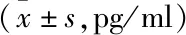
表5 IL-17A检测结果
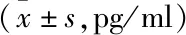
表6 TNF-ɑ检测结果
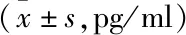
表7 IFN检测结果
3 讨论
细胞因子是由活化免疫细胞和非免疫细胞分泌的一种低分子可溶性蛋白质,具有调节免疫、血细胞生成、细胞生长以及损伤组织修复等多种功能。根据不同来源可分为淋巴因子(LK)、单核因子(MK)及非淋巴细胞、非单核因子,各类细胞因子通过旁分泌、自分泌或内分泌等方式发挥作用,形成了十分复杂的细胞因子调节网络,参与人体多种重要的生理功能。LK、MK主要参与了机体免疫的调控,在构建机体免疫防御、维持正常免疫平衡上发挥着重要的作用,细胞因子调节网络是纷繁复杂的,不但各因子之间、各因子与细胞之间相互关联、相互影响,同时又是动态变化的。因此,了解各个细胞因子分泌时间特征,将有助于了解机体免疫应答过程,准确选择药物干预时间节点,使实验研究更加准确有效。
Th1/Th2细胞因子在HBV侵入人体时发挥着重要的抗病毒作用,Th1细胞因子主要包括IL-2、IFN-、TNF-ɑ等,IL-2具有促进淋巴细胞生长、提高吞噬细胞的活性、刺激分泌免疫干扰素、诱导和增强自然杀伤细胞和细胞毒性T淋巴细胞的效应[10,11]。IFN-主要由活化T细胞产生,通过激活APC功能和巨噬细胞、NK、CTL细胞功能发挥抗病毒作用[12,13]。TNF-ɑ可杀伤肿瘤细胞、诱导炎症反应、增强CTL对靶细胞杀伤[14]。Th2细胞因子主要包括IL-4、IL-6、IL-10等。IL-4可促进B细胞的增殖分化、促进IgE、IgG的产生并抑制Th1分泌IFN-γ、IL-2等细胞因子,下调细胞免疫应答,诱导Th2细胞生成[15]。IL-6可促进B细胞增殖分化,合成分泌Ig,促进T细胞增殖分泌,参与炎症反应[16]。IL-10可抑制巨噬细胞功能,降低抗原递呈作用,减少单核因子生成;抑制Th1细胞分泌IL-2、IFN-γ等细胞因子,下调细胞免疫;促进B细胞增殖和抗体生成,上调体液免疫[17]。
研究发现Th1/Th2型细胞因子平衡失调,可导致HBV清除障碍,HBV感染慢性化可能与Th2细胞因子增高有关,IL-17A、TNF-ɑ的高表达可加重了肝脏炎症反应[9]。HBeAg可以明显抑制Th1型细胞因子IFN-γ的产生,促进Th2型细胞因子IL-6和IL-10分泌,上调外周血PBMC表面PD-1/PD-L1的表达,从而有利于形成对HBV感染的免疫耐受[8]。本实验结果证实HBV干预后PBMC分泌抗病毒因子IFN-γ减少,免疫抑制性因子IL-10、炎症因子IL-6、IL-17A、TNF-ɑ等均不同成都升高,与既往体内研究一致,同时观察了IL-2、IL-4、IL-6、IL-10、IL-17A、IFN-γ、TNF-ɑ各细胞因子分泌高峰和时间动态曲线,为进一步的药物干预选择合适的检测时间节点研究提供了参考。

