大黄素改善D氨基半乳糖胺造成的L02细胞损伤*
尹瑞英 魏飞力 胡建华
1.首都医科大学附属北京佑安医院中西医结合中心 (北京, 100069) 2.北京市肝病研究所
急性肝衰竭(ALF)是肝细胞急性损伤的严重后果,可在数天或数周内演变为致命结果。ALF的5个最普遍的原因是对乙酰氨基酚(APAP)过量、病毒性肝炎、药物性肝损伤、威尔逊病和自身免疫性肝炎[1]。ALF患者的管理包括一般考虑、病因特异性管理、给药缓解肝功能衰竭、急性肝功能衰竭的系统性并发症管理和肝移植[2]。ALF的治疗选择很少,但研究表明,当怀疑服用对乙酰氨基酚过量时,早期服用乙酰半胱氨酸可能会保护肝脏免受损伤[3]。然而,这种干预仅部分有效,并伴有不良反应,包括过敏性反应[4]。因此,对于急性肝功能衰竭患者,有必要寻找其他干预措施。
中医药在肝病的治疗中有悠久的历史,发挥了重大作用。中药单体具有潜在的治疗价值。大黄具有退黄、清热利湿效果,在肝病中应用广泛。大黄素是中药大黄的有效成分之一,具有抑制炎症反应、保护肝细胞的作用[5]。但是大黄素保护肝细胞的机制并不明确。我们应用网络药理学手段筛选大黄素保护肝损伤的潜在靶点,选择D-GalN作为诱导ALF的肝毒性药物[6],通过细胞实验验证大黄素作用的靶点和通路。
1 材料与方法
1.1 收集大黄素和急性肝损伤的潜在靶点 首先,在TCMSP网站查找大黄素的潜在靶点。其次,在GeneCards数据库以“Acute liver failure” 和“Fulminant Hepatic Failure”为关键词查找急性肝损伤的靶点基因。我们在UniProt数据库进一步找到基因的正式名称。通过韦恩图分析大黄素和急性肝损伤之间的靶点基因交集。
1.2 基因功能注释和KEGG通路分析 将韦恩分析得到的交集基因导入KOBAS数据库,选择物种为人,设置阈值为P<0.05。整个预测过程如图1所示。

图1 KEGG富集分析结果气泡图
1.3 试剂和抗体 人正常肝细胞(L02)购于中国科学院细胞库,D-GalN(G1639)购自Sigma公司,大黄素(Emodin)购自Abmol公司,二甲基亚砜购自Sigma公司,细胞凋亡试剂盒购自翌圣生物科技公司。
1.4 细胞培养 90% DMEM,10%胎牛血清配置培养基。对照组细胞以正常培养基培养,模型组细胞加入D-GalN作用12 h,治疗组细胞以特定浓度的大黄素溶解在二甲基亚砜中预处理细胞12 h,12 h后加D-GalN损伤肝细胞。
1.5 细胞增殖测试 CCK-8法检测L02细胞增殖活力,为确定D-GalN的最佳作用浓度和大黄素的治疗浓度,将L02细胞接种于96孔培养板内,每孔细胞数5 000个,在37℃、体积分数为5% CO2培养箱中培养12 h,分别用0、5、10、25、50 μmol/L大黄素溶液处理细胞。24 h时分别加入10、20、30、40、50 mmol/L D-GalN溶液处理细胞。在干预12 h后,用CCK-8在全自动酶标仪上检测450 nm波长处各孔的吸光度值,计算各组细胞增殖活力,确定最佳作用浓度。
1.6 实时荧光定量PCR 用Trizol法抽提总RNA,经过逆转录反应合成cDNA,以cDNA为模板进行PCR扩增,体系(20 μl)为SYBR Green Mix 10 μl,正向、反向引物各0.8 μl,无菌无酶水6.4 μl,cDNA模板2.0 μl;反应条件为98℃预变性30 s,98℃变性5 s,60℃退火30 s,循环40次。以β-actin为内参,采用2^-CT法计算目的基因mRNA相对表达,设置3个复孔。
1.7 流式细胞术 将人肝细胞接种到6孔板内,每孔细胞数5×103个。按照1.4中分组方法处理,磷酸缓冲盐溶液洗涤后,将细胞悬浮在100 μl的结合缓冲液中,加入膜联蛋白V-FITC(annexin V-FITC)10 μl、碘化丙啶(PI)5 μl,室温结合15 min,加入400 μl结合缓冲液置于冰上,流式细胞仪检测。
1.8 蛋白印迹法测定L02细胞BCL2、Cleaved-Caspase-3水平从L02细胞中提取总蛋白,BCA法检测蛋白含量,十二烷基硫酸钠聚丙烯酰胺凝胶电泳分离蛋白,转膜封闭孵一抗(Cleaved-Caspase-3、BCL2、β-actin,稀释倍数1∶1 000),4℃过夜,洗膜,孵二抗,室温下孵育2 h,洗膜,曝光显色,凝胶成像系统分析蛋白的相对表达情况。

2 结果
2.1 大黄素治疗急性肝衰竭的基本靶点分析 通过TCMSP数据库共收集到34个大黄素的作用靶点。然后通过Genecard数据库收集9 445个急性肝衰竭相关靶点。韦恩分析显示,大黄素和急性肝衰竭之间共有29个交集靶点(见表1)。
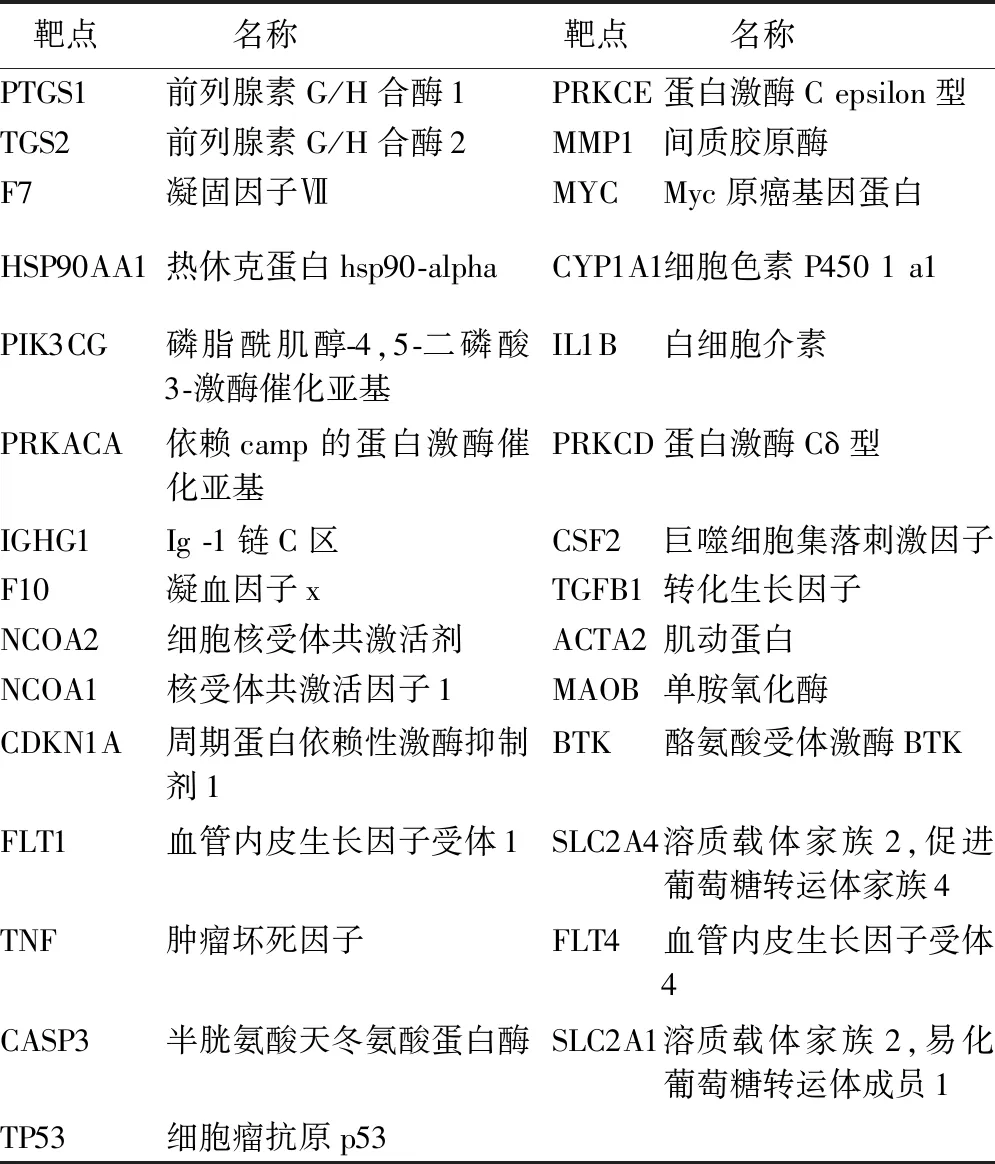
表1 大黄素与急性肝衰竭的共同靶点
2.2 基因功能注释及KEGG通路富集分析 KOBAS是富集分析的在线数据库,可以进行基因功能注释和GO富集分析。大黄素与急性肝损伤交集基因的功能注释结果显示,大黄素与丝裂原活化蛋白激酶(MAPK)级联、细胞凋亡、蛋白功能修饰相关。KEGG富集分析表明,大黄素具有广泛的药理作用,涉及的通路包括非洲锥虫病、甲状腺癌、IL-17信号通路、AGE-RAGE信号通路、糖尿病并发症、Ⅱ型糖尿病、苯丙氨酸代谢、色氨酸代谢、胰岛素抵抗、组氨酸代谢、松弛素信号通路、雌激素信号通路、原发性免疫缺陷、补体和凝血级联、血小板活化(图1)。提示相关疾病和通路是相互关联的,说明大黄素通过协调不同的生物学过程发挥保护急性肝损伤的功能。我们对与细胞凋亡和糖代谢相关的基因进行细胞实验验证。
2.3 细胞增殖实验 CCK8检测结果表示,与空白培养基组相比,D氨基半乳糖胺药物浓度大于40 mmol/L时,对L02细胞的损伤作用明显,细胞存活率明显下降(P<0.001)。我们选取40 mmol为D氨基半乳糖胺的造模剂量。大黄素>25 μmol/L时细胞抑制作用明显,因此我们选取对细胞存活率无影响的5、10 μmol/L作为治疗剂量。大黄素剂量为10 μmol/L时对D氨基半乳糖胺造成的肝细胞生长抑制作用有明显的逆转作用。(图2)。

图2 各组细胞增殖结果
2.4 实时荧光定量PCR qRT-PCR检测SLC2A1、SLC2A4和Caspase-3表达水平,与对照组相比较,D氨基半乳糖胺模型组的SLC2A1、Caspase-3基因水平上调,而SLC2A4水平下调。大黄素治疗组mRNA水平与D-GalN模型组相比SLC2A1、Caspase-3显著变化下调(*P<0.05,**P<0.01,***P<0.001),见图3。
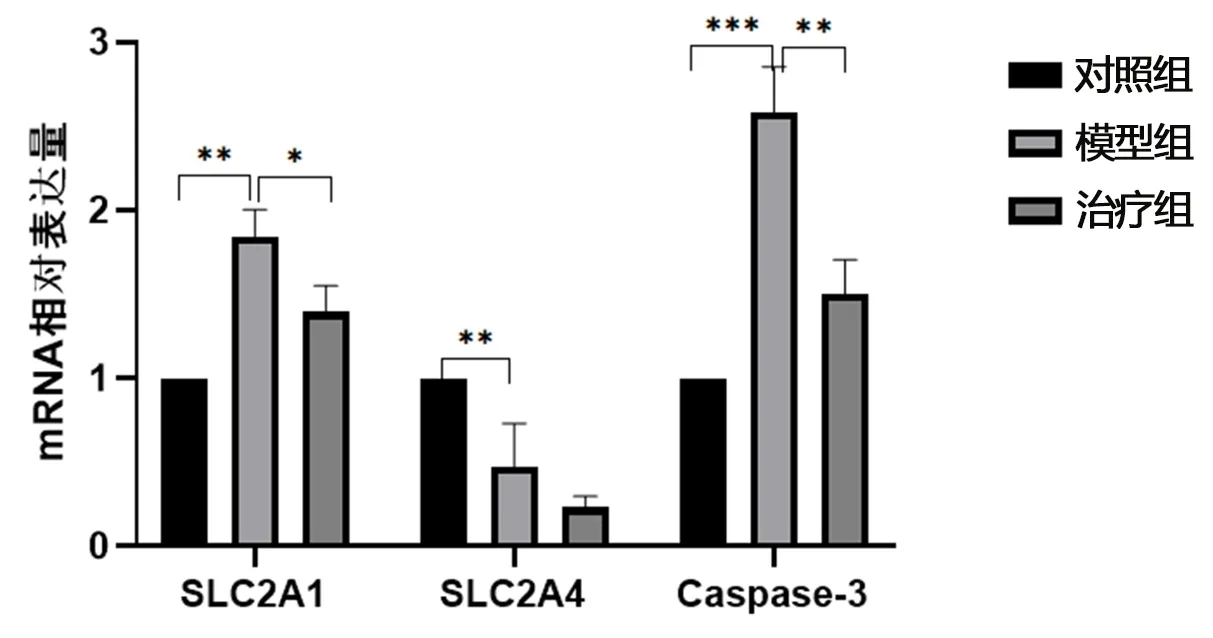
图3 各组细胞mRNA相对表达量
2.5 各组细胞凋亡情况 流式细胞术结果显示,与对照组相比D-GalN模型组细胞总凋亡率显著增加(P<0.001),总凋亡细胞比例从(4.82±1.10)%增加至(29.76±1.83)%,与D-GalN模型组相比,大黄素治疗组细胞凋亡率降低至(18.29±1.10)%(P<0.001 )。Q1:机械损伤;Q2:晚期凋亡;Q3:正常;Q4:早期凋亡;总凋亡=Q4+Q2。见图4。

图4 各组细胞凋亡情况
2.6 蛋白表达水平 与对照组相比,D-GalN模型组Cleaved-Caspase-3蛋白表达增加,而大黄素干预可使损伤肝细胞组的Cleaved-Caspases-3蛋白表达降低,大黄素治疗后BCL2蛋白表达上调(图5) 。

图5 Cleaved-Caspases-3和BCL2蛋白表达情况
3 讨论
网络药理学结果提示急性肝衰竭是一个多通路参与的、复杂的病理生理过程,大黄素可能通过激活细胞凋亡信号通路、Ⅱ型糖尿病信号通路、苯丙氨酸代谢信号通路、色氨酸代谢信号通路等多个通路发挥抗肝损伤的作用。肝细胞凋亡是一种重要的肝细胞死亡形式。肝细胞凋亡是急性肝衰竭早期的一种重要病理学表现。BCL2是抑癌基因,激活BCL2减少细胞内氧自由基的产生,抑制线粒体途径的细胞凋亡,抑制Caspase3表达[7]。 Caspase3是多种凋亡刺激信号传递最主要的终末执行酶,其以无活性前体存在于细胞中,当细胞进入凋亡时被激活,从而进入细胞核中执行凋亡效应,使得染色质凝集、DNA片段化、凋亡小体形成[8]。大黄素拮抗D-GalN引起的肝细胞增殖抑制可能与上调BCL2蛋白表达,抑制肝细胞凋亡相关。
急性肝衰竭低血糖风险增加,通常通过静脉输注葡萄糖预防[9]。葡萄糖主要通过溶质-载体基因家族SLC2A1进入细胞,SLC2A1过表达促进葡萄糖转运至细胞,加快糖酵解产生的乳酸排出细胞,促进细胞凋亡[10]。我们的研究也证实了急性肝损伤发生时SLC2A1表达上调、SLC2A4表达下调。与D氨基半乳糖胺模型组相比,大黄素治疗后SLC2A1表达量下调,细胞凋亡率降低。因此,推测大黄素减轻肝损伤的作用可能与抑制SLC2A1的表达,减少细胞摄入葡萄糖,减缓乳酸排除相关。
本实验结果显示,大黄素能对抗D氨基半乳糖胺导致的肝细胞增殖抑制,上调BCL2蛋白表达,减少Cleaved-Caspase-3的表达,抑制基因SLC2A1和Caspase-3表达,表明大黄素可能通过调节BCL2和SLC2A1多途径发挥抗凋亡作用,从而减轻D氨基半乳糖胺所致肝细胞损伤。大黄素减轻急性肝损伤的机制可能为临床缓解急性肝衰竭和低血糖并发症提供一种潜在的新途径。

