松露多酚的提取纯化工艺研究
李美凤 赵建伟 王晓雅 郭力


摘要:采用正交试验法优化松露多酚的提取工艺,探究提取温度、提取时间、料液比、乙醇浓度4个因素对多酚得率的影响,确定松露多酚的最佳提取工艺,并用大孔吸附树脂对得到的粗多酚进行初步的纯化。结果显示,最佳提取工艺为乙醇浓度60%、料液比1∶30 (g/mL)、提取温度70 ℃、提取时间40 min,此时提取率为6.17 mg/g。经大孔树脂纯化后,多酚纯度由11.13%提高到47.59%。研究结果表明,松露多酚超声辅助提取工艺具有提取时间短、工艺简单、提取率较高的优点,为后续食用菌多酚的提取、分离和纯化奠定了试验基础和相关数据。
关键词:松露;多酚;超声辅助提取;提取工艺;纯化
中图分类号:TS201.2 文献标志码:A 文章编号:1000-9973(2023)05-0131-05
Abstract: Orthogonal test method is used to optimize the extraction process of truffle polyphenols, and the effects of four factors including extraction temperature, extraction time, solid-liquid ratio and ethanol concentration on the yield of polyphenols are investigated to determine the optimal extraction process of truffle polyphenols. The crude polyphenols are preliminarily purified by macroporous adsorption resin. The results show that the optimal extraction process is ethanol concentration of 60%, solid-liquid ratio of 1∶30 (g/mL), extraction temperature of 70 ℃, extraction time of 40 min. At this time, the extraction yield is 6.17 mg/g. After purification by macroporous resin, the purity of polyphenols increases from 11.13% to 47.59%. The results show that the ultrasonic-assisted extraction process of truffle polyphenols has the advantages of short extraction time, simple process and high extraction yield, which has laid an experimental basis and relevant data for the subsequent extraction, separation and purification of polyphenols from edible fungi.
Key words: truffle; polyphenols; ultrasound-assisted extraction; extraction process; purification
收稿日期:2022-11-29
基金项目:四川省科技基础条件平台项目(2019JDPT0032)
作者简介:李美凤(1986-),女,博士,研究方向:药食两用资源开发利用。
*通信作者:王曉雅(1995-),女,硕士,研究方向:中药药效物质基础;
郭力(1964-),男,教授,博士,研究方向:中药药效物质基础。
松露(truffle),又名块菌、猪拱菌、无娘果,隶属于子囊菌门,是通过感染植物地下根系而形成的一种外生菌根真菌,主产于欧洲各地,在我国主要分布于四川、云南等地[1-4]。松露是一种商品价值较高的药食同源真菌[5-6],具有独特的风味和口感,且富含多种氨基酸、蛋白质、多酚、维生素、矿物质等物质[7]。此外,松露含有多种活性物质,如松露多糖、多酚、α-雄烷醇等,具有抗氧化、抗炎、抗病毒、抗肿瘤、抗氧化、免疫调节等功效[8-9]。课题组前期已完成对松露多糖的提取分离、纯化及结构鉴定,并对不同产地松露的营养价值做了全面评价[10-11],本文主要对松露中多酚的提取、纯化工艺进行研究。
多酚是一类产生于植物代谢过程中的次生产物[12]。真菌多酚具有多种生物活性,包括抗氧化、抑菌、抗病毒等,已有研究表明,茶薪菇多酚类提取物能减缓自由基对小鼠脏器的损害[13-16];氧化型茶多酚能改变高脂饮食老年大鼠的肠道微生物群落结构,从而改善其健康状况[17]。目前对多酚提取方法的研究多采用常规提取法、超声提取法[18-19],本文采用超声提取法研究松露多酚的最佳提取工艺,由于多酚粗提取含有较多的杂质,因此后续将继续对其进行分离纯化,以获得纯度更高的多酚类物质,并评价其生理活性。本文探讨了松露多酚的提取工艺及纯化方法,为松露多酚的进一步研究和在功能性产品中的应用提供了理论研究和相关数据支撑。
1 材料和方法
1.1 材料与试剂
松露:购于四川会东县嘎吉村,经成都中医药大学龙飞副教授鉴定为印度块菌Tuber indicum。
没食子酸:购于成都瑞芬思生物科技有限公司;NKA-9:购于天津浩聚树脂科技有限公司;SP-700、D-101、S-8、HPD-100:均购于天津光复精细化工研究所;福林酚试剂:购于美国Sigma公司;无水碳酸钠、无水乙醇:均为分析纯,购于成都科龙化工试剂厂。
1.2 主要仪器与设备
101-2AB型电热恒温鼓风干燥箱 北京中兴伟业仪器有限公司;KM-500DE型超声波清洗仪 昆山美美超声仪器有限公司;ZYCGE-Ⅱ-10T超纯水机 四川卓越水处理设备有限公司;HTX-2酶标仪 美国Bio-Tek公司;H1850型台式高速离心机 湖南湘仪离心机仪器有限公司;BP211DAG型分析天平 德国赛多利斯公司;RE-52AA型旋转蒸发仪 上海亚荣生化仪器厂。
1.3 方法
1.3.1 原材料的预处理
将新鲜松露清洗切片,烘干粉碎后过80目药筛备用。
1.3.2 多酚含量的测定[20]
准确称取没食子酸标准品10 mg,用去离子水溶解并定容至100 mL,即为没食子酸标准溶液。精密吸取没食子酸标准溶液0.0,0.1,0.2,0.4,0.6,0.8 mL于10 mL容量瓶中定容,再分别吸取0.2 mL稀释后的溶液,加入1.0 mL 10%福林酚溶液,混匀后加入2.8 mL 7.5%饱和碳酸钠溶液,混匀后室温放置30 min,在750 nm处测定吸光度值。根据吸光度值与各溶液的没食子酸浓度绘制标准曲线,所得线性方程为y=0.007 1x+0.005 26,R2 =0.998。按照式(1)计算多酚得率:
W=C·V·Nm。(1)
式中:W为松露多酚得率,mg/g;C为根据标准曲线计算所得的提取液中多酚浓度,mg/mL;V为提取液的总体积,mL;N为稀释倍数;m为松露干粉的质量,g。
1.3.3 单因素试验
称取松露干粉1.00 g,以乙醇水溶液作为提取溶剂超声提取,单因素试验设计分析料液比(1∶15、1∶20、1∶25、1∶30、1∶35,g/mL)、提取时间(20,30,40,50,60 min)、提取温度(50,55,60,65,70 ℃)、乙醇浓度(60%乙醇-水、65%乙醇-水、70%乙醇-水、75%乙醇-水、80%乙醇-水)对多酚得率的影响。
1.3.4 正交试验
以单因素试验结果为依据,选取料液比、提取时间、提取温度、乙醇浓度4个因素作为自变量,每个因素中最佳的3个变量为正交试验的3个水平,以松露多酚提取率为评价指标,设计四因素三水平正交试验,见表1。
1.3.5 松露多酚的分离纯化
1.3.5.1 大孔吸附树脂的预处理
用无水乙醇对D-101、NKA-9、SP-700、HPD-100和S-8树脂进行洗涤,静置12 h,除去漂浮的杂质和树脂碎片,之后用无水乙醇冲洗至澄清透明,再用蒸馏水将大孔树脂冲洗至无醇味,再将大孔树脂分别用5%的盐酸溶液浸泡4 h,用蒸馏水洗至中性后,再用5%的NaOH溶液浸泡4 h,用蒸馏水冲洗至中性后直接使用或浸泡在无水乙醇中,储存备用[21]。
1.3.5.2 大孔吸附树脂吸附容量和解吸率的测定
称取2.0 g活化处理后的D-101、NKA-9、SP-700、HPD-100和S-8大孔树脂,置于250 mL锥形瓶中,加入100 mL已知浓度的松露多酚粗提液,置于25 ℃、150 r/min的恒速振动器上振荡8 h以达到吸附平衡状态。吸附完成,倒出上层样品液,用去离子水将吸附多酚后的树脂洗涤2~3次,加入60%乙醇洗脱液100 mL,在25 ℃、150 r/min条件下振荡4 h,解吸被吸附的多酚。
采用福林-酚法分别测定吸附处理后的粗提液以及60%乙醇洗脱液中总多酚的含量。采用上述静态吸附试验方法分别考察大孔树脂的吸附容量和解吸率,比较两种指标的测定结果,选择吸附容量大、解吸率高的大孔树脂用于后续多酚的分离纯化。根据式(2)、式(3)、式(4)分别计算大孔树脂的吸附容量、吸附率、解吸率:
吸附容量=C0-C1。(2)
吸附率=C0-C1/C0×100%。(3)
解吸率=解吸液中多酚含量吸附容量。(4)
式中:C0為吸附前原液多酚含量,μg/mL;C1为吸附后原液多酚含量,μg/mL。
1.3.5.3 松露多酚的纯化
采用SP-700大孔树脂湿法装柱,将松露多酚粗提液过柱进行分离纯化。按照纯水、20%乙醇-水、40%乙醇-水、60%乙醇-水、80%乙醇-水梯度洗脱,流速为2 mL/min,直至馏分不含松露多酚为止。根据式(5)计算松露多酚纯度:
纯度=纯化后的多酚含量粗提液干燥后的多酚含量×100%。(5)
1.4 数据处理
本试验数据采用SPSS Statistics 25.0统计软件进行统计分析,结果以平均值±标准差表示,并通过GraphPad Prism 8.0软件绘图,差异分析中,“*”表示差异显著(P<0.05),“**”表示差异极显著(P<0.01)。
2 结果与讨论
2.1 单因素试验结果
2.1.1 料液比对多酚提取率的影响
不同料液比对多酚提取率的影响结果见图1。
由图1可知,随着料液比的增加,提取液中多酚的含量明显增加,当料液比为1∶25时,松露多酚的提取率最高,为4.47 mg/g,但当料液比超过1∶25时,提取液中多酚的含量开始降低。原因可能是溶剂量较低时,样品和溶剂的接触不充分,导致提取不完全,适当地增加溶剂量有利于提取的进行[22-23]。当溶剂量过高时,松露中其他醇溶性杂质的溶出会增加,从而降低了提取液中多酚的含量。因此,选择1∶25、1∶30、1∶35 (g/mL)进行正交试验以确定最佳的料液比。
2.1.2 提取时间对多酚提取率的影响
由图2可知,当提取时间从20 min增加到50 min时,溶液中多酚的含量明显增加,但提取时间超过50 min时,提取液中多酚的含量明显下降,原因可能是提取时间过长,提取液中的多酚可能会被氧化,导致提取率降低。因此,选择30,40,50 min进行正交试验以确定最佳的提取时间。
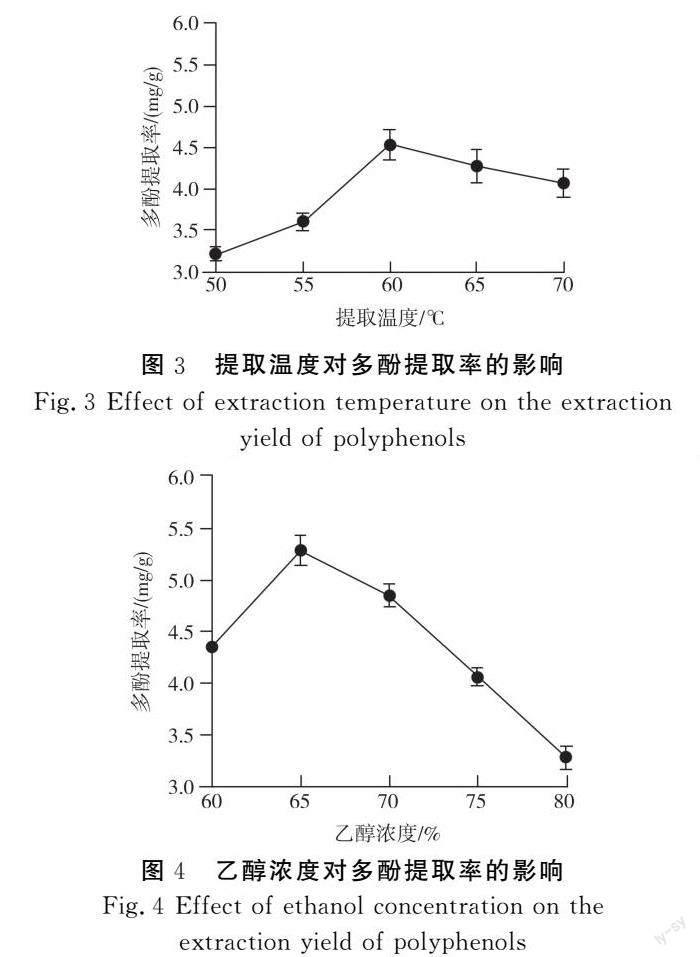
2.1.3 提取温度对多酚提取率的影响
由图3可知,提取温度由50 ℃上升至60 ℃时,多酚含量明显上升,并在60 ℃时提取率最大,为4.53 mg/g。当温度超过60 ℃后,松露多酚的提取率逐渐缓慢下降,但提取率明显高于55 ℃和50 ℃时的提取率。可能是在较低温度下,多酚溶出速率较慢,适当提高温度增加了多酚的溶出速率;而当温度增加到60 ℃以上时,可能由于较高的温度使多酚发生氧化或分解,因而多酚得率降低。因此,选择60,65,70 ℃进行正交试验以确定最佳的提取温度。
2.1.4 乙醇浓度对多酚提取率的影响
由图4可知,当提取剂中乙醇浓度从60%增加到65%时,提取液中多酚含量明显增加,达到最高,为5.28 mg/g。当提取剂中乙醇浓度继续增加后,提取液中多酚含量开始逐渐下降。出现这种情况可能是因为适当增加乙醇浓度会促进多酚物质的溶出,但当乙醇浓度过高时对多酚物质的溶出会产生不利的影响。因此,选择60%、65%、70%进行正交试验以确定提取剂中乙醇的最佳浓度。
2.2 正交试验结果
对料液比(A)、提取时间(B)、提取温度(C)和乙醇浓度(D)进行正交试验分析。由表2可知,4个因素对提取液多酚含量影响的主次顺序为提取温度>提取时间>乙醇浓度>料液比。最佳提取条件是A2B2C3D1,即料液比为1∶30(g/mL),提取时间为40 min,提取温度为70 ℃,乙醇浓度为60%,此时多酚提取率为6.17 mg/g,与郭坦等[24]通过乙醇回流提取得到的粗多酚提取率7.5%相近。
2.3 大孔树脂筛选结果
由表4可知,进行筛选的5种大孔树脂中D-101与S-8的解吸率虽然很高,但是吸附容量却只有另外3种树脂的1/3左右,根据文献报道得知[25],为了使粗提液的纯化具有较好的效果,选择的树脂应当具有较大的吸附容量和较高的解吸率,因此选择SP-700进行后续的多酚纯化试验。
2.4 大孔树脂纯化结果
由图5可知,测定吸光度值时,确定其多酚含量为38.23 mg,经干燥后得到的总质量为80.33 mg,纯化后多酚的纯度为47.59%,纯度提高了4.27倍。
3 结论
本研究对超声提取松露多酚的工艺进行了优化,最佳提取工艺为料液比1∶30 (g/mL)、提取时间40 min、提取温度70 ℃、乙醇浓度为60%,在最佳提取条件下,松露多酚得率最大,为6.17 mg/g。同时对5种大孔吸附树脂的吸附率和解吸率进行比较,最终选择SP-700对提取的粗多酚进行纯化,经过SP-700大孔樹脂的处理,多酚纯度由11.13%提升到了47.59%。本文得到的超声辅助提取松露多酚的工艺具有提取时间短、工艺简单、提取率较高的优点,为后续松露多酚的提取、分离及纯化奠定了理论基础,为松露多酚进一步的开发利用提供了相应的试验依据。
参考文献:
[1]蔡佳仲,黄珍珍,周娟,等.国产松露乙醚提取物的GC-MS分析[J].天然产物研究与开发,2012,24(9):1242-1245.
[2]陈以丽.种植松露产业助力永胜脱贫攻坚[J].现代农村科技,2019(2):98-99.
[3]叶雷,付雨,邹捷,等.四川3种商业块菌内生真菌的分离及鉴定[J].中国农学通报,2018,34(24):57-63.
[4]张智超,王宏越,路晓玉.块菌的研究现状及药用价值[J].当代化工研究,2018(11):169-170.
[5]CATEL-FERREIRA M, TNANI H, HELLIO C, et al. Antiviral effects of polyphenols:development of bio-based cleaning wipes and filters[J].Journal of Virological Methods,2015,212:1-7.
[6]VILLARES A, GARCIA-LAFUENTE A, GUILLAMON E, et al. Identification and quantification of ergosterol and phenolic compounds occurring in Tuber spp.truffles[J].Journal of Food Composition and Analysis,2012,26(1-2):177-182.
[7]CLAGHORN G C, THOMPSON Z, WI K, et al. Caffeine stimulates voluntary wheel running in mice without increasing aerobic capacity[J].Physiology & Behavior,2017,170:133-140.
[8]BARROS L, FERREIRA M J, QUEIROS B, et al. Total phenols, ascorbic acid, beta-carotene and lycopene in Portuguese wild edible mushrooms and their antioxidant activities[J].Food Chemistry,2007,103(2):413-419.
[9]呼鑫荣,熊海宽,薛文通.松露的组成成分及功能活性研究进展[J].食品工业科技,2017,38(22):341-345,352.
[10]李美凤,刘娟汝,陈艳,等.3个不同产地的松露氨基酸组成及营养价值评价[J].食品工业,2021,42(1):342-346.
[11]李美凤,袁明昊,邹仕赟,等.松露多糖的提取、分离纯化和结构鉴定[J].食品与发酵工业,2020,46(16):196-200.
[12]任彩君,吴黎明,王凯.膳食多酚对肠道菌群影响研究进展[J].食品工业科技,2022,43(1):400-409.
[13]马倩.植物性多酚多糖体外抗病毒作用的初步研究[D].兰州:甘肃农业大学,2018.
[14]吴俐,翁敏劼,李怡彬,等.茶薪菇酚类提取物的抗氧化功效评价[J].中国食品学报,2021,21(1):96-102.
[15]杨育静,曾珍.植物多酚抑菌机制及其在肉和肉制品中的应用[J].东北农业大学学报,2021,52(2):87-94.
[16]余海尤,曹春蕾,崔宝凯.忍冬木层孔菌液体培养过程中多酚含量及抗氧化活性研究[J].菌物学报,2012,31(6):933-939.
[17]张蒙,聂妍,颜平,等.氧化型茶多酚对高脂饮食老年大鼠肠道微生物的影响[J].基因组学与应用生物学,2022,41(3):577-586.
[18]曾媛媛,仝濤,黄昆仑.石莼多酚的提取工艺、组成成分分析及生物活性评价的研究进展[J].食品工业科技,2021,42(20):384-390.
[19]穆谈航,叶嘉,杨明建,等.石榴皮多酚提取工艺优化及其贮藏稳定性研究[J].食品工业科技,2021,42(11):142-146.
[20]张梅梅,魏志文,刘玉冰,等.Folin-Ciocalteu比色法测定桦褐孔菌多酚的条件优化[J].菌物学报,2011,30(2):295-304.
[21]张娟梅.玫瑰花渣中多酚的超声辅助提取制备、组分分析及其生物活性研究[D].南京:南京农业大学,2014.
[22]闫旭宇,李娟,任潘,等.银杏叶多酚超声辅助提取工艺及其对羟自由基的清除作用[J].食品研究与开发,2020,41(19):99-104.
[23]祝敏,展俊岭,高子怡,等.夏枯草多酚超声辅助提取及其抗氧化活性研究[J].中国食品添加剂,2018(12):136-142.
[24]郭坦,侯成林,魏磊,等.印度块菌提取物抗氧化活性的研究[J].菌物学报,2010,29(4):569-575.
[25]冀德富,郭东艳,崔春利,等.纯化叶下珠总多酚的大孔树脂筛选研究[J].山西中医学院学报,2009,10(5):20-21.

