赤潮异弯藻对CO2浓度、温度和营养盐变化的响应
杨安强, 赵丽侠, 宋淑贞, 刘 倢, 何彦龙, 王艳娜
(1. 华东师范大学 河口海岸学国家重点实验室, 上海 200241; 2. 自然资源部 东海生态中心, 上海 201206; 3. 自然资源部 海洋生态监测与修复技术重点实验室, 上海 201206;4. 卑尔根大学 生物科学系, 卑尔根 N-5020, 挪威;5. 长江三角洲河口湿地生态系统教育部/上海市野外科学观测研究站, 上海 202162)
0 引言
自工业革命以来, 人类活动特别是化石燃料的燃烧导致全球大气中CO2含量不断上升. 根据联合国政府间气候变化专门委员会 (intergovernmental panel on climate change, IPCC) 预测, 到21世纪末, 大气CO2浓度(一百万体积的空气中CO2的体积数)将由现在的416 ppm上升到1000 ppm[1]. 海洋作为大气CO2最大的汇, 约1/3的大气CO2增量被海洋吸收, 导致海水pH值降低, 这一现象被称为海洋酸化[2]. 全球海洋平均pH值已经下降了0.1个单位, 预计到21世纪末还将下降0.4个单位[2]. 目前, 我国近岸海域已监测到了海水酸化现象[3-5]. 同时, CO2等温室气体的增加导致全球气候变暖, 预计到21世纪末全球平均温度将升高2 ~ 4℃ (相对于1990—1999年的平均气温)[2]. 2021年IPCC发布的报告中指出, 在人为大量排放温室气体的情景下, 全球平均温度将在21世纪末升高2.8 ~ 5.7℃[6].全球变暖将会加剧海洋水体层化: 一方面, 这会阻碍营养盐从底部向上输送至表层供浮游植物利用;另一方面, 混合层变浅, 使浮游植物暴露在更多的太阳辐射下, 影响海洋初级生产力的生产[7].
浮游植物是海洋中重要的初级生产者, 海洋浮游植物对CO2浓度升高和气候变暖的响应一直是研究的热点. CO2浓度升高对不同浮游植物的影响不同, 但对于多数有害藻华种的生长是有利的. 例如: 增加CO2浓度可以显著提升赤潮异弯藻 (Heterosigma akashiwo)[8]、短凯伦藻 (Karenia brevis)[9]、血红哈卡藻 (Akashiwo sanguinea)[10]和米氏凯伦藻 (Karenia mikimotoi)[11]等的比生长速率. CO2浓度升高还将促使有害藻华种逐渐成为浮游植物群落中的优势种[12]. 此外, 气候模型预测结果显示, 随着温度的上升, 北大西洋和太平洋的产毒有害藻华种会季节性向北扩张[13]. 因此, CO2浓度升高和气候变暖均有利于多数有害藻华种的生长和繁殖, 从而加剧河口及近岸暴发有害藻华的风险[14].
赤潮异弯藻是一种针胞藻纲的有害藻华种, 广泛分布在近岸海域, 是日本[15]、美国[16]、加拿大[17]及我国近岸海域[18-21]常见的赤潮种. 由于该藻可以产生鱼毒素, 对鱼类和贝类有致死作用, 这种藻华的爆发往往会造成海洋渔业和生态资源的巨大损失[22]. 目前已有大量研究通过营养盐控制实验[16,23-25], 探究了赤潮异弯藻对富营养化的响应, 但是营养盐浓度的设定往往比实际海洋环境中的浓度高出几个数量级. 然而, 营养盐浓度的变化会影响细胞的生理、生长状态, 例如: 低营养盐条件可抑制浮游植物的与温度相关的代谢速率[26]. Hennon等[27]研究发现, 在营养盐充足的条件下, 赤潮异弯藻对CO2浓度升高的响应呈非线性, 然而在低营养浓度下这种关系是否成立还有待进一步探讨. 因此, 本文参考我国长江口邻近海域的营养盐浓度水平, 以及当前和21世纪末 (预测) 的CO2浓度和温度变化情况, 在不同的营养盐浓度 (氮、磷)、CO2浓度和温度条件下, 探讨了赤潮异弯藻的生长变化. 通过该研究, 以期进一步理解赤潮异弯藻爆发藻华的机制, 为预警和防控赤潮异弯藻藻华爆发提供科学参考.
1 材料和方法
1.1 实验藻种及培养方法
实验所用赤潮异弯藻藻种 (CCMA-266) 由厦门大学提供, 该藻株于2010年5月分离自长江口邻近海域. 采用由人工海水配置的无硅f/2培养基, 将藻种培养在人工光照培养箱内 (GXZ-280D), 温度设置为20℃, 光照强度为200 µmol·m–2·s–1, 光照黑暗周期为12 h∶12 h. 实验前, 将赤潮异弯藻在对数生长期反复传代培养, 使其保持较高的细胞活性和良好的细胞状态.
1.2 实验设计
为探究赤潮异弯藻对CO2浓度和温度变化的响应, 本研究设计了具有不同CO2浓度和温度的3组实验, 分别为: 实验1, 为当前大气CO2浓度和当前长江口邻近海域春末海表温度[28](CO2浓度为430 ppm, 温度为20℃); 实验2, 为IPCC预测的21世纪末CO2浓度和当前长江口邻近海域春末海表温度 (CO2浓度为1000 ppm, 温度为20℃); 实验3, 为预测的21世纪末的CO2浓度和长江口邻近海域春末海表温度 (CO2浓度为1000 ppm, 温度为25℃) (图1). 此外, 为探究营养条件对赤潮异弯藻生长的影响, 本研究参考了长江口邻近海域的营养盐浓度水平[29], 在每组实验中设置了4种营养盐组合(图1), 分别为: 高氮高磷(high nitrogen and high phosphorus concentration, HNHP) (N浓度为30 µmol·L–1, P浓 度 为1 µmol·L–1)、高 氮 低 磷(high nitrogen and low phosphorus concentration,HNLP) (N浓度为30 µmol·L–1, P浓度为0.5 µmol·L–1)、低氮高磷(low nitrogen and high phosphorus concentration, LNHP) (N浓度为15 µmol·L–1, P浓度为1 µmol·L–1)和低氮低磷(low nitrogen and low phosphorus concentration, LNLP) (N浓度为15 µmol·L–1, P浓度为0.5 µmol·L–1).

图1 实验设计示意图Fig. 1 Diagram of experimental setup
实验所使用的培养基均以人工海水为基底, 其微量元素和维生素浓度与f/2培养基保持一致, 根据实验设计添加不同浓度的氮和磷. 培养基经水下紫外灯照射30 min后, 取3 L用0.22 µm的无菌滤膜过滤至已灭菌的4 L高硼硅玻璃瓶中, 每个处理组分别过滤3瓶. 取适量 (大约20 mL) 预培养的赤潮异弯藻细胞接种至3 L培养基中, 并使初始细胞密度达到1000 cells·mL–1. 实验采用一次性批培养方法开展. 实验过程中, CO2浓度由二氧化碳培养箱 (GXZ-280D-CO2) 调控, 并用气泵将含不同CO2浓度的混合气体以100 mL·min–1的速度通入培养瓶. 同时, 培养箱调控实验所需的温度, 设定光照强度均为200 µmol·m–2·s–1、光暗时常为12 h∶12 h.
1.3 生长测定
从实验起始, 每隔24 h取5 mL样品, 用颗粒成像分析仪 (FlowCAM 8400, Fluid Imaging Technologies) 测定细胞密度. 比生长速率 (µ, d–1)计算公式为
式中:N1和N2分别表示t1和t2时的细胞密度; 根据细胞密度及增长率, 判断不同培养条件下赤潮异弯藻对数生长期的开始时间 (t1) 和结束时间 (t2).
1.4 叶绿素测定
在培养实验的第6天, 取20 mL 样品过滤到0.7 µm孔径的 GF/F (Whatman®) 膜上, 将膜对折放入15 mL离心管, 避光保存在 –20℃的冰箱备用. 叶绿素测定前, 在含样品的离心管中加入5 mL 90%的丙酮溶液, 在4℃条件下提取24 h后在4℃、5000 r/min条件下离心10 min. 离心后取上清液,用叶绿素荧光仪 (Trilogy Laboratory Fluorometer 7200-000, Turner Designs, USA) 测定叶绿素含量.
1.5 数据分析
本文统计数据均为平均值±标准误差 (n= 3) 的形式. 利用Origin软件 (版本9.5.0) 中的内置函数“Extreme”“Logistic”或者“Logistpk”分析各实验组细胞密度随时间的变化情况. 利用R软件 (版本4.0.3) 中的方差分析及Fisher最小显著差检验法 (least significant difference, LSD) 分别分析不同营养盐浓度、CO2浓度和温度条件对赤潮异弯藻细胞密度、比生长速率和叶绿素含量的影响.
2 结果
2.1 赤潮异弯藻在不同营养盐条件下的生长情况
每组实验共进行了9 d, 所有实验组中赤潮异弯藻表现出相似的生长过程, 即细胞密度先增大后减小. 培养中后期, 细胞密度均表现出显著差异, 并且与磷浓度有显著的相关性 (图2, 表1).
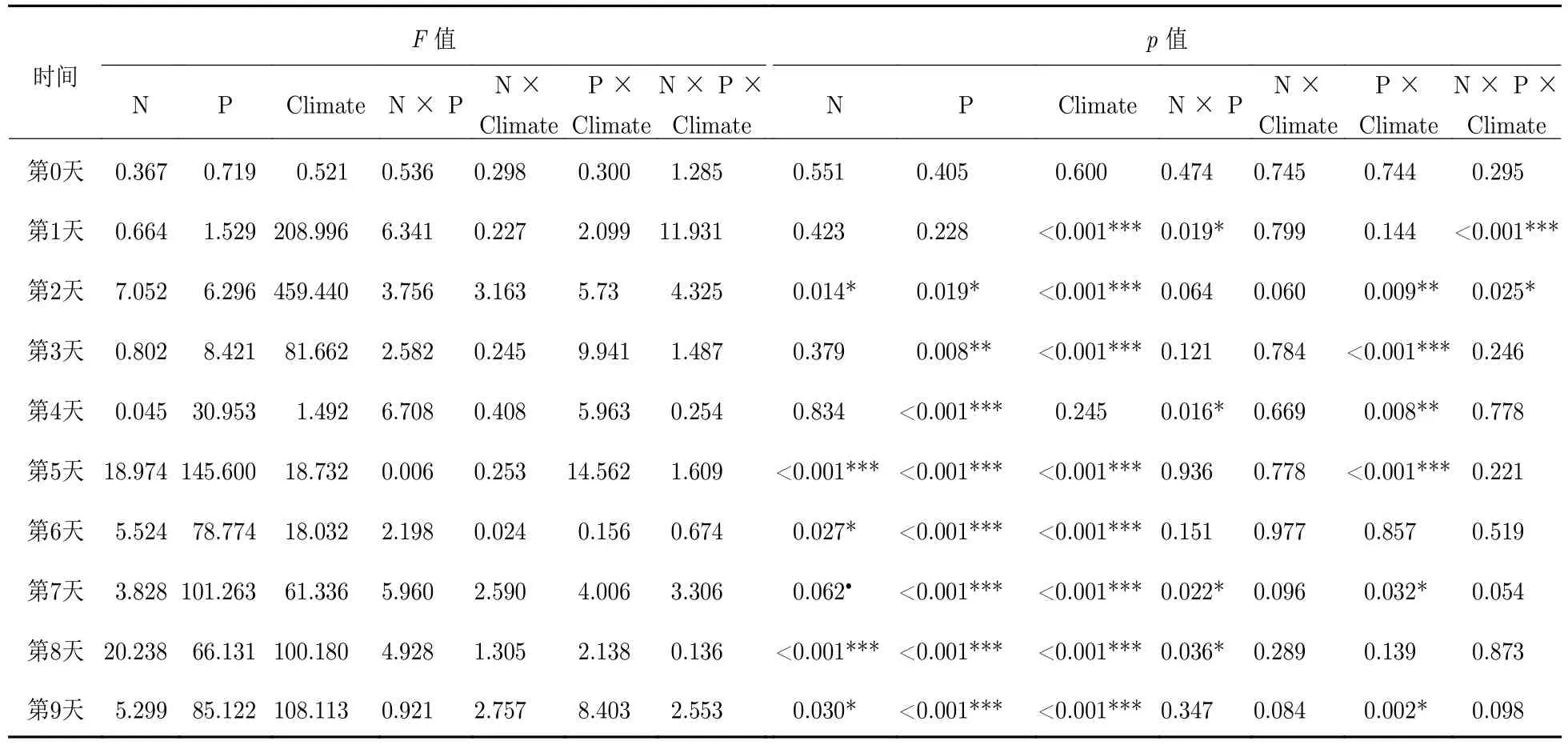
表1 在不同时间对不同硝酸盐 (N)、磷酸盐 (P) 浓度和气候情景 (Climate)下的赤潮异弯藻细胞密度的方差分析Tab. 1 Summary of ANOVA results of the effects of nitrate (N), phosphate (P), and climate on the cell density on different days

图2 不同CO2浓度和温度下赤潮异弯藻的生长对营养盐变化的响应Fig. 2 Growth response of Heterosigma akashiwo to changes in nutrients, CO2, and temperature
在当前CO2浓度和温度的条件下 (实验1), 不同营养盐浓度对赤潮异弯藻细胞密度的影响在第4天开始出现差异. 与高磷组相比, 低磷组显著降低了赤潮异弯藻的细胞密度, 降低约41% (图2(a),HP∶LP,F= 61.18,p< 0.001); 而氮浓度的变化并没有显著影响赤潮异弯藻的细胞密度 (图2(a),HN∶LN,F= 0.147,p= 0.712). 营养盐浓度的不同改变了赤潮异弯藻的细胞密度峰值以及到达生长峰值的时间, 高氮高磷组、高氮低磷组、低氮高磷组和低氮低磷组分别在第6、5、7、7天达到细胞密度峰值, 分别为(17.03 ± 1.26) × 103、(10.02 ± 0.44) × 103、(16.65 ± 1.36) × 103和(9.7 ± 0.68) ×103cells·mL–1. 另外, 低磷组显著抑制了赤潮异弯藻的比生长速率 (图2(d), 实验1: HP∶LP,F=16.295,p= 0.004; HN∶LN,F= 0.459,p= 0.517) .
CO2浓度的升高改变了营养盐对赤潮异弯藻生长的影响 (图2(b)、2(d), 表1). 一方面, 自第4天起, 除低磷组赤潮异弯藻的细胞密度显著降低外 (降低24% ~ 36%), 低氮组赤潮异弯藻的细胞密度也显著降低 (图2(b), HN∶LN,F= 23.396,p= 0.001; HP∶LP,F= 55.854,p< 0.001; HNHP∶LNHP,p< 0.001). 另一方面, 赤潮异弯藻达到生长峰值的时间也与实验1不同. 高氮高磷组、高氮低磷组、低氮高磷组和低氮低磷组分别在第7、8、6、7天达到细胞密度峰值, 分别为(18.32 ± 0.58) × 103、(11.72 ± 0.09) × 103、(15.16 ± 1.37) × 103和(11.56 ± 1.19) × 103cells·mL–1. 尽管赤潮异弯藻细胞密度在达到峰值后略有下降, 但在实验周期内细胞密度降低的趋势并不明显. 此外, 低磷处理依然显著抑制了赤潮异弯藻的比生长速率 (图2(d), 实验2: HP∶LP,F= 17.952,p= 0.003; HN∶LN,F=2.582,p= 0.147).
当同时升高CO2浓度和温度时, 赤潮异弯藻的生长表现出对营养盐的依赖性. 一方面, 实验3中在实验的前3天, 细胞密度均高于实验1和实验2 (图2(c), 图3); 另一方面, 最大细胞密度却低于实验1和实验2, 并且种群较早达到生长峰值 (图2(c), 图3). 高氮高磷组、高氮低磷组、低氮高磷组和低氮低磷组分别在第5、3、4、4天达到细胞密度峰值, 分别为(13.05 ± 0.31) × 103、(7.62 ± 0.30) × 103、(11.56 ± 0.52) × 103和 (7.36 ± 0.28) × 103cells·mL–1. 此外, 低磷组和低氮高磷组中赤潮异弯藻的细胞密度也相对较低 (图2(c), HP∶LP,F= 177.88,p< 0.001; HNHP∶LNHP,p= 0.014).
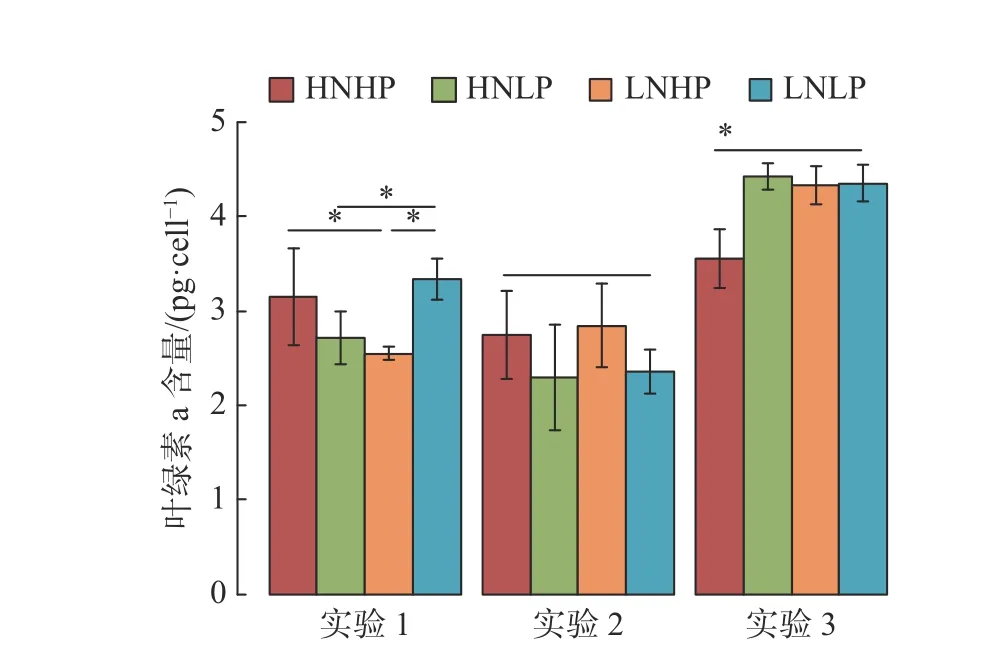
图3 不同实验组的赤潮异弯藻单位细胞内的叶绿素a含量Fig. 3 Cellular chlorophyll-a contents of Heterosigma akashiwo in different experimental groups
单位细胞内叶绿素a含量的结果显示, 实验1中, 氮磷营养盐的耦合作用较单一营养素对赤潮异弯藻单位细胞内叶绿素a含量的影响更为显著 (图3, 实验1, N∶P,F= 5.239,p= 0.047; HP∶LP,F= 2.582,p= 0.146; HN∶LN,F= 2.560,p= 0.148). 与实验1相比, 当升高CO2浓度时 (实验2),单位细胞内叶绿素a含量无显著变化 (图3, 实验1∶实验2,p= 0.082); 并且不受营养盐浓度变化的影响 (图3, 实验2, N∶P,F= 0.039,p= 0.848). 当同时升高CO2浓度和温度时 (实验3), 赤潮异弯藻单位细胞内叶绿素a含量显著升高. 高氮条件下, 高磷组的单位细胞内叶绿素a含量较低(图3, 实验3, HNHP∶HNLP,p= 0.024), 而在低氮条件下各处理组间无显著差异 (图3, 实验3,LNHP∶LNLP,p= 0.953).
2.2 赤潮异弯藻在不同CO2浓度和不同温度条件下的生长情况
赤潮异弯藻生长经历了对数增长期—稳定期—衰退期的过程, 营养盐条件不改变赤潮异弯藻的生长规律, 但是对其生长周期有显著影响 (图4). 以高氮高磷组为例 (图4(a)), 与实验1相比, CO2浓度升高 (实验2) 使赤潮异弯藻在对数生长期的细胞密度和最大细胞密度均显著增加, 并且较晚进入衰亡期; 当同时升高CO2浓度和温度时 (实验3), 对数生长期的细胞密度均高于其他实验组, 且较早达到最大细胞密度, 但其衰亡速率与实验1相近. 另外, 实验3的最大细胞密度远小于其他实验组.
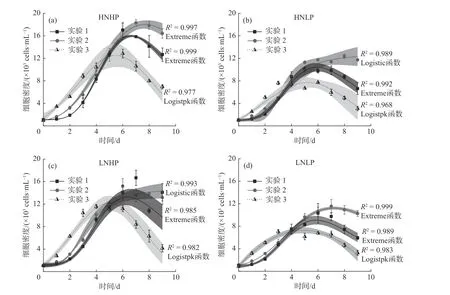
图4 不同营养盐水平下赤潮异弯藻细胞密度对CO2浓度和温度变化的响应Fig. 4 Response of cell density of Heterosigma akashiwo to increased CO2 and temperature under HNHP, HNLP,LNHP, and LNLP
同样地, 在不同CO2浓度和温度下, 赤潮异弯藻的比生长速率具有显著差异, 且这种差异在不同营养盐浓度下依然表现出相似的规律 (图2(d)). 具体为: 与实验1相比, 当CO2浓度升高时, 赤潮异弯藻的比生长速率被显著提高; 当同时升高CO2浓度和温度时, 比生长速率被进一步提高(图2(d)).另外, 实验3中赤潮异弯藻单位细胞内的叶绿素含量显著高于其他两组实验, 而实验1和实验2无显著差异 (图3, 实验1∶实验3,p< 0.001; 实验2∶实验3,p< 0.001; 实验1∶实验2,p= 0.082).
3 讨论
3.1 赤潮异弯藻生长对营养盐变化的响应
大量研究表明, 磷缺乏会限制有害藻华的生长. 如剧毒卡尔藻 (Karlodinium veneficum)[30-31]、米氏凯伦藻[11,32]、拟菱形藻 (Pseudo-nitzschiaspp.)[33]等, 在磷缺乏条件下, 其生长明显受到抑制. 本研究中, 在所有CO2浓度和温度下, 虽然在少数几天中观察到低氮组细胞密度低于高氮组 (表1), 但是比生长速率没有明显差异 (表2). 而且, 无论在低氮还是高氮条件下, 细胞密度和比生长速率在低磷条件下均受到明显抑制 (表1, 表2). 这表明磷酸盐可能是影响赤潮异弯藻增殖的关键环境因子之一.

表2 对不同硝酸盐 (N) 、磷酸盐 (P) 浓度和气候条件 (Climate) 下的赤潮异弯藻比生长速率的方差分析Tab. 2 Summary of ANOVA analysis for the effects of nitrate (N), phosphate (P) and climate on the specific growth rate
增加磷浓度会促进有害藻华的繁殖、生长. 例如: 针胞藻纲的古卡盾氏藻 (Chattonella antiqua)[34]和赤潮异弯藻[15]在磷得到补充后迅速增殖. 然而, 进一步的研究发现, 高磷浓度对赤潮异弯藻生长的促进作用是以氮浓度达到其生长所需的最低浓度以上为前提条件的. 例如: Baek等[35]在氮浓度小于5 µmol·L–1的磷加富实验中并没有观察到磷加富对赤潮异弯藻生长的促进作用. 本研究的营养盐浓度参考了我国长江口邻近海域的营养盐水平, 最低氮浓度设定为15 µmol·L–1, 不会影响磷对赤潮异弯藻生长的促进作用. 需要说明的是, 本研究使用的是一个相对封闭的培养系统, 营养盐的增加/损失几乎可以忽略不计. 培养装置内的初始营养盐浓度决定了赤潮异弯藻种群的可发展程度. 由此可以预测,河口近岸环境中的营养盐浓度是决定赤潮异弯藻暴发藻华的关键因子之一. 那么, 富营养化的近岸水体就具有爆发赤潮异弯藻藻华的较高风险. 相反地, 通过有效控制人为排放磷的输入则可能是降低我国近岸海域爆发赤潮异弯藻藻华风险的途径之一.
此外, 氮是合成叶绿素的主要元素之一, 其浓度直接或间接影响叶绿素的合成. 研究表明, 随着氮浓度的降低, 单位体积叶绿素a含量逐渐减小[36]. 本研究中, 实验1中低氮高磷组和实验2中高氮高磷组叶绿素a含量较其他实验组低, 此结果可能与这两组中赤潮异弯藻的生长较快、对氮的消耗大有关, 进而导致合成叶绿素a含量较低.
3.2 赤潮异弯藻生长对气候变化的响应
CO2浓度的升高对不同海洋浮游植物的影响各不相同. 例如: CO2浓度升高对亚历山大藻(Alexandrium monilatum) 和微小原甲藻 (Prorocentrum mimum) 的生长具有负面影响, 对窄隙角毛藻 (Chaetoceros affinis) 的生长无明显影响[37], 而对赤潮异弯藻[8]、短凯伦藻[9]、血红哈卡藻[10]、米氏凯伦藻[11]的生长具有促进作用. 此外, 对于同一物种而言也可能存在种内差异[38]. 升高CO2浓度对大多数有害藻华种的生长是有利的. 一项基于26个物种的元分析研究发现, 升高CO2浓度可以有效提高有害藻华种的生长, 但在其他藻种中并没有相同的规律[39]. 本研究中, 无论是只增加CO2浓度的实验2还是同时升高CO2浓度和温度的实验3, 赤潮异弯藻的比生长速率及对数生长期的细胞密度均比实验1高 (图3, 表1, 表2). 这一结果较好地验证了前人的研究结论[8,37].
同时, 温度的升高也可以进一步促进赤潮异弯藻的繁殖生长. Zhang等[40]研究表明, 赤潮异弯藻的最适生长温度为20 ~ 30℃. 温度对赤潮异弯藻生长影响的多项研究也发现了, 该藻在25℃下的比生长速率高于20℃下的比生长速率[8,41-43]. 本文研究结果再一次验证了, 升高温度可以有效提升赤潮异弯藻的生长速率. IPCC报告中指出[6], 在温室气体高排放情境下, 21世纪末全球平均增温约2.7℃.这意味着, 同样面临温度持续升高影响的中国近岸海域, 具有爆发更大范围、更长时间赤潮异弯藻藻华的风险.
另外, 温度还会影响细胞的新陈代谢. 在最适生长温度范围内, 温度越高细胞的新陈代谢越快[44],这包括叶绿素a合成等生理代谢过程. 因此, 本研究中, 实验3的细胞内叶绿素含量显著高于其他两组 (图3). 但是, 实验3的最大细胞密度低于实验1. 究其原因可能是: 一方面, 赤潮异弯藻在CO2浓度和温度同时升高的条件下, 合成较多的叶绿素a需要消耗更多的能量, 对营养盐的需求就更多; 另一方面, 由于培养系统相对封闭, 无额外的营养盐补给, 因此限制了实验3赤潮异弯藻的最大细胞密度. 其他研究也指出了, 海洋升温会增加有害藻华的强度[13,45-46]. 基于以上分析, 全球气候变化 (CO2浓度和温度升高) 将加剧赤潮异弯藻爆发的几率和强度.
4 结论
本研究模拟了3种不同CO2浓度和温度组合的气候条件, 并以长江口邻近海域营养盐浓度为参考, 设定了4个营养盐水平, 探讨了赤潮异弯藻生长对不同CO2浓度、温度以及营养盐浓度的响应.温度上升和CO2浓度升高都会促进赤潮异弯藻的增殖. 因此, 在未来气候变化条件下, 赤潮异弯藻藻华爆发的风险会加大. 改善河口近岸环境中的富营养化状况, 特别是人为排放的磷酸盐输入, 是降低赤潮异弯藻爆发藻华风险的有效途径之一. 本研究补充了赤潮异弯藻生长对营养盐与气候变化耦合作用响应的实验证据, 可以为河口近岸水质和生态管理提供科学参考.

