川芎挥发油组分及体外抗炎活性研究
周羿宇,孟德超,何永成,王 成,余 杰,张朝文,邹元锋
(四川农业大学动物医学院天然药物研究中心,成都 611130)
中药材川芎为伞形科藁本属植物川芎(LigusticumchuanxiongHort.)的干燥根茎。夏季当茎上的节盘显著突出并略带紫色时采挖,除去泥沙,晒后烘干,再去须根。川芎入药已有两千年历史,首载于《左传》,入药始于《神农本草经》上品,有“川芎味辛、温,主治中风人脑头痛、寒痹、筋挛缓急、妇人血闭无子”之称。主产于四川省彭州、都江堰等地,为四川的道地药材之一[1]。“个头大饱满、质地坚实,断面色为黄白、油性大、香气浓郁者”为优。《本草便读》中记载“辛甘微苦,能解郁调经;温宣之性,能疏血分寒”[2],为中医中活血行气,法风止疼之药。川芎因其有效成分及药用价值广而备受关注,临床上主要应用于治疗心脑血管、呼吸、泌尿系统及妇科方面的疾病。现代研究表明其在抗炎、镇痛、抗血栓形成、促血管舒张、抗哮喘、抗呼吸抑制、抗纤维化、抗阻塞性疾病及抗肿瘤等方面发挥显著的药理作用。
挥发油是川芎主要活性成分,约占化学成分总量的1%,主要包括苯酞类、萜烯类、脂类、有机酸类等化合物。钱敏[3]通过GC-MS法测定川芎挥发油中含有29种成分,其中以藁本内酯含量最多,其次是正丁烯基苯酞、丁基苯酞、α-萜品醇。另有学者[4]用GC-MS-DS方法分析,鉴定出40个化合物,占挥发油总组成93.64%,主要成分为藁本内酯(58.00%),3-丁基苯酞(5.29%),香松烯(6.08%)。其他研究[5-7]均表明藁本内酯为川芎挥发油的主要活性成分,可占挥发油总量的60%及以上。
炎症是具有血管系统的活体组织对各种损伤因子的刺激所发生的以防御反应为主的基本病理生理过程,是损伤、抗损伤和修复的动态过程[8]。炎症是机体重要的防御反应,适度的炎症反应有益于机体健康,但是在一定情况下对机体有潜在的威胁性。如病毒性心肌炎可以影响心脏功能[9]、细菌性脑膜炎的脓性渗出物可以引起颅内压增高[10]、结核性心包炎引发心包增厚[11]等。脂多糖(LPS)可刺激小鼠单核巨噬细胞(RAW267.4)产生急性炎症反应,可在此基础上建立体外炎症细胞模型。炎症反应的过程中会释放多种炎症因子,从而调控整个炎症反应的进程,例如一氧化氮(Nitric oxide,NO)、肿瘤坏死因子-α (Tumor necrosis factor-α,TNF-α)、白细胞介素-1β (Interleukuin-1β,IL-1β)、白细胞介素-6 (Interleukuin-6,IL-6)、白细胞介素-10 (Interleukuin-10,IL-10)等,这些炎症因子的含量可以间接反应炎症发生的程度,常常作为检测炎症反应的实验依据。
研究利用水蒸气蒸馏法分别对川芎非药用部分和药用部分中的挥发油进行提取,采用气相色谱-质谱联用法分析鉴定其化学成分,通过LPS诱导RAW 264.7细胞建立体外炎症模型,给予系列浓度梯度的川芎药用部分和非药用部分挥发油溶液,采用qRT-PCR对IL-6炎症因子进行检测,探究其抗炎作用。在同产地川芎原料基础上,将药用部分和非药用部分中的挥发油的化学成分以及抗炎活性进行比对,为扩大川芎药源提供实验依据。
1 材料
1.1 仪器
电热鼓风干燥箱(DHG-9070B 上海琅玕实验设备有效公司);恒温电热套(ZDHW 中兴伟业仪器有限公司);电子天平(BS-210S 北京赛多利斯天平有限公司);显微分光光度计(NanoDrop One/OneC 美国赛默飞公司);CO2细胞培养箱(美国赛默飞公司);高速冷冻离心机(美国赛默飞公司);倒置生物显微镜(Nikon)等。
1.2 材料
川芎(LigusticumchuanxiongHort.),根茎及茎叶采自眉山市彭山区川芎种植基地,经四川农业大学邹元锋副教授鉴定为川芎(LigusticumchuanxiongHort.)的块根及茎叶。
1.3 试剂
DMEM培养基(美国Gibco公司);胎牛血清(FBS;美国Gibco公司);青霉素-链霉素(美国Gibco公司);Trizol试剂(RA101-02 北京博迈德基因技术有限公司);CCK-8试剂盒(Dojindo Molecular Technologies);胎牛血清(美国Gibco公司);脂多糖(LPS,Sigma,O55:B5);M-MLV4 First-Strand cDNA Synthesis Kit(Takara生物技术有限公司);SYBR premix Ex Taq II试剂盒(Takara生物技术有限公司)。
1.4 细胞株
小鼠RAW264.7单核-巨噬细胞(中国典型培养物保藏中心细胞库)。
2 方法
2.1 提取方法
参照2020年版《中国药典》四部通则2204《挥发油测定法》[1]进行挥发油提取。精密称取干燥川芎块根及茎叶100 g(根茎切块为1cm3,茎叶切段为1cm长),置于3000mL圆底烧瓶中,加水2000mL,充分混匀后浸泡2 h,连接回流冷凝管,加热至沸腾,并保持微沸回流提取10 h,至测定器油量不再增加,分离油层,得川芎挥发油,计算提取得率,分装于棕色瓶,置于-80℃备用。
2.2 成分分析
分别取川芎药用部分挥发油和非药用部分挥发油进行GC-MS检测,并联用NIST 17数据库自动检索。
2.2.1 气相色谱柱 HP-5MS(60m×250μm×0.25μm)。
2.2.2 GC条件 进样口温度280℃,气质接口温度280℃,载气流速1.5mL/min;进样量1μl;分流比100:1;升温程序:初始50℃,保持0min;以5℃/min升温到100℃保持5min;以4℃/min升温到140℃保持5min;以4℃/min升温到180℃保持5min;以5℃/min升温到250℃保持5min;以10℃/min升温到290℃保持10min。
2.2.3 MS条件 离子源温度230℃,四级杆温度150℃,EI电离70 eV,全扫描35~550 Da。
2.3 体外抗炎活性
2.3.1 细胞培养、传代、冻存与复苏 (1)细胞培养。在超净台台中,将含有一定数量RAW267.4细胞的细胞悬液加入细胞培养皿内,并加入9mL含10%胎牛血清的高糖DMEM培养基,放入37℃,5%CO2的培养箱中培养,每12h观察细胞状态及生长情况。
(2)细胞传代。待RAW267.4细胞生长至培养皿80%左右传代。将旧培养基移除,用提前在37℃水浴锅预热的0.1mol/L PBS冲洗2~3次,加入2mL0.25%的胰蛋白酶消化液,消化1min后移除所有胰酶,加入4mL的DMEM,用移液枪轻轻吹打贴壁的细胞使之脱落,收集细胞于10mL离心管,1000rpm/min,离心5min,弃上清,加入2mL的新培养液充分混匀,均匀添加至两个装有7mL完全培养基的培养皿中,放入培养箱中培养。约24h传代1次,以保持细胞生长状态,维持适宜的细胞密度。
(3)细胞复苏。从液氮中取出冻存管,迅速放入提前准备的37℃水浴中,摇晃冻存管加速溶解(呈液态,1 min为宜)。在超净台将溶解好的细胞移入到装有9mL完全培养基的离心管,2000 rpm/min离心3 min,弃去上清液,用1~2mL完全培养基重悬细胞,再将细胞悬液加入装有7mL完全培养基的培养皿中,放入培养箱中培养,次日更换培养基,观察细胞的生长状况。
2.3.2 细胞毒性测定 根据CCK-8检测法,检测川芎药用部分和非药用部分挥发油对RAW 264.7细胞的细胞毒性。取川芎药用部分和非药用部分挥发油溶解在二甲基亚砜(DMSO)中,配置成0.1 mg/mL的母液,之后取适量母液配置所需浓度。将RAW 264.7细胞在96孔板上培养并孵育24 h。更换培养基后,在96孔板中添加不同浓度LPS(1.25、2.5、5、10、20、40、60μg/mL)、川芎药用部分挥发油和川芎非药用部分挥发油溶液(1.25、2.5、5、10、20、40、60、80μg/mL),并孵育12 h。按照CCK-8试剂说明加入试剂,每孔加入10μL的CCK-8试剂,孵育1h,使用酶标仪,于450 nm波长出测量每孔吸光度并计算细胞毒性。
细胞活力(%)=(给药组细胞OD值-空白OD/正常组的OD值-空白组OD值)×100%
2.3.3 qRT-PCR实验 将RAW264.7细胞接种于6孔板中,培养24 h(2×105个细胞/孔)。使用不同浓度的川芎药用部分挥发油(2.5、5、10μg/mL)和川芎非药用部分挥发油(2.5、5、10μg/mL)给药并培养12 h,更换培养基后添加500 ng/mL的LPS溶液,孵育12 h,以诱导细胞炎症。用Trizol试剂提取RAW 264.7细胞的总RNA。用显微分光光度计测量RNA浓度,并测定A260/280在1.6-2.0范围内,用于定量测定炎症细胞因子IL-6基因的相对表达。使用M-MLV4 First-Strand cDNA Synthesis Kit将分离的总RNA(5μg/μL)逆转转录成cDNA。实时荧光定量PCR(qRT-PCR)严格使用SYBR premix Ex Taq II试剂盒。以β-actin(mouse)作为内参数,用△△Ct法计算,确定靶基因的相对表达量。RT-qPCR所用的引物见表1。
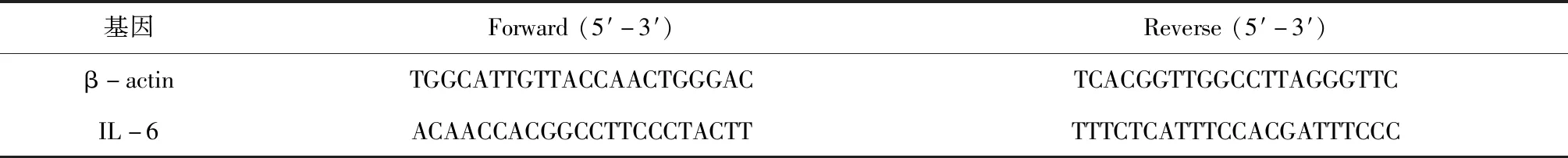
表1 qRT-PCR的引物序列
3 结果与分析
3.1 挥发油提取得率
采用水蒸气蒸馏法分别对川芎药用部分与非药用部分进行提取,提取得率结果见表2,川芎非药用部分挥发油得率平均值为0.2845%,药用部分挥发油得率平均值为0.2267%。
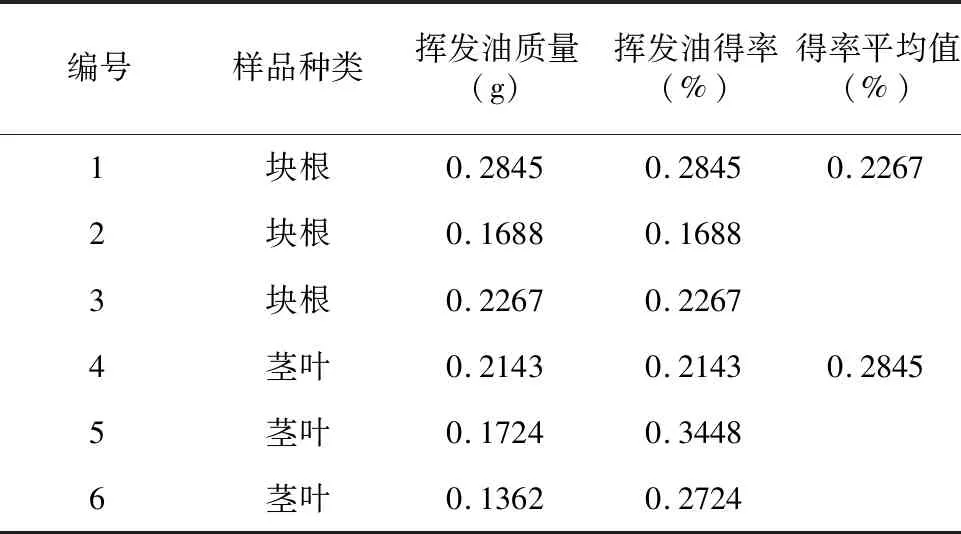
表2 川芎药用部分和非药用部分挥发油提取得率
3.2 GC-MS分析
提取得挥发油样品经气相色谱—质谱联用仪分析,联用NIST 17数据库进行自动检索,并与相关文献及标准图谱分析对比,然后以色谱面积归一化法计算各组分的相对百分含量,分析得到不同部位川芎挥发油化学组分。
经GC-MS分析,总共检出112种挥发性成分,其中川芎药用部分所得挥发油共中检出87种,占总峰面积98.46%;从川芎非药用部分所得挥发油中检出65种,占总峰面积96.20%。经统计分析,川芎挥发油主要成分为3-丁基苯酞(Butyl Phthalide)、3-丁叉苯酞(3-butylidene-phthalid)、松油烯醇-4(4-Terpineol)、N,N'-Diacetyl-1,4-phenylenediamine、乙位水芹烯(β-phellandrene)。表3、表4分别整理出非药用部分和药用部分含量最高的前十种挥发性成分,经分析对比,相同成分共有两种,分别为3-丁基苯酞(Butyl Phthalide)和3-丁叉苯酞(3-butylidene-phthalid),非药用部分中含量分别为51.21%、1.78%,药用部分中含量分别为55.08%、2.51%。实验数据表明含量最高的成分均为3-丁基苯酞,非药用部分和药用部分分别含有51.21%、55.08%。

表3 川芎非药用部分挥发油含量最高的前10种组分
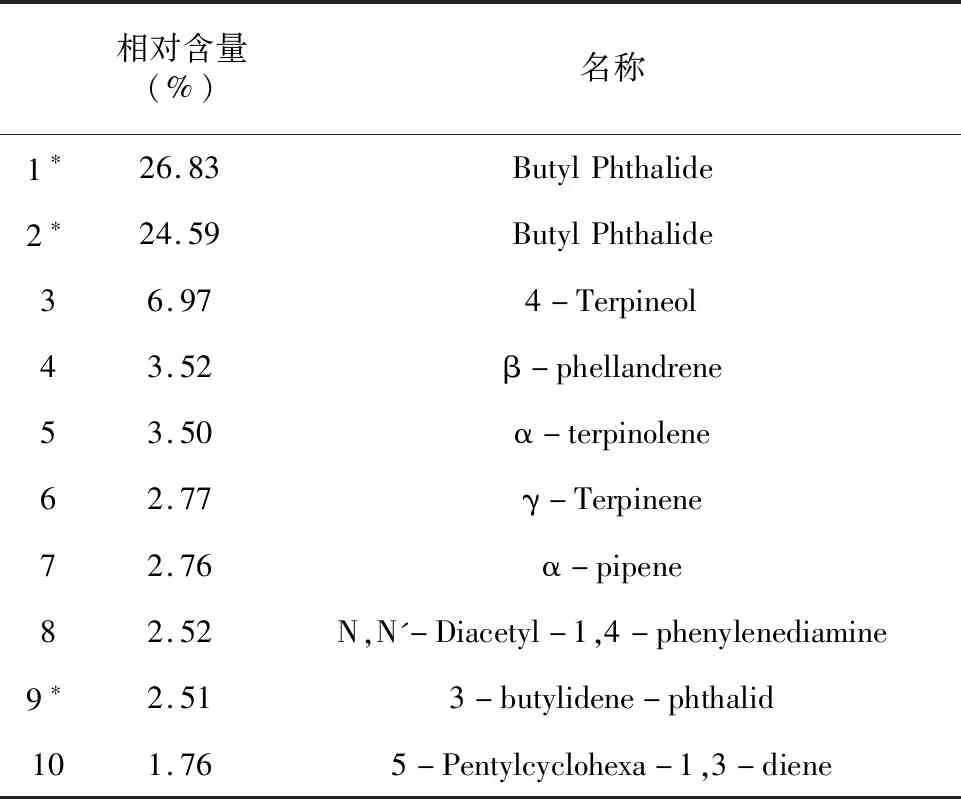
表4 川芎药用部分挥发油含量最高的前10种组分
川芎药用部分挥发油和川芎非药用部分挥发油的化学成分基本一致,但也存在部分差异。不同部分川芎挥发油具有40种共同化学成分,两种挥发油各主要化学组分的百分含量存在差异,例如3-丁叉苯酞,其在川芎非药用部分、药用部分挥发油中的相对含量分别为1.78%、2.51%。不同部分川芎挥发油主要成分也具有一定差异,非药用部分含有β-瑟林烯、α-瑟林烯、乙位石竹烯、大牛儿烯、反式-α-佛手甘油烯、β-榄香烯、α-毕橙茄醇等主要化学成分,具有一定的抗菌、抗真菌[12]、抗肿瘤、诱导细胞凋亡等作用。药用部分含有松油烯醇-4、乙位水芹烯、异松油烯、γ-松油烯、α-蒎烯、N,N-二乙酰-1,4-苯二胺、5-Pentylcyclohexa-1,3-diene等主要化学成分,具有抑制酶活性[13]、抗氧化[14]、清除自由基、杀虫活性[15]等作用。实验结果说明川芎药用部分和非药用部分都具有相同的功效,但两者的不同成分存在特殊药用价值的可能性,拥有广阔的研究价值。
3.3 川芎挥发油对LPS诱导的RAW264.7细胞的影响
首先采用CCK-8试剂检测川芎挥发油及LSP的细胞毒性(图1),实验结果表明三种溶液在实验浓度下对RAW 264.7细胞均无毒性。
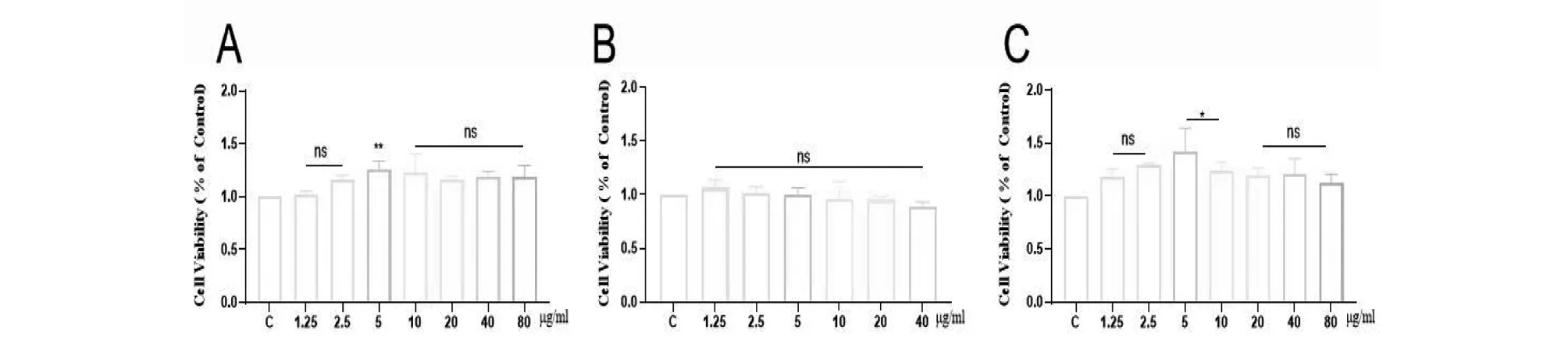
图1 川芎药用部分 (A)、非药用部分挥发油 (B)和LPS (C)对RAW267.4细胞细胞存活率的影响
炎症产生时,局部血管扩张,血浆及中性白细胞等血液成分渗出到组织内,细胞中的炎症通路如LPS-TLR4/MD-2、Jak/Stat等被激活并释放多种促炎细胞因子。IL-6是促炎症细胞因子中的重要代表,其分泌水平可以反映炎症反应的程度。而LPS已被证实并应用于诱导RAW 173.4细胞炎症和氧化应激[16],与本实验结果一致(图2),LPS刺激RAW 264.7细胞后,IL-6的基因表达量显著增加(P<0.001),进一步考察川芎药用部分挥发油和非药用部分挥发油对炎症因子分泌的作用效果。
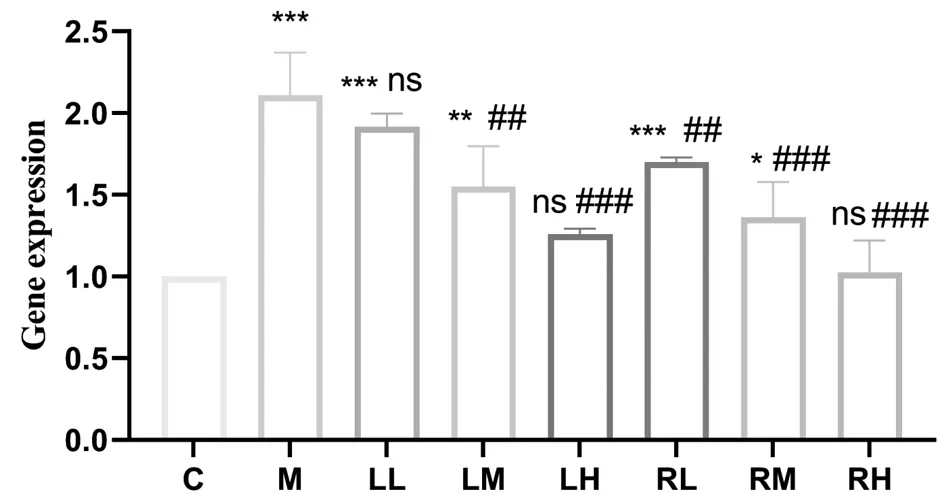
图2 川芎挥发油对LPS诱导RAW 267.4细胞炎症中IL-6表达的影响注:C为空白组,M为模型组,LL、LM和LH分别为川芎非药用部分挥发油低剂量(2.5μg/mL)、中剂量(5μg/mL)和高剂量(10μg/mL)组,RL、RM和RH分别为川芎药用部分挥发油低剂量(2.5μg/mL)、中剂量(5μg/mL)和高剂量(10μg/mL)组。与LPS模型组相比*P<0.05,**P<0.01,***P<0.001;与空白对照组相比#P<0.05,##P<0.01,###P<0.001;ns表示无显著差异(P>0.05)。
与炎症模型组相比(仅作LPS处理),LPS处理前经过不同浓度给药,其中川芎药用部分中剂量(P<0.01)和高剂量组(P<0.001)对IL-6基因表达抑制作用显著,低剂量组抑制作用不明显(P>0.05);而川芎非药用部分低剂量(P<0.01)、中剂量(P<0.001)和高剂量(P<0.001)组对IL-6基因表达抑制作用显著,呈现剂量依赖关系。结果说明,川芎药用部分和非药用部分挥发油对LPS诱导的RAW 267.4细胞炎症反应均有不同程度的抑制作用,而高剂量时作用最显著,表明两种挥发油在体外具有良好的抗炎活性,并不同程度降低了炎症因子(IL-6)的含量。在本实验中,川芎药用部分和非药用部分挥发油有着相近的化学成分,表现出相似的抗炎效果,为进一步利用川芎浪费的非药用部分作为抗炎物质的药用来源奠定了基础。
4 讨论与结论
川芎入药历史悠久,具有良好的药用价值,药用部位为成熟的川芎根茎,花茎叶等非药用部分在成熟前因摘除而无法利用,存在潜在的经济价值。目前研究主要集中在不同提取挥发油的方法之间成分差异性的比较,还有不同产地川芎挥发油成分比较[17]。若加强对川芎茎叶,即非药用部分的研究可以有效避免资源的浪费,提高全药材的利用度。采用GC-MS分别对其药用部分和非药用部分挥发进行成分分析,比较其成分的差异性与相似性,探究药源开发的可能。
川芎挥发油的化学成分主要为各种萜类化合物,此外还含有醇、酯、醛、酮以及其衍生物。虽然川芎非药用部分和药用部分成分存在些许差异,但其主要成分含量基本相同,其中含量最高的组分都为3-丁基苯酞,它们分别含有51.21%、55.08%,含量接近。故川芎非药用部分挥发油与药用部分挥发油具有相似的功效。川芎挥发油中均未检测出藁本内酯成分,与文献报道[5-7]有差异,说明川芎的主要成分发生了变化,可能与源产地、存放时间、采收期等原因以及藁本内酯的不稳定性有关,仍需进一步考察。
革兰氏阴性致病菌产生的LPS可产生强烈的炎症反应,本研究中RAW267.4细胞经过LPS诱导建立炎症模型,炎症因子IL-6显著上调。经过挥发油处理过后,由LPS诱导产生的IL-6过度分泌被明显抑制,且药用部分和非药用部分挥发油抗炎抑制作用相似,在体外均有良好的抗炎效果。研究表明,部分二萜类化合物存在优异的抗炎活性[18],而萜类作为川芎挥发油的主要成分,推测其是其临床抗炎作用的物质基础,存在进一步研究价值。本实验对川芎药用部分和非药用部分挥发油总体物的抗炎活性进行对比,表明非药用部分的抗炎效果与药用部分同佳,为川芎全药材利用提供实验依据,其作用机制仍缺乏相关研究。

