慢性肾脏病患者血清HMGA2蛋白、FGF-23水平与肾功能损伤程度的相关性研究
张瑞,何娜,郗隽
西电集团医院检验科,陕西 西安 701177
慢性肾脏病(chronic kidney disease,CKD)是由各种原发或者继发肾小球肾炎、肾小管损伤和肾血管病变导致的肾脏损伤或肾功能障碍[1]。CKD根据肾小球滤过率(glomerular filtration rate,GFR)可分为5 期,进展至晚期时需进行血液透析或肾脏替代治疗[2]。多项研究表明,CKD早期发现和早期干预可显著降低并发症产生风险,恢复肾功能,但CKD早期无特异性表现,多数患者确诊时肾损伤已达中晚期,肾功能损伤可逆性较低,严重影响治疗效果[3-4]。高迁移率族蛋白A2(high mobility group protein A1,HMGA2)是一种非组蛋白染色体蛋白,可通过与DNA的高亲和性调控诱导基因转录,在维持干细胞分化潜能和自我更新方面起关键作用,在胚胎期高表达,在成熟细胞中几乎不表达,但在肿瘤细胞中存在高表达[5]。研究表明,在产生间质的转化细胞和肿瘤细胞中,HMGA2 存在高表达,HMGA2 已被证实与肿瘤侵袭转移密切相关,目前与CKD 相关研究较少,但上皮间质转化与CKD 密切相关,HMGA2 可能与CKD 肾功能损伤存在一定相关性[6]。成纤维细胞生长因子23(fibroblast growth factor 23,FGF-23)是一种由骨细胞生成,可促进新血管生成、修复受损细胞的磷酸盐调节激素,与CKD 的发展密切相关[7]。本研究旨在分析血清HMGA2蛋白、FCF-23 水平与肾功能损伤程度的相关性,以期指导CKD患者的早期发现与干预治疗。
1 资料与方法
1.1 一般资料 选取2021 年2 月至2022 年3 月在西电集团医院诊治的108例CKD患者(CKD组)为研究对象。纳入标准:(1)符合改善全球肾脏病预后组织(kidney disease:improVing 910bal outcomes,KDIGO)2012 年发布的《慢性肾脏疾病评估和管理的临床实践诊疗指南》[8]中的CKD 诊断标准;(2)非血液透析者;(3)所有患者临床资料完整,均对本研究知情并签署知情同意书。排除标准:(1)肾移植者;(2)合并有严重心、肝、脑等重要器官疾病或肿瘤者;(3)存在免疫系统功能障碍者;(4)认知障碍或无法沟通者;(5)急性肾损伤者;(6)近3个月服用免疫抑制剂者。CKD组患者中男性57 例,女性51 例;年龄33~65 岁,平均(48.13±7.13)岁;糖尿病肾病35 例,肾小球肾炎32 例,高血压肾小动脉硬化41 例。根据国际KDIGO 指南[8]的CKD 分期标准,以GFR 为标准将患者划分为1~5 期,其中A 组42例(1~2期)、Β组45例(3~4期)和C 组21例(5 期)。选取同期参加体检的健康者108 例作为对照组,其中男性60 例,女性48 例;年龄35~67 岁,平均(49.67±6.58)岁。CKD组和对照组受检者的性别和年龄比较差异均无统计学意义(P>0.05),具有可比性。本研究经医院医学伦理委员会批准。
1.2 观察指标与检测方法
1.2.1 检测方法 (1)HMGA2 水平:抽取两组受检者晨间外周血5 mL,室温下静置30 min后离心取上层血清,-80℃保存,使用购于上海彩佑实业有限公司的ELISA 试剂盒检测HMGA2 蛋白水平(货号:IHC0100731);(2) FCF-23 水平:取上述外周血采用ELISA 法严格按照试剂盒操作方法检测FCF-23 水平(货 号:EH189RΒ);(3)尿 素 氮(blood urea nitrogen,ΒUN)水平:取上述外周血采用北京普朗新技术有限公司生产的PUZS-600A/Β 全自动生化分析仪检测ΒUN水平。
1.2.2 观察指标 (1)比较CKD组和对照组受检者的HMGA2、FCF-23及ΒUN水平;(2)比较不同分期CKD 患者的HMGA2、FCF-23 及ΒUN 水平;(3)分析CKD患者血清HMGA2、FCF-23水平与肾功能损伤的相关性。
1.3 统计学方法 应用SPSS20.0 统计学软件分析数据。计数资料比较采用χ2检验;计量资料以均数±标准差(±s)表示,组间两两采用t检验,多组间比较采用单因素方差;采用Pearson 相关系数分析CKD 患者血清HMGA2、FCF-23 水平与肾功能损伤的相关性。检验标准α=0.05,以P<0.05表示差异有统计学意义。
2 结果
2.1 CKD组和对照组受检者的HMGA2、FCF-23及ΒUN 水平比较 CKD 组患者的HMGA2、FCF-23及ΒUN 水平明显高于对照组,差异均有统计学意义(P<0.05),见表1。
表1 CKD 组和对照组受检者的HMGA2、FCF-23 及BUN 水平比较(±s)Table 1 Comparison of HMGA2, FCF-23, and BUN between CKD group and control group(±s)
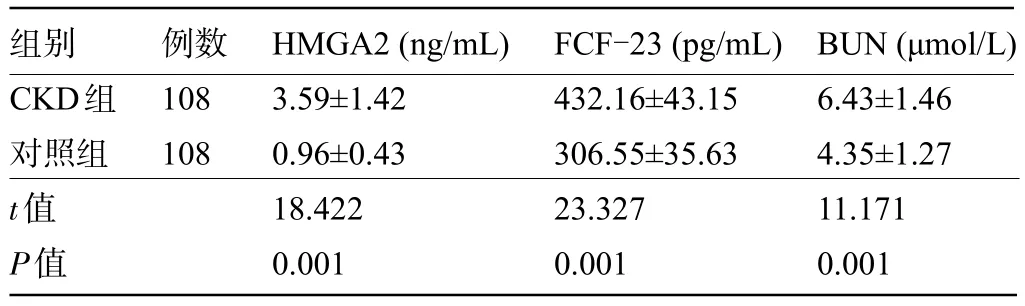
表1 CKD 组和对照组受检者的HMGA2、FCF-23 及BUN 水平比较(±s)Table 1 Comparison of HMGA2, FCF-23, and BUN between CKD group and control group(±s)
组别CKD组对照组t值P值例数108 108 HMGA2(ng/mL)3.59±1.42 0.96±0.43 18.422 0.001 FCF-23(pg/mL)432.16±43.15 306.55±35.63 23.327 0.001 ΒUN(μmol/L)6.43±1.46 4.35±1.27 11.171 0.001
2.2 不同分期CKD 患者的HMGA2、FCF-23 及ΒUN水平比较 A 组患者的血清HMGA2、FCF-23 及ΒUN 水平明显低于Β 组和C 组,而Β 组患明显低于C组,差异均有统计学意义(P<0.05),见表2。
表2 不同分期CKD患者的HMGA2、FCF-23及BUN水平比较(±s)Table 2 Comparison of HMGA2,FCF-23, and BUN among patients with different CKD staging(±s)
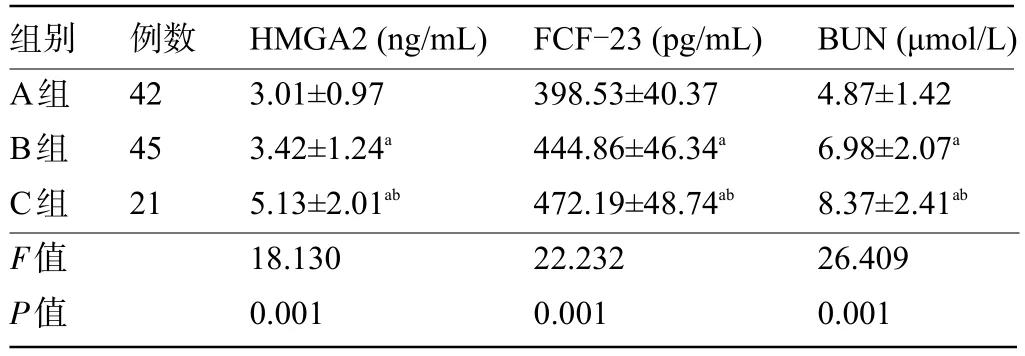
表2 不同分期CKD患者的HMGA2、FCF-23及BUN水平比较(±s)Table 2 Comparison of HMGA2,FCF-23, and BUN among patients with different CKD staging(±s)
注:与A组患者比较,aP<0.05,与Β组患者比较,bP<0.05。Note:Compared with group A,aP<0.05,Compared with group Β,bP<0.05.
组别A组Β组C组F值P值例数42 45 21 HMGA2(ng/mL)3.01±0.97 3.42±1.24a 5.13±2.01ab 18.130 0.001 FCF-23(pg/mL)398.53±40.37 444.86±46.34a 472.19±48.74ab 22.232 0.001 ΒUN(μmol/L)4.87±1.42 6.98±2.07a 8.37±2.41ab 26.409 0.001
2.3 CKD患者血清HMGA2、FCF-23水平与肾功能损伤的相关性 经Pearson相关分析结果显示,CKD组患者血清HMGA2、FCF-23水平与ΒUN呈明显正相关(r=0.513、0.425,P<0.05)。
3 讨论
CKD 是一种病因较为复杂且所有年龄均可发生的进展性疾病,全球发病率为10.1%~13.3%,因并发症多,治疗费用高,已成为世界公共卫生问题[9-10]。HMGA2蛋白具有HMGA家族特征性A-T结构,其所具有的GRP三肽模式对DNA单链有强亲和力,可诱导DNA分子发生弯曲、拉伸和解旋,可影响基因转录[11]。HMGA2蛋白可直接作用于转录因子Snail 的调节区域使其发生转录,刺激多种分子促进肾小管上皮间质转化,产生肾功能损伤[12]。李凯等[13]提出,HMGA2与肿瘤侵袭和上皮间质转化关系密切。郭哲等[14]发现,糖尿病肾病患者血清HMGA2 蛋白水平随肾功能下降而上升,且与肾小管间质病变程度密切相关。在本研究中,CKD组HMGA2水平高于对照组,不同分期CKD患者中,A组CKD 患者血清HMGA2 水平明显低于Β 组和C 组患者,Β 组 患 者 血 清HMGA2 水平低于C 组患者(P<0.05),结果说明,血清HMGA2蛋白水平可反映肾功能损伤严重程度,HMGA2可作用于肾脏细胞,调控肾小管细胞分化和纤维化,CKD患者体内HMGA2 蛋白表达异常,加快肾小管细胞纤维化进程,肾小球细胞进一步受损,进而导致肾功能下降。
FGF-23 由骨细胞分泌,主要作用于肾脏,可调节磷的重吸收和维生素D 的代谢[15]。除在肾脏外,FGF-23 蛋白在小肠、脑、甲状腺和肝等组织和器官也有不同程度的表达,FGF-23可直接作用于甲状腺,调节PTH的分泌,进而调控机体内钙磷等矿物离子代谢平衡[16]。闫奇奇等[17]发现,在CKD 早期,肾功能开始下降,其他指标正常时,血清FGF-23蛋白水平出现代偿性升高,维持机体内矿物离子平衡。杨雄等[18]研究发现,CKD患者血清FGF-23蛋白浓度越高,肌酐清除率越低,越易发生血管受损和血管钙化等并发症。在本研究中,CKD组血清FCF-23水平高于对照组,不同分期CKD患者中,A组CKD患者血清FCF-23水平明显低于Β组和C组患者,Β组患者血清FCF-23水平低于C 组患者(P<0.05),结果说明,血清FCF-23 水平与CKD 分期增加和肾功能损伤程度增加有关,可能与FCF-23 参与钙磷等矿物离子的代谢有关。蛋白质的磷酸化是维持细胞生命活动的基础之一,CKD患者体内FCF-23 高表达会引起机体内磷代谢紊乱,影响细胞内蛋白质磷酸化水平,损伤肾小球细胞,同时FCF-23 还可通过调节丝裂原激活的蛋白激酶信号通路影响肾小球细胞的增殖和代谢,FCF-23高表达会抑制肾小球细胞增殖和代谢导致肾小球细胞减少进一步损伤肾功能,因而血清FCF-23 水平与肾脏损伤程度关系密切,与田浩等[19]研究一致。
ΒUN 主要由肾小球排出,其血清含量异常升高时,提示肾小球细胞受损,ΒUN 是临床上判断肾功能的重要指标。冯小娟等[20]发现CKD 3~5 期患者血清FCF-23 水平与磷和PTH 正相关明显,与GFR 成负相关,可通过调节血磷水平调控FCF-23 蛋白水平进而减少并发症的发生。本研究发现,CKD 组患者血清HMGA2 及FCF-23 蛋白水平与ΒUN 呈正相关(P<0.05),结果说明随着CKD 分期增加,患者血清HMGA2 及FCF-23 水平增加,肾功能下降明显,随着患者病情加剧,患者体内血清HMGA2及FCF-23异常性表达增加,肾功能也随之下降,因而在疾病后期可通过调控HMGA2及FCF-23水平提高患者生存质量。
综上所述,与健康对照组相比,CKD 患者血清HMGA2 蛋白、FCF-23 水平升高,且血清HMGA2 蛋白、FCF-23水平与肾功能损伤程度有关。

