外源壳聚糖对低氮胁迫下菜用大豆结瘤固氮及光合作用的影响
李 星,郝佳奇,白颖慧,王 聪
(1.内蒙古民族大学 农学院,内蒙古 通辽 028043;2.通辽市科尔沁左翼中旗农业技术推广中心,内蒙古 通辽 029300)
大豆根瘤固氮是大豆重要的氮素来源,共生固氮系统可提供大豆生命所需氮素的50%~60%,其余主要由土壤氮和肥料氮提供。土壤氮是大豆早期生长发育所需氮素的重要来源[1],土壤中主要有有机氮和无机氮2种,无机氮主要是铵态氮和硝态氮。在根瘤形成的关键时期,氮素不仅能调节大豆的生长发育,还能调节根瘤菌的侵染、结瘤和固氮效率。当氮素缺乏时,为了适应环境,大量用于生长发育的能量被消耗,植物生长受到抑制,根瘤形成受到影响[2]。我国大部分地区的土地普遍存在含氮量偏低的问题,因此,保证低氮胁迫下大豆正常生长发育,使大豆根瘤形成及固氮作用达到最佳具有重要意义。
大豆结瘤固氮和氨同化需要大量的光合产物来提供根系结瘤增加的呼吸负担和有机氮合成所需的碳骨架[3]。大豆根瘤每固定1 g氮,需消耗15~20 g碳水化合物,大豆光合产物的16%会被根瘤消耗。而光合产物主要是以蔗糖的形式运输到“库”端[4],蔗糖的合成、向根部转运及其在根部的积累状况对豆科植物根瘤形成、生长产生重要影响。此外,蔗糖不仅提供豆科植物结瘤固氮的物质基础和能量来源,同时可引起结瘤相关基因表达的变化。大豆MADS-Box 家族转录因子GmNMHC5可促进大豆结瘤,而GmN⁃MHC5的表达受蔗糖的调控,内源蔗糖水平的升高会诱导GmNMHC5的表达,促进大豆结瘤[5]。然而,缺氮会抑制叶绿素合成[6-7],降低光合电子传递速率[8],减弱植物光合作用[9],影响光合产物的形成和能量固定[10-11]。因此,在低氮胁迫下加强叶片光合作用和有机质合成对促进豆科植物结瘤和固氮至关重要。
壳聚糖是一种廉价、清洁的化学物质,由甲壳素脱乙酰化而得,壳聚糖也是一种植物生长调节物质,可调节植物的生长发育,增强植物抗性。研究发现,盐胁迫下喷施壳聚糖可显著提高菜用大豆的结瘤数、瘤鲜重和植株氮含量[12],壳聚糖能调节叶绿素合成相关酶活性,促进叶绿素合成,从而提高玉米叶片的光合能力[13]。笔者前期研究发现,外源壳聚糖可诱导菜用大豆过氧化物酶、超氧化物歧化酶活性升高,显著促进抗坏血酸-谷胱甘肽循环速率[14-15],清除叶绿体中过量的H2O2与,从而保护光合膜结构,维持较高的净光合速率[16-17]。但低氮胁迫下壳聚糖对豆科植物,特别是对菜用大豆结瘤固氮及光合调控机制的研究尚属空白。为此,笔者以菜用大豆-根瘤菌共生体系为试材,研究壳聚糖对低氮胁迫下菜用大豆结瘤固氮及光合作用的影响,为进一步探讨壳聚糖缓解低氮胁迫、促进结瘤固氮的生理机制提供参考,为减少化学氮施用探索新的途径。
1 材料与方法
1.1 供试材料 菜用大豆选用北方主栽品种“日本青”,根瘤菌选用与其共生匹配性较好的费氏中华根瘤菌属(Sinorhizobium fredii)HH103[18](购自黑龙江省农科院微生物研究所)。以(NH4)2SO4与KNO3为氮源。
1.2 试验设计
1.2.1 试材培育 将消毒后的种子播入高17 cm、口径16 cm、底部具小孔的花盆中,以蛭石为基质,每钵5粒,定苗4株。每处理21盆,3次重复,随机排列。
1.2.2 试验处理 处理1(CK):根部供溶有氮素的营养液(最适氮浓度),叶面喷施无菌水;处理2(T1):根部供溶有氮素的营养液(最适氮浓度),叶面喷施CTS 无菌水溶液;处理3(T2):根部供溶有氮素营养液(低氮胁迫浓度),叶面喷施无菌水;处理4(T3):根部供溶有氮素营养液(低氮胁迫浓度),叶面喷施CTS无菌水溶液。分铵态氮与硝态氮2组,完全随机排列。铵态氮最适氮浓度为50 mg·L-1,低氮胁迫浓度为25 mg·L-1,壳聚糖处理的适宜浓度为250 mg·L-1;硝态氮最适氮浓度为50 mg·L-1,低氮胁迫浓度为25 mg·L-1,壳聚糖处理的适宜浓度为200 mg·L-1。均为前期筛选所得结果。
1.2.3 壳聚糖诱导和氮素处理 待2片真叶完全展开后,用手持小型喷雾器将筛选出的适宜浓度壳聚糖溶液均匀喷洒在幼苗叶面上,量足但不下滴,用无菌水喷洒CK和T2处理叶面。壳聚糖诱导处理第5 d时进行氮素处理,氮素溶于1/4浓度的Fahraeus 营养液中,均匀浇入基质。CK 和T1处理只浇灌1/4浓度的Fahraeus无氮营养液。
1.2.4 根瘤菌接种 氮素处理后,将稀释后的菌液(OD600值为0.1)每株接1 mL,用移液枪将菌液喷注到幼苗根部周围,再覆盖一层1 cm左右的蛭石保湿。
1.3 指标测定 各光合参数测定于氮素处理当天开始,记作0 d,之后每5 d 测定1 次,共7 次。采用LI-6400XT 便携式光合仪(美国LI-COR 公司)测定叶片净光合速率(Pn)、胞间CO2浓度(Ci)、气孔导度(Gs)和蒸腾速率(Tr)等参数。
在测定光合参数第30 d时,测定结瘤数、干物质量及植株氮含量;植株氮含量采用凯氏定氮法[19]测定。
1.4 数据分析 利用软件Microsoft Office Excel 2007和DPS数据处理系统进行相关数据处理。
2 结果与分析
2.1 壳聚糖对低氮胁迫下菜用大豆结瘤固氮及干物质量的影响 最适氮条件下,外源壳聚糖(T1)使菜用大豆在铵态氮胁迫与硝态氮胁迫下3个指标较CK均显著升高(P<0.05)。低氮胁迫(T2)导致菜用大豆的根瘤数、氮含量及干物质量均较CK显著下降(P<0.05)。而壳聚糖处理(T3)后,菜用大豆在铵态氮胁迫与硝态氮胁迫下根瘤数、氮含量及干物质量均较T2显著升高(P<0.05),其中,植株氮含量升幅最大,分别达47.55%与43.24%。见表1。
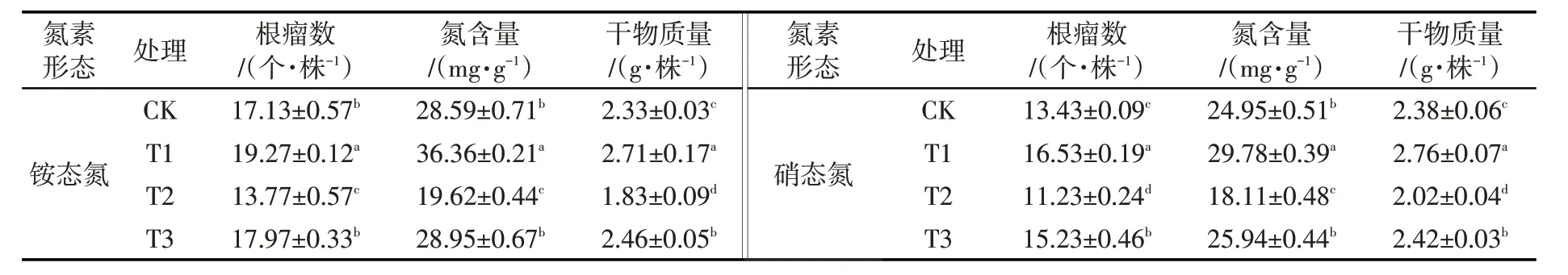
表1 壳聚糖对低氮胁迫下菜用大豆结瘤固氮及干物质量的影响Tab. 1 Effects of chitosan on nodulation nitrogen fixation and dry matter quality of vegetable soybean under low nitrogen stress
2.2 壳聚糖对低氮胁迫下菜用大豆净光合速率(Pn)的影响 以铵态氮与硝态氮为氮源,菜用大豆净光合速率总体呈先升高后降低趋势。T1处理后,铵态氮在第25、30 d时,硝态氮在第5、20、25、30 d时的净光合速率与CK差异不显著,其余时期均显著高于CK(P<0.05),这可能与壳聚糖的时效性有关。与CK相比,低氮胁迫(T2)使菜用大豆净光合速率在各胁迫阶段均降低,除硝态氮第5 d 以外,均呈显著差异(P<0.05)。壳聚糖处理(T3)后,铵态氮、硝态氮净光合速率均较T2升高,其中,铵态氮在第10、15 d时的净光合速率接近CK,第5、20 d时高于CK,增幅达17.73%、10.00%;硝态氮在第5、15 d时接近CK水平,第10 d时显著高于CK,增幅达22.41%。见图1。
2.3 壳聚糖对低氮胁迫下菜用大豆气孔导度(Gs)的影响 以2种氮素形态为氮源,菜用大豆气孔导度整体呈先降低后升高再降低趋势。T1条件下,除铵态氮第25、30 d与硝态氮第30 d增幅不显著外,其他处理阶段均显著高于CK(P<0.05),其中,铵态氮在第15 d时增幅达55.64%,硝态氮在第5、15 d时增幅分别达104.38%、94.22%。在整个胁迫期间,除硝态氮第30 d 外,其他处理阶段T2 均显著低于CK。与T2 相比,铵态氮的T3 处理使叶片气孔导度在胁迫第0、10、15、20 d 时显著升高(P<0.05),其余时期差异不显著,整体平均增幅达32.43%;硝态氮的T3处理使叶片气孔导度在胁迫第20、25、30 d时无显著差异,其余时期均显著升高,整体平均增幅为32.74%。见图2。

图2 壳聚糖对低氮胁迫下菜用大豆气孔导度(Gs)的影响Fig. 2 Effects of chitosan on stomatal conductance(Gs)of vegetable soybean under low nitrogen stress
2.4 壳聚糖对低氮胁迫下菜用大豆胞间CO2浓度(Ci)的影响 与CK相比,2种氮素下,T1除硝态氮第10 d降低不显著外,其他时期均显著降低(P<0.05)。T2叶片胞间CO2浓度在整个胁迫期间,除铵态氮第25 d与硝态氮第10 d以外,均显著低于CK,2种氮源在处理第30 d时降幅分别达45.13%与60.61%,说明低氮胁迫降低菜用大豆叶片净光合速率主要为气孔因素导致。壳聚糖处理(T3)后,与T2相比,铵态氮在第0 d较T2显著升高(P<0.05),其他时间段变化不显著;硝态氮除在第15、20、25 d时较T2显著降低外,其他时间段变化不显著,说明壳聚糖能够通过促进植物体内光合细胞活性,进而增强其光合能力。见图3。

图3 壳聚糖对低氮胁迫下菜用大豆胞间CO2浓度(Ci)的影响Fig. 3 Effects of chitosan on intercellular CO2 concentration(Ci)of vegetable soybean under low nitrogen stress
2.5 壳聚糖对低氮胁迫下菜用大豆蒸腾速率(Tr)的影响 T1条件下,铵态氮在0、10、15、20、25 d时,硝态氮在0、5、10、20 d时较T2显著升高(P<0.05)。2种氮素形态的叶片蒸腾速率在低氮胁迫(T2)下,均显著低于CK(P<0.05)。壳聚糖处理(T3)后,铵态氮在0、5、10、15、20 d 时分别较T2 显著升高8.79%、25.73%、25.20%、61.53%、14.97%;硝态氮在0、5、10、15、20、30 d 时分别较T2 显著升高12.35%、34.99%、26.41%、11.53%、9.15%、35.59%,说明在低氮胁迫和最适氮浓度下,外施壳聚糖均能使菜用大豆叶片的蒸腾速率升高。见图4。

图4 壳聚糖对低氮胁迫下菜用大豆蒸腾速率(Tr)的影响Fig. 4 Effects of chitosan on transpiration rate(Tr)of vegetable soybean under low nitrogen stress
3 讨论
3.1 低氮胁迫下壳聚糖对菜用大豆结瘤固氮的影响 大豆结瘤固氮和氨同化需要大量的光合产物来提供根系结瘤增加的呼吸负担和有机氮合成所需的碳骨架和能量,这些物质和能量主要由光合产物——糖类物质提供。杨忠等[20]研究发现,马桑的结瘤固氮能力与植株叶面积和光合能力密切相关,叶面积大、光合能力强的植株结瘤量大,根瘤固氮活性高,固氮能力强。而缺乏氮素时,植物会消耗大量用于生长的物质与能量来适应环境,使生长受抑制[21],且叶绿素合成受阻、光合作用效率低下,根瘤不能形成。本研究中,2 种氮素形态的低氮胁迫均导致菜用大豆结瘤数、植株氮含量及干物质量显著降低,而壳聚糖处理后,不论在最适氮条件下或是在低氮胁迫条件下,菜用大豆瘤数、植株氮含量及干物质量均显著升高。由此可推断,壳聚糖可促进低氮条件下菜用大豆结瘤固氮,其主要原因之一就是壳聚糖促进了低氮胁迫下菜用大豆的光合作用。
3.2 低氮胁迫下壳聚糖对菜用大豆光合作用的影响 植物进行光合作用时,气孔是植物与环境之间进行二氧化碳和水蒸气交换的通道,气孔导度的高低直接影响光合作用的强度,二氧化碳是植物进行光合作用的底物,胞间二氧化碳浓度会影响植物的光合速率,而净光合速率是判断植物光合系统是否正常工作的重要依据。植物净光合速率变化的原因主要分为气孔因素和非气孔因素[22]。当Pn、Gs及Tr下降的同时Ci也下降时,气孔因素占主导;当Pn、Gs与Tr下降而Ci升高,或者Pn、Gs及Tr下降而Ci变化不明显时,则是由非气孔因素所致。本研究结果发现,铵态氮、硝态氮低氮胁迫使菜用大豆Pn、Gs、Tr及Ci同时显著下降,这与在玉米[23]、大豆[24]、茄子[25]中的研究结果一致。而壳聚糖处理显著提高了2种氮素形态低氮胁迫下的Pn、Gs和Tr,却使Ci降低,同时,最适氮条件下,壳聚糖对菜用大豆光合参数的增益同样显著,规律与低氮胁迫下一致,说明低氮胁迫使菜用大豆叶片净光合速率降低主要由气孔因素导致,而壳聚糖对低氮胁迫或最适氮条件下叶片净光合速率的提升主要与非气孔因素关系紧密。本研究中,外源壳聚糖使低氮胁迫下菜用大豆光合速率升高,一方面为菜用大豆生长和发育提供了充足的碳源和能源,另一方面,充足的光合产物能为根瘤中提供固氮所需的碳骨架、能量及还原剂,同时还可提高植物体内物质合成与转运的能力,进而缓解低氮胁迫对植物的抑制作用。
值得注意的是,豆科植物的光合作用是一个非常复杂的生理过程,低氮胁迫下,壳聚糖对菜用大豆光合作用的具体调控机制还有待于进一步深入研究。
4 结论
壳聚糖通过促进低氮胁迫下菜用大豆光合作用,为植株生长发育及结瘤固氮提供较充足的碳源和能源,同时,高水平的物质合成与转运的能力也可有效缓解低氮胁迫对植物体的抑制作用。这可能是壳聚糖提高低氮胁迫下菜用大豆结瘤固氮的重要原因之一。
——固氮微生物

