PET/CT相关参数与非小细胞肺癌PD-L1表达的相关性研究
段梦月 胡春峰 鲍慧新
1.徐州医科大学附属医院放射科(江苏 徐州 221006)
2.徐州医科大学附属医院放射科(江苏 徐州 221006)
肺癌是世界上最常见的恶性肿瘤,也是导致癌症死亡的最大原因,每年有160万人死于肺癌[1]。非小细胞肺癌(Non-small cell lung cancer,NSCLC)是最常见的肺癌类型,约占所有肺癌的80 -90%[2]。NSCLC的治疗正变得越来越个性化,这是由于针对患者生物标志物的有效治疗驱动的。PD-1/PD-L1通路是一个重要的抑制性检查点,肿瘤细胞或肿瘤浸润性免疫细胞表达PD-L1抑制抗肿瘤免疫反应[3]。这一免疫检查点抑制剂抗PD -1/PD-L1药物在治疗NSCLC中显示出了良好的效果[4]。在非小细胞肺癌中,18F-FDG PET/CT是一种有价值的无创检测及分期方法,在各个方面表现出潜力,比如区分基因表达、原发灶及转移、预测生存和疗效等[5]。最近的许多研究一直强调PET/CT放射组学在肺癌中的潜在优势[6]。但是关于非小细胞肺癌PD-L1表达与PET/CT放射组学之间的关系研究甚少。本研究主要对非小细胞肺癌组织中PD-L1表达的水平及PET/CT放射组学参数的测定,进一步比较了各参数在预测PD-L1表达状态的价值。
1 资料与方法
1.1 一般资料收集了2018年3月到2021年3月初诊为非小细胞肺癌患者临床资料。其中男34例,女28例,平均年龄(61±0.6)岁;病理类型:腺癌45例,鳞癌17例。
纳入标准:原发性NSCLC诊断明确;行18F-FDG PET/CT检查前未进行临床治疗;患者进行病理检测且与18F-FDG PET/CT检查时间间隔小于1个月。排除标准:18F-FDG PET/CT检查图像不完整者;有其他系统肿瘤病史,原发病灶不能确定。所有患者手术治疗前给予18F-FDG PET/CT检查,并经病理给予确诊。入选的62例患者均知情同意并接受本研究。
1.2 18F-FDG PET/CT的检查及放射组学参数提取所有患者使用GE Discovery PET/CT Elite扫描仪进行图像采集,检查前患者禁食4-6小时,使血糖维持在8.5-11.1mmol/L,18F-FDG注射剂量为3.7MBq-4.44MBq/kg。注射后,所有患者休息1小时,休息期间不得饮用或输注含有葡糖糖类的饮料或注射液。检查前排空膀胱。首先采用低剂量螺旋CT扫描(电压:120keV,电流:180 mAs)进行组织衰减校正,然后使用7到8个重叠的床位(从颅骨顶部开始到大腿中部结束,每次2分钟)获得全身放射图像。图像重建算法为滤波反投影法(FBP)。
1.3 PET图像分析及处理传统参数提取:PET/ CT 图像识别由2 位高年资的核医学科医师一起确定,并通过计算机程序自动获取18F-FDG PET/CT 显象中的最大标准化摄取值(SUVmax)。
放射组学参数提取:均在Research Omni-Kinetics (Version V2.1.0-2017.11.16)软件上进行。将入组患者的PET图像序列以DICOM格式导入软件,由2名具有丰富诊断经验的放射科医生采用3D勾画法勾画病灶边界ROI,勾画区域包括坏死、囊变、钙化等肿瘤内部影像信息(图1、图2、图3)。软件自动绘出直方图图像并计算出ROI内4个类别的放射组学参数共76个,包括一阶灰度直方图(Histogram)参数29个,灰度共生矩阵(the gray-level co-occurrence matri,GLCM)参数28个,灰度游程(the grey level run-length matrix,,RLM)参数10个,形状参数(Morphology Metrics)9个。
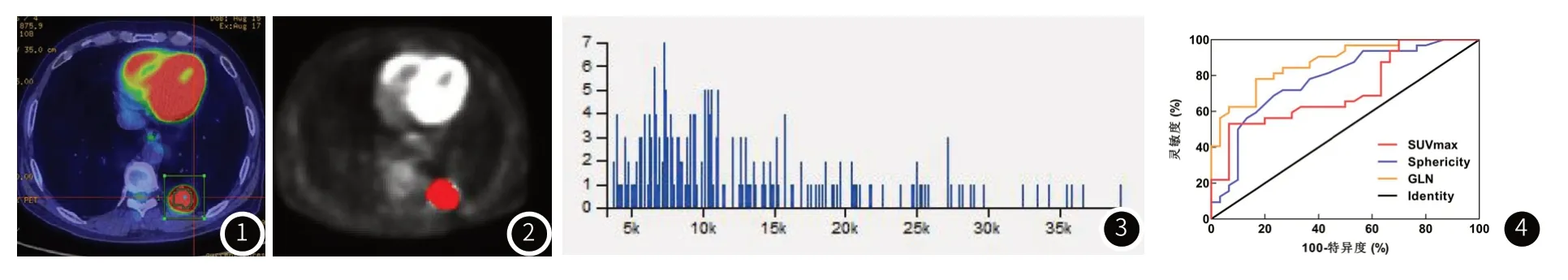
图1 女,48岁,左肺下叶腺癌,临床TNM分期III期。采用3D勾画法勾画RO1,自动计算生成肺癌原发灶PET代谢参数SUVmax。图2~图3 与图1属于同一患者,为患者轴位PET图像经ROI勾画,输出直方图。图4 各个指标预测PD-L1表达状态的ROC曲线
1.4 PD-L1的测定石蜡包被的肿瘤标本采用切片机切片,使用PD-L1单克隆抗体(抗体号22C3),采用ENVISION染色后进行免疫组化分析。根据肿瘤比例评分(Tumor proportion score,TPS)代表任何强度的部分或完全膜染色的肿瘤细胞占标本中所有肿瘤细胞的百分比。PD-L1阳性的肿瘤细胞由两名独立的病理学家在光镜下评估,他们对患者的临床信息不知情。TPS<1%诊断为阴性表达,TPS≥1%诊断为阳性表达[7]。
1.5 统计学分析采用SPSS 25.0软件处理所得数据。服从或近似服从正态分布的计量资料,数据采用“均数±标准差”()表示,不服从正态分布的计量资料以中位数表示,组间比较采用方差分析定义。绘制受试者工作特征(receiver operating characteristic,ROC)曲,计算曲线下面积(areaunder the curve,AUC),探究各项参数预测PD-L1表达状态的效能。检验水准a=0.05,P<0.05为差异有统计学意义。
2 结果
2.1 患者临床特征及其与PD-L1表达状态的关系62例患者中PD-L1阳性组32例,阴性组30例。两组在性别、年龄、吸烟史、TNM分期、病理类型之间均无显著相关性(P>0.05);在肿瘤的分化程度存在统计学差异(P<0.05)。TNM分期按国际肺癌研究协会(IASLC)第七版标准。62例患者临床特征与PD-L1状态关系见表1。

表1 62例患者临床特征与PD-L1表达状态的关系
2.2 PET图像相关参数的单因素分析PET相关参数一共77个,包括一个传统参数(SUVmax)和76个纹理参数。对参数进行统计后得出6个参数,分别为1个传统参数(SUVmax)、一阶灰度直方图参数1个(平均值),灰度共生矩阵参数2个(熵值、灰阶不均匀性GreyLevelNonuniformit,GLN),灰度游程参数1个(游程长不均匀性RunLengthNonuniformity,RLN),形状参数1个(球形度Sphericity)。单因素有统计学意义的参数见表2。PD-L1阳性组患者的纹理参数平均值、熵值、GLN、RLN高于阴性组;PD-L1阳性组Sphericity低于阴性组(P值均小于0.05)。

表2 PD-L1阳性组和阴性组所得的参数比较
2.3 采用Logistic回归分析PD-L1表达的影响因素影响PD-L1表达的Logistic回归分析结果见表3。以PD-L1表达情况为因变量(阳性=1,阴性=0),以平均值、熵值、GLN、RLN、Sphericity、SUVmax、分化程度(低分化=0,中-高分化=1)为自变量,采用条件向前法建立二元logistic回归模型(纳入标准0.05,排除标准0.10),结果显示GLN、SUVmax、分化程度、Sphericity在模型中均有统计学意义(P<0.05)。

表3 影响PD-L1表达因素的logistic回归
2.4 比较所选参数对NSCLC患者PD-L1表达的预测价值GLN、SUVmax、Sphericity诊断PD-L1表达阳性的ROC曲线见表4、图2。由ROC曲线可知,GLN、SUVmax、Sphericity诊断P表达阳性的曲线下面积分别为0.873、0.717、0.777,对应P值均小于0.05,说明各指标诊断P表达阳性的价值均有统计学意义。GLN诊断PD-L1表达阳性的阈值为2.395,对应灵敏度为78.1%,特异度为83.3%;SUVmax诊断PD-L1表达阳性的阈值为17.75,对应灵敏度为53.1%,特异度为93.3%;Sphericity诊断PD-L1表达阳性的阈值为0.895,对应灵敏度为68.7%,特异度为76.7%。GLN、SUVmax、Sphericity诊断PD-L1表达阳性的曲线下面积经Z检验结果显示,GLN曲线下面积明显高于SUVmax,差异有统计学意义(P<0.05)(见表5),说明GLN诊断PD-L1表达阳性的效能较其他指标较高。

表4 各参数预测PD-L1表达的效能

表5 各指标曲线下面积比较
3 讨论
国外学者认为,PD-L1表达与其他临床特征如年龄、性别、分期、吸烟情况均无显著相关性,而在鳞状细胞癌中明显较高,而在腺癌中较低[8]。本研究未发现PD-L1的表达与患者的病理类型有相关性。其原因可能是由于本研究病例数较少,且纳入的病例均来源于同一单位,存在选择偏倚。此外本研究发现非小细胞肺癌的分化程度与PD-L1的表达存在相关性,低分化的非小细胞肺癌患者的PD-L1的表达阳性率高于高分化患者,与何海栋[9]等人的研究结果一致。分化代表细胞发育过程中的形态变化。分化程度即为肿瘤组织与正常组织相近程度,癌细胞分化程度越高越接近正常的组织细胞。有研究者[10]发现分化差、侵袭性行为模式和逃避宿主免疫监测这些特征是密切相关的,在实性肿瘤低分化区往往出现PD-L1高表达的情况,可能是由于PD-L1高表达与Ki-67增殖指数高、E-cadherin低表达、vimentin(波形蛋白)高表达相关,也就从侧面验证了低分化非小细胞肺癌患者的PD-L1的表达阳性率高于高分化患者。
传统代谢参数SUVmax从肿瘤代谢方面评价了肿瘤的性质,可以在一定程度上提示肿瘤组织在分子水平上的代谢信息。PD-L1在免疫机制中通过缺氧诱导因子Iα(HIFIα)增强肿瘤细胞内糖酵解过程,大量消耗葡萄糖,进而可增加F-FDG摄取[11]。本研究结果显示PD-L1阳性组的SUVmax高于阴性组(P值<0.05)。本研究证实了上述学说,提示了PD-L1的表达与糖代谢存在相关性。放射组学是对医学扫描图像特征进行定量提取纹理参数。研究表明放射组学有潜力通过检测人类肉眼无法察觉的特征和模式来改进传统参数的局限性[12]。纹理参数主要反映肿瘤的异质性。本研究结果显示:PD-L1阳性组患者的纹理参数GLN高于阴性组;PD-L1阳性组Sphericity低于阴性组(P值均小于0.05)。GLN反映图像灰度的不均匀度,其值越低,图像灰度越均匀。这两者也就提示了PD-L1阳性组患者肿瘤实质代谢更不均匀。在Jreige[13]等人的研究中显示高PD-L1表达的患者在代谢上有较低的MMVR,提示高PD-L1表达的病灶内部坏死成分越多,功能代谢的成分越少或肿瘤代谢活性减低,也就导致了图像的异质性较强。球形是指为肿瘤体积与球体相比的程度,值越大提示病变越接近于球形。本研究提示PD-L1阴性组的肿瘤更趋向球形,形态更加规则。有笔者[14]认为在与PD-L1<1%的非小细胞癌患者中相比,PD-L1表达阳性者的肿瘤病变球形度更小。目前纹理分析多用于鉴别肿瘤的诊断、疗效及预后等,且多基于CT图像及PET/CT融合图像的分析[15-17]。近期有研究发现基于PET/CT扫描利用纹理分析可预测肿瘤基因的突变状态[18],但很少有数据表明其在评价免疫调节分子表达,特别是PD-L1方面的潜在用途。在有丝分裂前或分裂期间的细胞核中发现Ki-67抗原表达,它与染色质凝结和姐妹染色单体分离有关,通常被用作确定癌细胞增殖潜能的标志物[19]。Payelczyk等发现PD-L1与Ki-67存在正相关性,证实PD-L1表达与肿瘤细胞增殖有关[20]。坏死被证实是非小细胞肺癌侵袭性的预测因子[21]。有研究表明炎症细胞因子IL-7和TNF-α直接上调前列腺癌、结肠癌细胞中的PD-L1的表达[22],TNF-α是一种可以诱导快速出血坏死的因子。Chang等近期研究发现肺多形性癌患者中发现的PD-L1高表达与肿瘤坏死之间的显著相关性是一致的[23]。笔者认为PD-L1阳性组肿瘤中内部的不均匀、异质性及侵袭性增加归咎于肿瘤细胞增殖速度的加快及肿瘤缺氧、坏死成分较多。
本文存在以下一些局限性:1.本文选取的各组别的样本数偏小,存在抽样误差,我们在后续工作中将持续收集病例,扩大样本量。2.本研究属于回顾性研究,样本均于同一单位选取,无法避免选择偏倚。3.患者行18F FDG-PET/CT检查与病理检测时间间隔不同,虽控制于1个月内,但无法避免患者体内的不稳定性。综上所述,NSCLC患者的PET/CT参数与PD-L1的表达是有相关性的,并且能够预测其表达。PET参数较既往传统参数更有价值,可以对非侵入性评估PD-L1表达进行补充,对临床治疗起到一定的参考价值。为了进一步验证放射组学特征的预测能力,需要进行更多的独立性研究。

