经阴道单孔与常规多孔腹腔镜卵巢囊肿剔除术的疗效对比
张淑萍 杨秀玮 董粟心
卵巢肿瘤是育龄期女性常见的内生殖器官肿瘤,约75%组织学分型为良性肿瘤[1]。经阴道单孔腹腔镜手术可将切口隐藏于阴道内,保持腹部皮肤完整,因而有效避免传统手术的腹部切口,具有良好的美容效果[2]。但经阴道单孔腹腔镜用于良性卵巢肿瘤治疗的国内报道不多,并且缺乏系统的对比分析[3]。现阶段,临床治疗良性卵巢肿瘤的主要手段为病灶组织剔除手术,常见方式主要包含开腹手术、腹腔镜微创手术等。与传统开腹手术相比,腹腔镜微创技术在临床妇科疾病治疗中的有效性、安全性以及可行性均已被大量研究资料所证实[4]。有鉴于此,本文将我院妇科收治的64例良性卵巢肿瘤患者分组治疗和比较,重点探究不同腹腔镜治疗方案在良性卵巢肿瘤治疗中的近远期疗效。现将相关内容阐述如下:
1 资料与方法
1.1 一般资料 选择2020年1月1日-2022年3月30日我院妇科收治的良性卵巢肿瘤患者64例,并依据治疗手段的差异性将患者分为两组。对照组纳入患者32例,研究组纳入患者32例,两组患者的一般资料比较,差异无统计学意义(P>0.05),具有可比性,见表1。本研究经过我院伦理委员会审核批准。
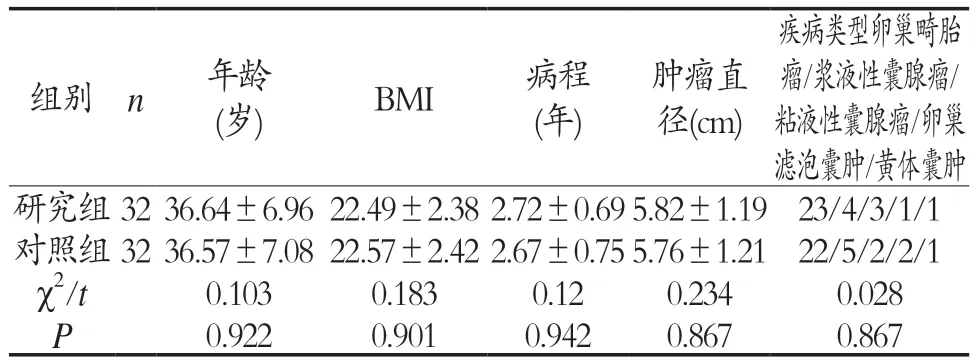
表1 两组患者一般资料比较
1.2 纳入及排除标准 ①纳入标准:有性生活史的患者;未绝经的患者;具有卵巢囊肿手术治疗指征的患者;知情自愿参加本次研究并签署纸质协议的患者。②排除标准:无性生活史的患者;存在子宫直肠陷凹封闭、盆腔广泛粘连的患者;阴道极度狭窄的患者;合并盆腔恶性肿瘤的患者;罹患全身性严重疾病的患者。
1.3 研究方法
1.3.1 对照组 对患者行常规多孔腹腔镜卵巢囊肿剔除术,具体操作方法:指导患者在手术台上保持仰卧姿态,待全身麻醉成功后,在患者脐部做纵行切口,长约1 cm,然后将腹腔镜置入;在患者的下腹部做穿刺孔2个,置入手术器械,并对气腹管予以连接,完成人工气腹的建立;之后手术步骤与研究组保持一致,术毕逐层缝合腹壁各处的切口,并对患者实施常规术后镇痛操作。
1.3.2 研究组 对患者行经阴道单孔腹腔镜卵巢囊肿剔除术,具体操作方法:协助患者在手术台上保持膀胱截石位,全身麻醉起效后,对两侧的小阴唇予以妥善固定;充分暴露患者的阴道,对外阴、阴道以及宫颈等部位进行常规消毒;在患者的阴道后穹窿处做长度约为2 cm的弧形手术切口,并由此进入患者的腹腔;常规置入Port,及时连接气腹管,建立人工气腹,而后将腹腔镜视频器械置入;通过10 mm通道将摄像头置入,通过5 mm通道将分离钳置入,然后在患者卵巢门正常组织处对包膜实施环形切开;利用弯钳的帮助对囊肿实施钝性分离并完整剥除;对剩余卵巢组织可凭借2号可吸收线缝合成形,如在手术中遇到囊肿体积较大的患者,需要对部分囊液进行吸出,向外牵拉患者的囊壁,然后在直视条件下剥除并缝合囊肿;取大量生理盐水对创面进行冲洗,继续使用2号可吸收线对创面实施间断或连续缝合,并进行有效止血,如有必要也可对患者采取电凝止血;手术结束后,将患者调整为头低脚高位,并放出腹腔气体;妥善放置阴道T型引流管,对阴道后穹窿切口进行逐层缝合并止血,完成手术。术后24 h,还应继续对患者留置导尿管和阴道碘伏纱条,应根据患者的手术情况合理使用抗生素,以免术后感染事件的发生。
1.4 观察指标 详细记录两组患者的各项围手术期指标。采用疼痛视觉模拟评分(VAS)评估两组患者术后不同时间段内的疼痛情况,评分越高表示疼痛程度越剧烈。此外,采集两组患者术前及术后的空腹静脉血约4 mL,经高速离心操作后分离血清,后凭借电化学发光法对其血清雌二醇(E2)、促卵泡生成素(FSH)以及促黄体生成素(LH)水平予以检测。
1.5 统计学方法 所得相关数据应用SPSS 21.0统计学软件分析,计量资料采用均值±标准差()表示,使用t检验;计数资料采用(n,%)表示,使用χ2检验。P<0.05表示差异有统计学意义。
2 结 果
2.1 两组患者围手术期临床指标比较 研究组患者的围术期时间指标均少于或短于对照组相应指标,差异具有统计学意义(P<0.05),见表2。
表2 两组患者围手术期临床指标比较()
术后首次下床时间(h)组别 n 手术所耗时间(min)术中出血量(mL)肛门排气时间(h)对照组 3271.52±22.0526.73±6.0413.02±7.5818.12±7.64研究组 3250.96±18.4218.12±6.7512.11±4.9512.52±2.06 t 4.048 5.377 0.568 9.007 P 0.001 0.001 0.572 0.001
2.2 两组患者术后不同时间段内的VAS评分比较 两组患者术后VAS评分逐渐降低,且与对照组相比,相同时间点研究组患者的VAS评分更低,差异具有统计学意义(P<0.05),见表3。
表3 两组患者术后不同时间段内的VAS评分比较(,分)

表3 两组患者术后不同时间段内的VAS评分比较(,分)
组别 n 术后1 d 术后2 d 术后3 d对照组 32 3.52±1.48 1.47±0.82 0.66±0.15研究组 32 1.56±0.63 0.86±0.24 0.16±0.08 t 6.893 4.038 16.637 P 0.001 0.001 0.001
2.3 两组患者治疗前后雌激素水平比较 治疗后,两组患者的E2水平均显著降低,FSH、LH水平明显升高,但两组间差异无统计学意义(P>0.05),见表4。
表4 两组患者治疗前后雌激素水平比较()
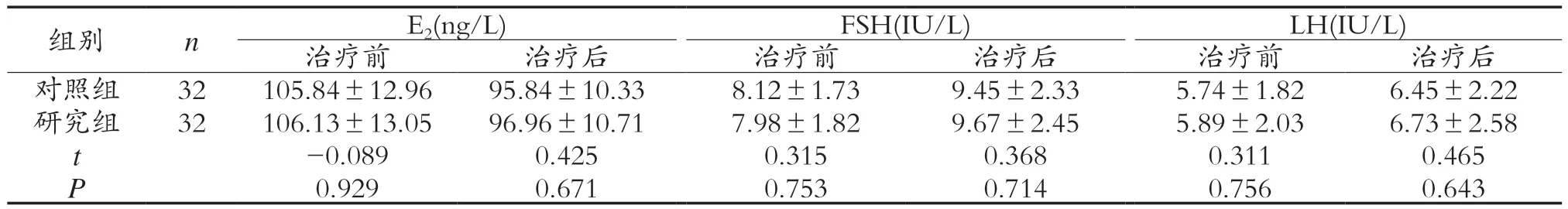
表4 两组患者治疗前后雌激素水平比较()
组别 n E2(ng/L) FSH(IU/L) LH(IU/L)治疗前 治疗后 治疗前 治疗后 治疗前 治疗后对照组 32 105.84±12.96 95.84±10.33 8.12±1.73 9.45±2.33 5.74±1.82 6.45±2.22研究组 32 106.13±13.05 96.96±10.71 7.98±1.82 9.67±2.45 5.89±2.03 6.73±2.58 t-0.089 0.425 0.315 0.368 0.311 0.465 P 0.929 0.671 0.753 0.714 0.756 0.643
3 讨 论
由于激素水平过高、炎症性刺激所致的良性卵巢肿瘤属妇科较为常见的一种生殖系统肿瘤疾病。有研究指出,内分泌失调、遗传、不良生活方式、精神紧张等原因也与此类疾病的发生具有十分密切的关系[5]。疾病发作时,绝大部分患者可自觉腹部肿块、压迫以及剧烈疼痛等症状,再加之组织分型相对复杂,部分病灶甚至具有恶化的风险,如未能及时采取有效的介入治疗手段,可对患者的身体健康、生活质量造成极大的影响[6]。
腹腔镜卵巢囊肿剔除术是现阶段临床用于治疗良性卵巢肿瘤的一种比较成熟的手术方案,与此类术式相比较,传统开腹手术的应用不仅会在患者腹部遗留较为明显的瘢痕,而且还会在术后出现切口疝、腹壁血管损伤、卵巢功能障碍以及切口感染等并发症。伴随着现代微创外科技术的持续进步和发展,临床在确保疾病治疗效果的基础上,逐渐开始追求低术后并发症发生率、较短住院时间、较小手术切口瘢痕,在某些临床妇科疾病治疗中甚至还需要做到“无瘢痕”手术操作[7]。较传统开腹手术而言,常规多孔腹腔镜卵巢囊肿剔除术的实施既能保证良好的美容效果,又可以减轻术后疼痛程度。但有研究指出,常规多孔腹腔镜卵巢囊肿剔除术在术后仍会在患者的脐部遗留长达1 cm左右的瘢痕,且仍具有较高的脐部切口疝发生风险[8]。经阴道单孔腹腔镜卵巢囊肿剔除术是近几年来新兴于临床妇科的一种微创手术治疗方式,该术式多集中在患者的腹腔或盆腔内操作,由于手术切口通常位于阴道穹隆部,避免在患者体表遗留瘢痕的同时,还能提高手术美观性,缓解因手术操作造成的机体创伤。此次研究通过对收治的64例需行腹腔镜卵巢囊肿剔除术的良性卵巢肿瘤患者分组,比较了经阴道单孔与常规多孔腹腔镜卵巢囊肿剔除术的疗效。
本研究结果显示:研究组患者在围手术期内所耗的手术操作时间、术中出血量、术后首次下床时间均少于对照组(P<0.05)。比较两组患者在术后1 d、2 d和3 d的VAS评分,研究组均低于对照组(P<0.05)。由此证实,经阴道单孔腹腔镜卵巢囊肿剔除术较之常规多孔腹腔镜手术更具有优势,改善患者围手术期相关指标和术后疼痛症状。推测造成上述结果的原因在于,经阴道单孔腹腔镜手术切口单一,而常规多孔腹腔镜手术则会在患者体表做多处切口,因而经阴道切口损伤的血管、神经少于腹部切口,切口疼痛程度相对较轻;同时手术位置距离阴道壁切口较近,腹腔内低腹状态下即可完成手术,尽管释放气腹的通道少,术后气腹所致的疼痛程度也比多孔腹腔镜手术轻。故而经阴道单孔腹腔镜卵巢囊肿剔除术在良性卵巢肿瘤治疗中的整体效果更为突出[9]。本研究结果显示:治疗后,两组患者的E2水平均显著降低,FSH、LH水平明显升高,但组间对比差异无统计学意义(P>0.05)。手术可能会影响患者卵巢功能,致使E2水平降低,LH、FSH水平升高,甚至部分患者会出现月经不规律的现象,且卵巢良性肿瘤手术亦可能会破坏正常卵巢组织,使卵巢功能受到影响。本研究结果显示,研究组患者E2、LH和FSH水平与对照组比较,差异无统计学意义(P>0.05),表明经阴道单孔腹腔镜卵巢囊肿剔除术对患者卵巢功能影响较小。
综上所述,经阴道单孔腹腔镜卵巢囊肿剔除术可减少手术创伤,降低疼痛程度,有效改善患者的机体细胞免疫功能、卵巢功能,值得借鉴或推广。

