运动疗法与营养干预对血液透析肌少症患者影响的Meta分析
吴庆峰,李 珍,常立阳,章 莉,孙秋英
1.杭州市红十字会医院,浙江杭州 310003;2.杭州市中医院,浙江杭州 310006
血液透析(hemodialysis,HD)是终末期肾脏病(end stage renal disease,ESRD)患者最常用的治疗方法之一,能维持机体内环境稳定,延长患者生命。但是随着HD患者年龄的增长与疾病的进展,易发生肌少症(sarcopenia,SP)。SP是以肌肉质量下降,活动耐受力减退、心肺功能降低为主要特征的退行性综合征,若任其发展,将增加跌倒、骨折、心血管事件等发病率[1]。有研究[2-3]显示,行HD的ESRD患者,SP发病率高于普通人群5~10倍,已逐渐成为危害HD患者生命健康和生活质量的不利因素之一。运动疗法是以运动医学为原理,在充分评估患者身体状况后,选择合适的运动模式,利用器械或自身力量进行训练,达到改善患者全身或局部运动能力的治疗方法[4]。国际肾脏病组织、美国肾脏病基金会推荐血液透析肌少症(以下简称HD-SP)患者通过持续运动疗法或营养支持来改善SP症状,提高身体机能[5]。近年来,关于运动疗法改善HD-SP患者的研究逐渐增多,但是对在运动疗法后是否应及时进行营养干预研究较少且结论不一。因此,本研究通过对运动疗法联合营养干预相关文献进行Meta分析,探讨其对HD-SP患者的干预效果,以期为HD-SP患者SP干预方案提供临床依据。
1 资料与方法
1.1 文献纳入与排除标准
纳入标准:研究类型为运动疗法联合营养干预治疗HD-SP患者的临床随机对照试验;研究对象:年龄≥18岁,符合ESRD诊断行规律HD治疗且合并SP的患者,规律HD治疗是指透析时间≥3个月,每周2~3次[6];干预措施为试验组为运动疗法联合营养干预、对照组为单独运动疗法或营养干预;评价指标至少包括以下指标中的任意一种,肌肉力量包括握力(handgrip strength,HGS)及腿部负重力量(leg press strength,LPS),肌肉质量包括骨骼肌质量指数(skeletal muscle mass index,SMI)及瘦体重(lean body mass,LBM),身体功能包括步行速度(gait speed,GS)、6 min步行试验(6-minute walk test,6MWT)及30 s坐立测试(30-second sit-to-stand test,30 s-STS)。排除标准:无法获取全文的文献,重复发表的文献、综述或会议论文,非中英文文献;研究对象为非规律行HD患者;无对照组或治疗前后数据不完整的文献。
1.2 文献检索策略
计算机检索PubMed、Embase、Cochrane Library、Web of Science、PsycINFO、Scopus、中国知网、维普资讯中文期刊服务平台、万方数据知识服务平台等国内外数据库中有关运动疗法联合营养干预应用于HD-SP患者的文献。检索策略采用主题词和自由词相结合的方法,检索时限为自建库起至2021年12月31日。中文检索词包括“血液透析/血透/透析”和“运动/健身/抗阻力练习/抗阻力运动/有氧练习/有氧运动/锻炼/训练/举重/自行车/登山/步行/健步走/太极拳”和“肌肉减少症/肌少症/衰弱”“营养/营养支持/营养干预/营养不良”等。英文检索词包括“hemodialysis/haemodialysis/dialysis/renal dialysis/extracorporeal dialysis/dialyses/intradialytic”and“exercise/training/physical activity/resistance training/resistance exercise/aerobic trainging/aerobic exercise/strength exercise/weight lifting/climbing/bicycle/walking/tai chi”and“sarcopenia/less muscle disease/muscle less/weakness/muscle wasting”“nutrition/nutritional support/nutrition intervention/malnutrition”等。此外,手工检索相关综述和纳入文献的参考文献。
1.3 文献筛选与资料提取
去重后,由2名研究者分别根据纳排标准对检索的文献文题和摘要进行独立初筛并交叉核对,如有分歧,通过讨论或联系原文作者最终确定是否纳入研究,必要时咨询第3名研究者。由1名研究者负责资料提取,对符合标准的文献进行全文阅读,按照预设计表格提取文献作者、发表时间、国家、样本量、干预时间、干预方法、结局指标等,由第2名研究者进行内容复核校对。
1.4 文献质量评估
由2名研究者独立根据Cochrane系统评价手册[7]对文献进行偏倚风险评价。按照随机分配方法、分配隐藏、实施者与研究对象盲法、结果测量盲法、结果数据完整性、选择性报告、其他偏倚7个方面进行评价,评价结果为“低风险”“高风险”和“存在顾虑”,当文献偏倚风险评价结果全部为低风险时质量为A级,部分为低风险时质量为B级,完全不符合低风险时质量为C级,将此类文献予以剔除。随后由2名研究者进行讨论并确定,有分歧时,邀请第3名研究者共同讨论解决。
1.5 统计学方法
采用RevMan 5.3软件进行Meta分析,通过x2检验P值和I2检验确定研究的异质性。若P≥0.1,且I2≤50%,则认为研究具有同质性,采用固定效应模型;若P<0.1,I2>50%,则认为研究具有异质性,采用随机效应模型。若结局指标采用相同测量工具获得,则采用加权均数差(WMD)进行分析;若结局指标采用不同测量工具获得,则采用标准化均数差(SMD)进行分析。以P<0.05为差异有统计学意义,效应值以95%置信区间(95%CI)表示。
2 结果
2.1 文献检索结果
英文数据库检索获得文献833篇,中文数据库检索获得文献219篇,检索纳入文献的参考文献后补充文献15篇,共1 067篇。筛选后最终纳入英文文献9篇[8-16]。文献筛选流程及结果见图1。
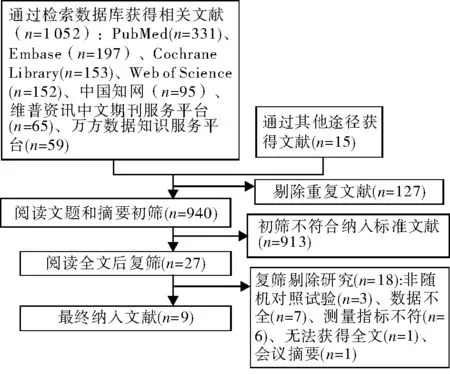
图1 文献筛选流程及结果
2.2 纳入文献的基本特征
纳入的文献来自5个国家,发表年限2007-2020年。研究对象为HD-SP患者,共513例患者。研究设计均为随机对照研究,为运动疗法联合营养干预与单独运动疗法或营养干预比较,试验组样本量256例,对照组样本量257例。干预周期为12周~2年,干预频率为2~3次/周。结局指标主要为肌肉力量、肌肉质量、身体功能3种类型。见表1。
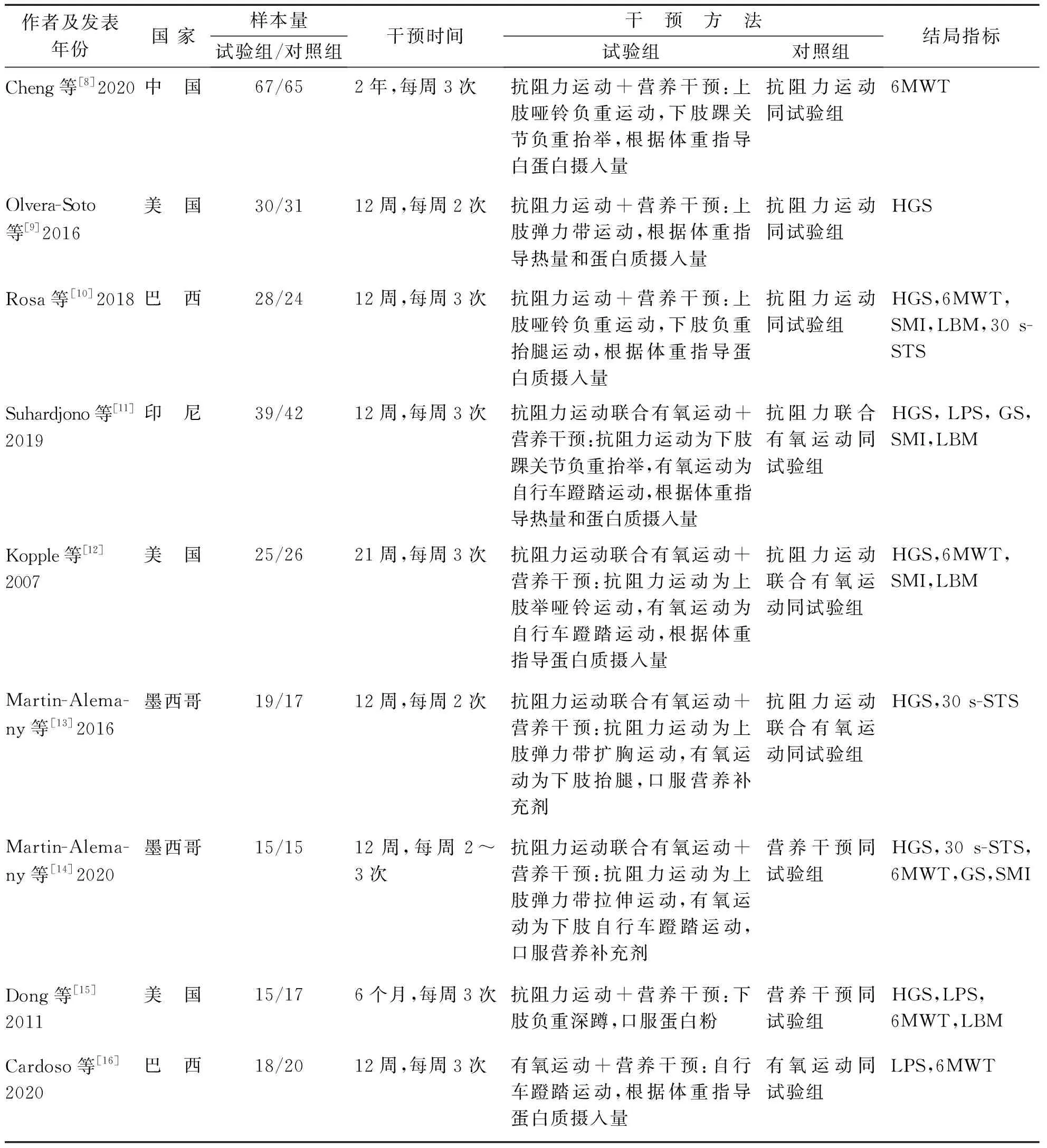
表1 纳入文献的基本特征
2.3 纳入文献质量和偏倚风险评价结果
9篇纳入文献质量和偏倚风险评价,其中文献[8-15]质量等级为A、文献[16]质量等级为B。
2.4 Meta分析结果
2.4.1肌肉力量
评价肌肉力量指标包括HGS和LPS。
2.4.1.1 HGS
7项研究[9-15]报道了HD-SP患者运动疗法联合营养干预前后HGS变化情况,研究对象共343例,与单独运动疗法或营养干预组(对照组)进行比较,运动疗法联合营养干预组(试验组)无明显异质性P=0.92,I2=0%,选用固定效应模型进行分析,见图2。研究结果显示MD=3.78,95%CI(2.02,5.53),P<0.001,差异有统计学意义。
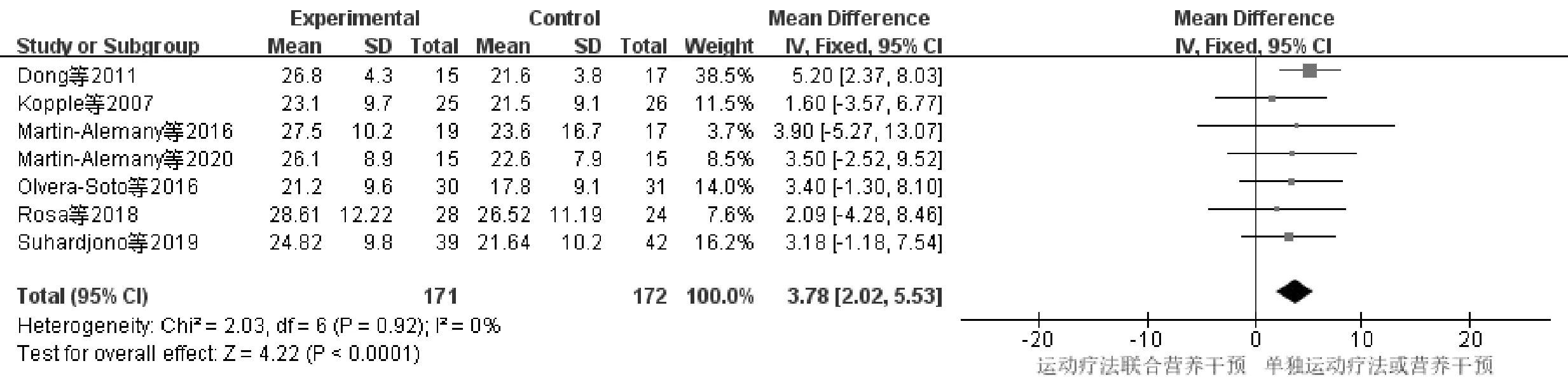
图2 运动疗法联合营养干预对HGS影响的Meta分析森林图
2.4.1.2 LPS
3项研究[11,15-16]报道了HD-SP患者运动疗法联合营养干预前后腿部力量LPS变化情况,研究对象共151例,与单独运动疗法或营养干预组(对照组)相比,运动疗法联合营养干预组(试验组)无明显异质性P=0.64,I2=0%,选用固定效应模型进行分析,见图3。研究结果显示MD=5.52,95%CI(1.47,9.58),P=0.008,差异有统计学意义。

图3 运动疗法联合营养干预对LPS影响的Meta分析森林图
2.4.2肌肉质量
评价肌肉质量指标包括SMI和LBM。
2.4.2.1 SMI
4项研究[10-12,14]报道了HD-SP患者运动疗法联合营养干预前后SMI变化情况,研究对象共214例,与单独运动疗法或营养干预(对照组)相比,运动疗法联合营养干预组(试验组)的异质性较小P=0.13,I2=47%,选用固定效应模型进行统计分析,见图4。研究结果显示MD=0.69,95%CI(0.36,1.03),P<0.001,差异有统计学意义。
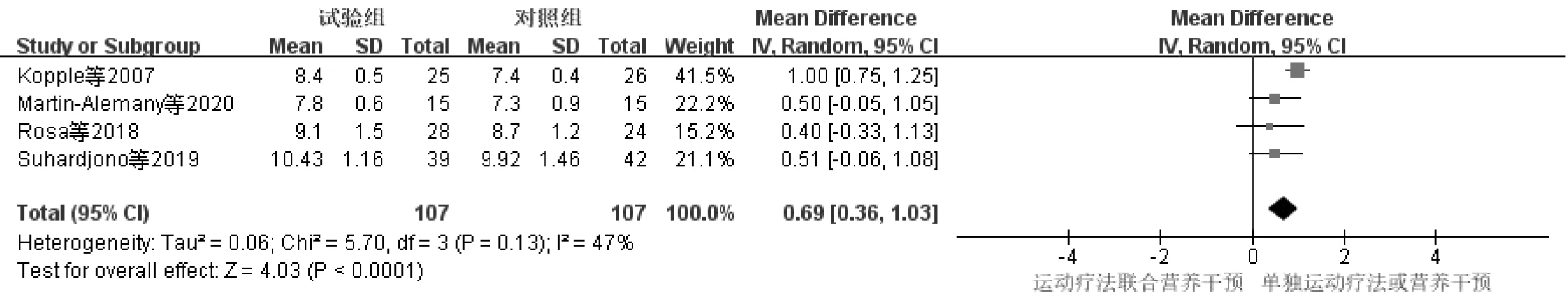
图4 运动疗法联合营养干预对SMI影响的Meta分析森林图
2.4.2.2 LBM
4项研究[10-12,15]报道了HD-SP患者运动疗法联合营养干预前后LBM变化情况,研究对象共216例,与单独运动疗法或营养干预组(对照组)进行比较,运动疗法联合营养干预组(试验组)无明显异质性P=0.14,I2=45%,选用固定效应模型进行分析,见图5。研究结果显示MD=2.53,95%CI(0.45,4.61),P=0.02,差异有统计学意义。
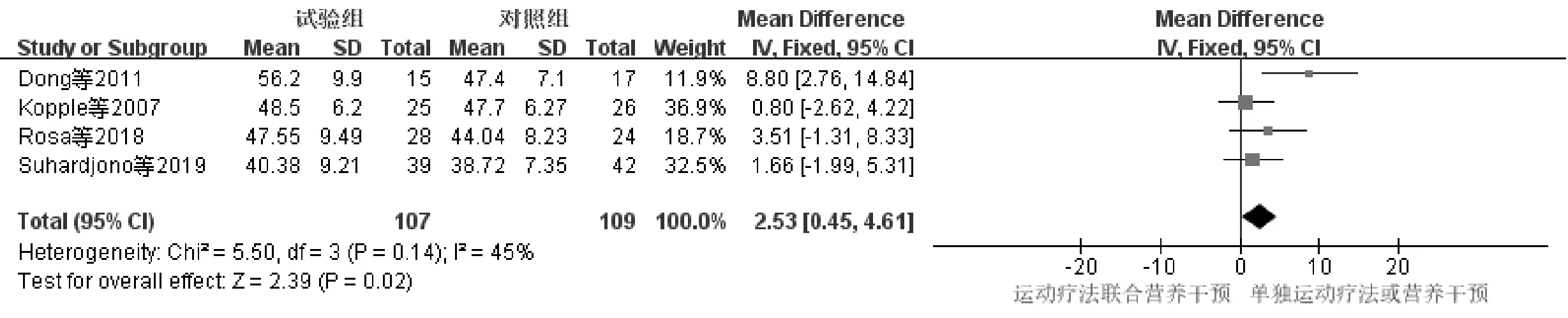
图5 运动疗法联合营养干预对LBM影响的Meta分析森林图
2.4.3身体功能
评价身体功能指标包括GS、6MWT和30 s-STS。
2.4.3.1 GS
2项研究[11,14]报道了HD-SP患者运动疗法联合营养干预前后GS变化情况,研究对象共111例,与单独运动疗法或营养干预组(对照组)进行比较,运动疗法联合营养干预组(试验组)无明显异质性P=0.48,I2=0%,选用固定效应模型进行分析,见图6。结果显示MD=0.11,95%CI(0.01,0.22),P=0.04,差异有统计学意义。

图6 运动疗法联合营养干预对GS影响的Meta分析森林图
2.4.3.2 6MWT
6项研究[8,10,12,14-16]报道了HD-SP患者运动疗法联合营养干预前后6MWT变化情况,研究对象共335例,与单独运动疗法或营养干预组(对照组)进行比较,运动疗法联合营养干预组(试验组)无明显异质性P=0.83,I2=0%,选用固定效应模型进行统计分析,见图7。研究结果显示MD=41.73,95%CI(20.16,62.58),P<0.001,差异有统计学意义。

图7 运动疗法联合营养干预对6MWT影响的Meta分析森林图
2.4.3.3 30 s-STS
3项研究[10,13-14]报道了HD-SP患者运动疗法联合营养干预前后30 s-STS变化情况,研究对象共118例,与单独运动疗法或营养干预组(对照组)相比,运动疗法联合营养干预组(试验组)无明显异质性P=0.94,I2=0%,选用固定效应模型进行分析,见图8。结果显示MD=3.37,95%CI(1.67,5.07),P<0.001,差异有统计学意义。
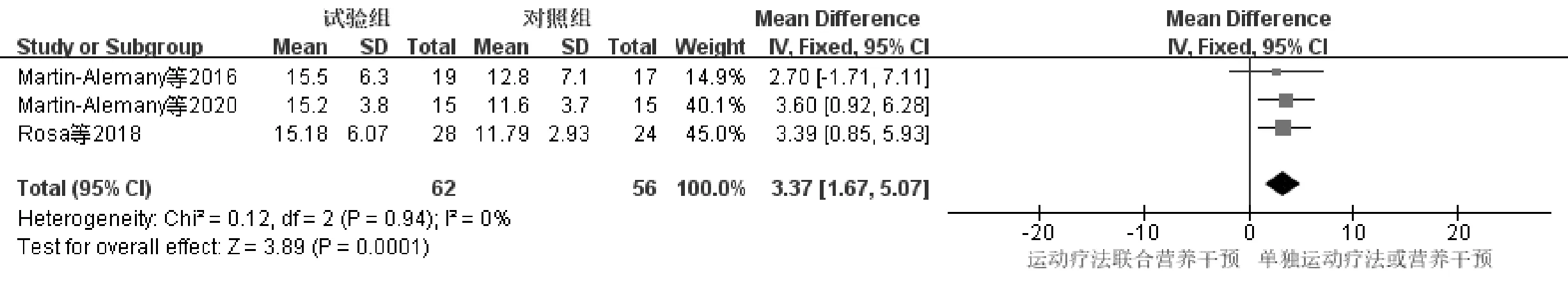
图8 运动疗法联合营养干预对30 s-STS影响的Meta分析森林图
2.5 发表偏倚及敏感性分析
由于纳入文献仅为9篇,不足10篇,故未进行漏斗图分析文献发生的偏倚性。
3 讨论
3.1 运动疗法及营养干预对HD-SP患者肌肉力量的影响
肌肉力量是评价HD-SP患者体能的常用指标,直接影响患者的生活质量和活动能力,主要测量方法包括HGS和LPS。运动疗法及营养干预对HGS的影响:HGS能简单有效的反映患者上肢骨骼肌及力量变化,与神经、肌肉等组织的功能状态呈正相关,可用于评估患者体能康复情况[17]。本研究结果显示,运动疗法联合营养干预相比单独运动疗法或营养干预能更好地提升HD-SP患者HGS情况,可能与以下原因有关,由于高龄、运动缺乏、蛋白质能量消耗等因素,大多数HD-SP患者均存在HGS下降问题,单独运动疗法虽然能提高手臂肌肉收缩频次,促进血液循环,但是在运动后机体新陈代谢速度加快,加速消耗热量和蛋白质,肌纤维增长速度缓慢,若及时补充营养物质,则能有效弥补热量和蛋白质损失,更好地刺激肌肉蛋白质合成,从而改善前臂肌群的肌肉质量,提升HGS[18]。运动疗法及营养干预对LPS的影响:腿部力量是保证HD患者日常生活能力的重要因素,腿部负重的能力越高,患者的独立生活时间越长,生活质量越高[19]。本研究结果显示,运动疗法联合营养干预相比单独运动疗法或营养干预能更好地提升患者LPS,其差异可能与以下原因有关,腿部肌群是人体第一大肌群,通过有效的腿部肌肉运动,能改善HD患者长期久坐不动的不良生活习惯,防止腿部肌肉减少,力量下降,然而,肌肉运动后,腿部营养需求高于其他部位,若未能及时补充,会加速肌肉消耗,抵消了运动疗法的益处,因此运动疗法联合营养干预腿部负重能力优于单独运动疗法或营养干预,能更好地缓解肌肉疲劳,使肌肉增长、肌力增加。
3.2 运动疗法及营养干预对HD-SP患者肌肉质量的影响
研究[20]显示,HD患者由于年龄、炎症、运动缺乏、营养丢失等因素,肌肉质量普遍不高,健康水平下降,常用SMI和LBM测量。本研究结果显示,运动疗法联合营养干预比单独运动疗法或营养干预疗效更佳。可能与以下原因有关:运动能提高人体骨骼肌收缩与舒张频率,使细小肌纤维通过断裂和修复达到增加肌肉的效果;且骨骼肌在运动后修复塑形时间较长,常需要6周~6个月,甚至更长时间,单独的运动疗法虽然可以改变骨骼肌功能和形态,增强肌肉力量,但在运动后若不及时补充营养,会减慢肌肉生长速度;此外,HD患者由于摄入减少及治疗相关因素,营养物质储备不足且消耗较快,也影响了肌纤维生长[21]。因此,HD-SP患者运动后及时营养干预是十分必要的。
3.3 运动疗法及营养干预对HD-SP患者身体功能的影响
身体功能可以较全面准确地反映HD-SP患者体能变化情况,早期识别有助于帮助HD-SP患者制定个性化的运动方案。本研究结果显示,运动疗法联合营养干预相比单独运动疗法或营养干预能更好地提高患者身体功能。可能与以下因素有关:HD患者接受运动疗法后,受到了专业的运动指导,体能活动显著增多,经过一段时间的训练,能有效提高心肺功能,增强活动耐力;同时,长期的运动治疗能提高血液中红细胞和血红蛋白含量,改善血液携氧能力,使肺换气和氧的扩散能力增强,有利于营养物质交换吸收,提高运动能力;此外,运动疗法还能提高新陈代谢,促进乳酸产生并加以利用,延缓由年龄和活动度低造成的如骨质流失、心脏及骨骼肌老化等生理性退化,对改善身体功能,增强力量有重大意义[22]。这提示在未来的临床工作中,应及早发现HD-SP患者,选择恰当的运动模式并鼓励患者坚持,个性化地制定营养干预措施,降低SP发生率。

