血清颗粒蛋白前体在Ⅰ型自身免疫性肝炎预后评估中的价值
任荟蓉 徐婷娟 武 涛 黄 玫 杨 亮
(1.中国科学技术大学附属第一医院检验科,安徽 合肥 230001;2.中国科学技术大学附属第一医院老年病研究所,安徽 合肥 230001;3.中国科学技术大学附属第一医院普外科实验室,安徽 合肥230001;4.中国科学技术大学附属第一医院感染性疾病科,安徽 合肥 230001)
自身免疫性肝炎(autoimmune hepatitis,AIH)是一类以肝脏酶类升高、高免疫球蛋白血症、自身抗体升高和肝脏炎症浸润为特征的慢性自身免疫性疾病[1];依据自身抗体类型可分为Ⅰ型AIH和Ⅱ型AIH。Ⅰ型AIH是最常见的AIH类型,患者抗核抗体(antinuclear antibody,ANA)和/或抗平滑肌抗体(anti-smooth muscle antibody,ASMA)阳性,而Ⅱ型AIH患者抗肝肾微粒体1抗体阳性[2]。AIH起病隐匿,早期症状无临床特异性,但诱发的肝损伤却很严重,晚期需进行肝移植。据报道,约有5.9%的AIH患者在疾病晚期阶段才得以明确诊断,早期诊断对于AIH患者的预后尤为重要[3]。然而,AIH的病因学尚不清楚,这造成了目前缺乏有效的AIH治疗方案和早期诊断标志物。既往研究证实,AIH发病与遗传、环境和免疫反应等因素密切相关,其中免疫平衡紊乱在AIH发病过程中扮演重要角色[4]。抗自身肝脏抗原的免疫反应若得不到适当调控会诱发严重的肝脏损伤。越来越多的研究发现,辅助性T细胞(T helper cell,Th)1/Th2失衡与AIH的发病机制密切相关,Th17/调节性T细胞(regulatory T cell,Treg)及其效应细胞因子白细胞介素(interleukin,IL)17/IL-10平衡紊乱参与了AIH的发生、发展[5]。颗粒蛋白前体(progranulin,PGRN)是新近发现的由免疫细胞广泛表达的新型细胞因子,在炎症反应中起调节作用。有研究发现,PGRN可促进CD4+T细胞向Treg分化,并增强Treg的功能[6]。动物实验结果显示,PGRN缺陷小鼠T细胞和B细胞介导的免疫功能紊乱[7]。系统性红斑狼疮、类风湿性关节炎和干燥综合征等多种自身免疫性疾病患者PGRN水平异常[7]。但关于PGRN在AIH患者中的研究很少。为此,本研究拟探讨Ⅰ型AIH PGRN水平的变化及其与肝脏损伤指标之间的关性。
1 材料和方法
1.1 研究对象
选取2016年5月—2021年4月中国科学技术大学附属第一医院确诊为Ⅰ型AIH的患者39例(AIH组),其中男26例、女13例,年龄(49.71±13.21)岁;ANA和ASMA均阳性6例,ANA单阳性28例,ASMA单阳性5例。所有患者均处于疾病活动期[丙氨酸氨基转移酶(alanine aminotransferase,ALT)或天门冬氨酸氨基转移酶(aspartate aminotransferase,AST)>50 U/mL];有25例患者在急性发作时单独使用泼尼松龙治疗,中位剂量为100 mg;其他14患者采用泼尼松龙和硫唑嘌呤联合治疗,中位剂量均为100 mg。AIH诊断参照1999年国际自身免疫性肝炎小组(the International Autoimmune Hepatitis Group,IAIHG)制定的AIH诊断和临床评分标准[8],排除其他自身免疫性疾病、结缔组织病、慢性炎症性疾病、酒精性肝病、药物性肝病、病毒性肝炎和遗传代谢性肝病,排除近6个月内接受过免疫抑制剂或糖皮质激素治疗的患者。另选取同期中国科学技术大学附属第一医院健康体检者35名(正常对照组),其中男24名、女11名,年龄(48.93±11.47)岁,均无慢性炎症病史。2个组之间年龄和性别差异均无统计学意义(P>0.05)。本研究经中国科学技术大学附属第一医院伦理委员会批准(2020 KY伦审第124号),所有研究对象均签署知情同意书。
1.2 方法
1.2.1 样本采集和处理
采集Ⅰ型AIH患者治疗前、健康体检者体检当日清晨的空腹静脉血10 mL,其中2 mL置于乙二胺四乙酸抗凝管中,用于白细胞(white blood cell,WBC)计数;另8 mL置于干燥管中,离心分离血清,-80 ℃保存备用,用于检测血清肝脏酶类、自身抗体和PGRN、IL-10、IL-17水平。
1.2.2 各项指标的检测
采用酶联免疫吸附试验检测血清PGRN、IL-10和IL-17水平,试剂盒均购自美国R&D公司,检测仪器为ST-360酶标仪(上海科华公司)。采用BC-6900全自动血液分析仪(深圳迈瑞公司)及配套试剂检测WBC。采用ADVIA 2400全自动生化分析仪(德国西门子公司)及配套试剂检测ALT、AST、γ-谷氨酰基转移酶(gamma-glutamyltransferase,GGT)、碱性磷酸酶(alkaline phosphatase,ALP)、总胆红素(total bilirubin,TB)、直接胆红素(direct bilirubin,DBil)、IgG、IgM和IgA水平。采用Sprinter XL全自动荧光免疫分析仪(德国欧蒙公司)及配套试剂检测ANA和ASMA。严格按仪器和试剂盒说明书进行操作。
1.2.3 Ⅰ型AIH患者治疗前后各项指标的变化
追踪随访12例Ⅰ型AIH患者治疗后8周各项指标的变化。将血清ALT升高至参考区间上限的2倍以上(ALT>90 U/L)定义为AIH复发。
1.3 统计学方法
采用SPSS19.0软件进行统计分析。呈正态分布的计量资料以±s表示,2个组之间比较采用独立样本t检验。计数资料以例或率表示,组间比较采用χ2检验。采用Spearman相关分析评估各项指标之间的相关性。采用受试者工作特征(receiver operating characteristic,ROC)曲线评价血清PGRN判断Ⅰ型AIH复发的效能。以P<0.05为差异有统计学意义。
2 结果
2.1 AIH组和正常对照组一般资料比较
AIH组WBC计数、ALT、AST、GGT、ALP、TB、DBil、IgG、IgM、IgA水平和ANA、ASMA阳性率均显著高于正常对照组(P<0.05)。见表1。
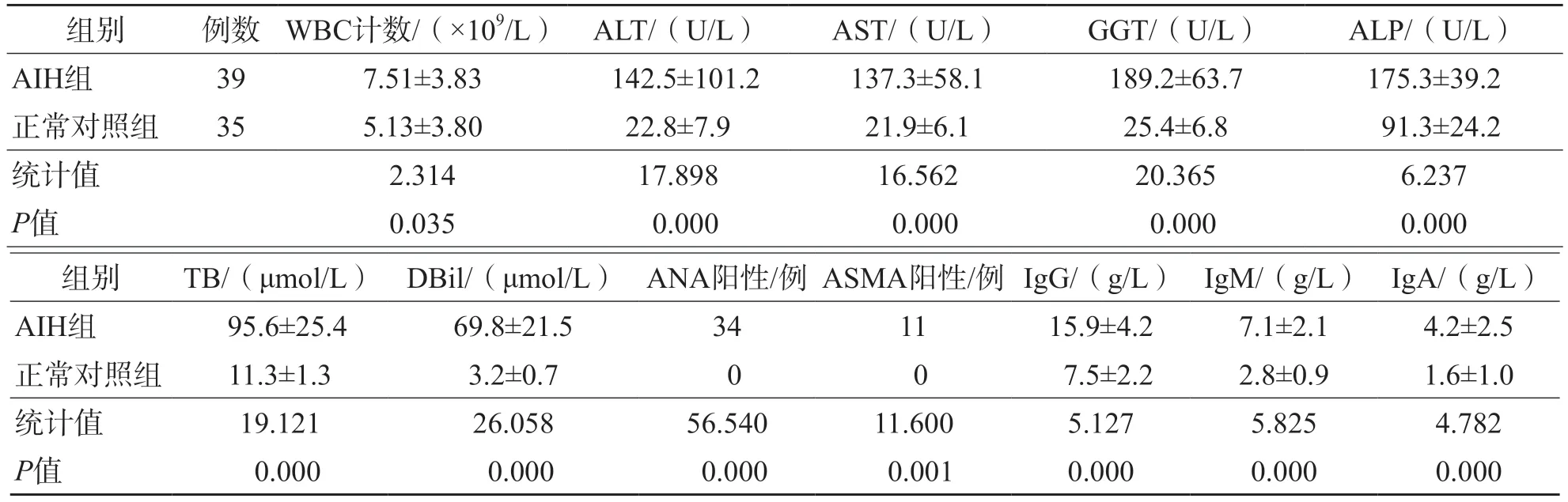
表1 AIH组和正常对照组的一般资料比较
2.2 AIH组和正常对照组血清PGRN、IL-10、IL-17水平比较
AIH组血清PGRN、IL-17水平显著高于正常对照组(P<0.05),血清IL-10水平显著低于正常对照组(P<0.05)。见表2。
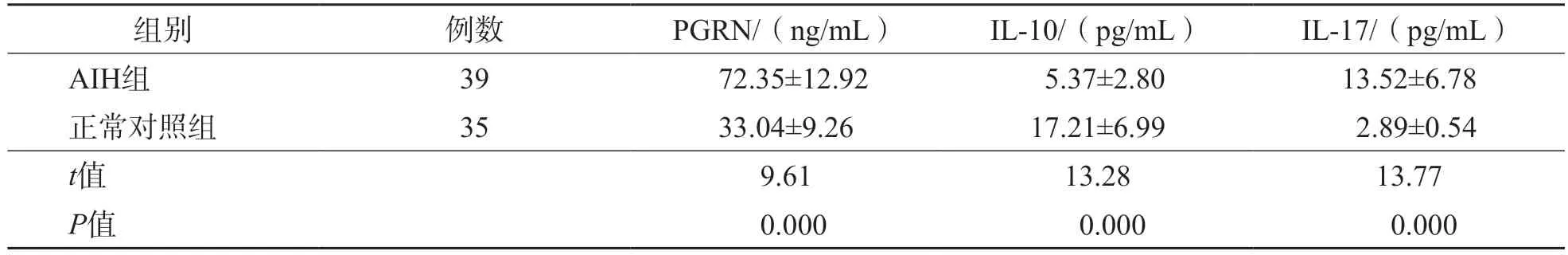
表2 AIH组和正常对照组血清PGRN、IL-10和IL-17水平比较
2.3 Ⅰ型AIH患者PGRN与其他指标的相关性
Ⅰ型AIH患者PGRN与IL-17、GGT、IgG和IgM均呈正相关性(r值分别为0.410、0.489、0.596、0.525,P<0.05);与IL-10、WBC计数、ALT、AST、ALP、TB、DBil和IgA均无相关性(r值分别为-0.297、0.152、0.208、0.211、0.293、0.157、0.134、0.284,P>0.05)。
2.4 Ⅰ型AIH患者治疗前后血清PGRN水平变化
随访的12例Ⅰ型AIH患者治疗后血清PGRN、ALT、AST、GGT、ALP、IgG、IgM和IgA水平均显著低于治疗前(P<0.01),见表3、图1。有1例患者治疗后PGRN水平高于治疗前,追踪发现该例患者为复发患者。
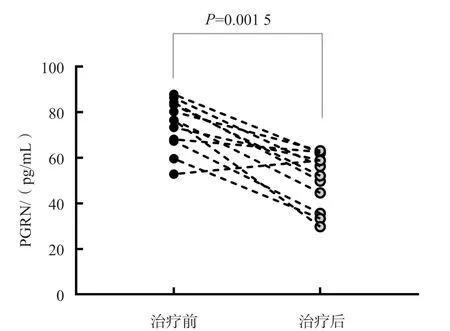
图1 Ⅰ型AIH患者治疗前后血清PGRN水平的变化
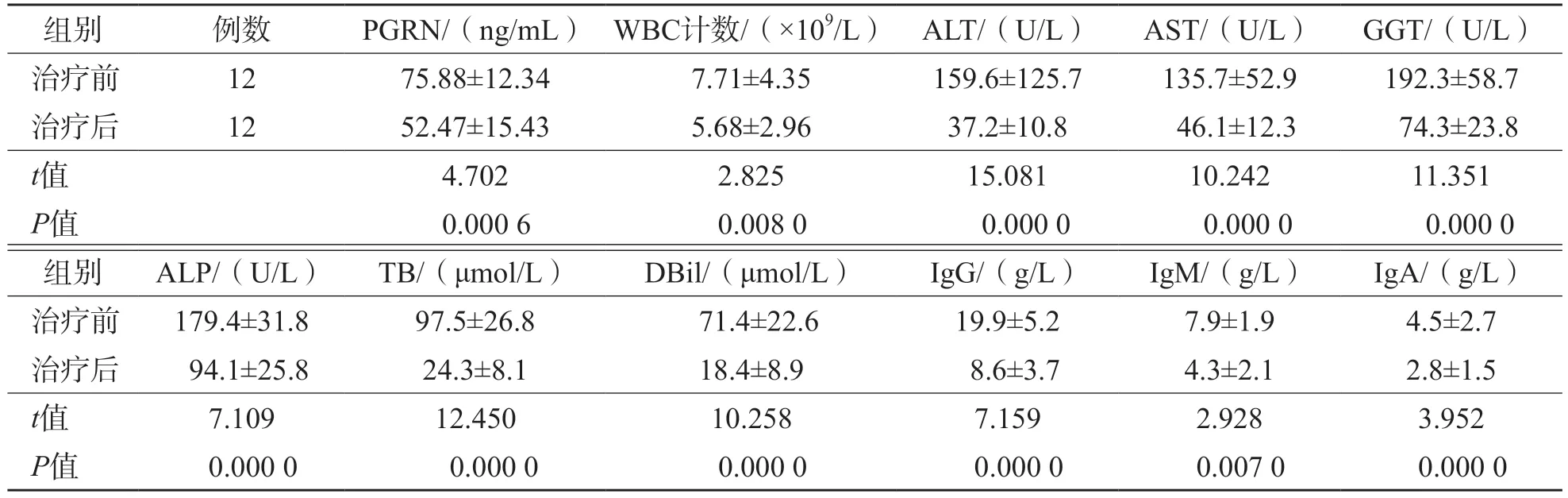
表3 治疗前后AIH患者常规指标检测结果比较
2.5 Ⅰ型AIH患者血清PGRN水平与复发的关系
39例Ⅰ型AIH患者中有8例出现复发(复发组),其中3例在免疫抑制治疗停止后复发、5例在免疫抑制治疗期间复发;其余31例患者未复发(未复发组)。复发组治疗前血清PGRN水平显著高于未复发组(P<0.05),见图2。
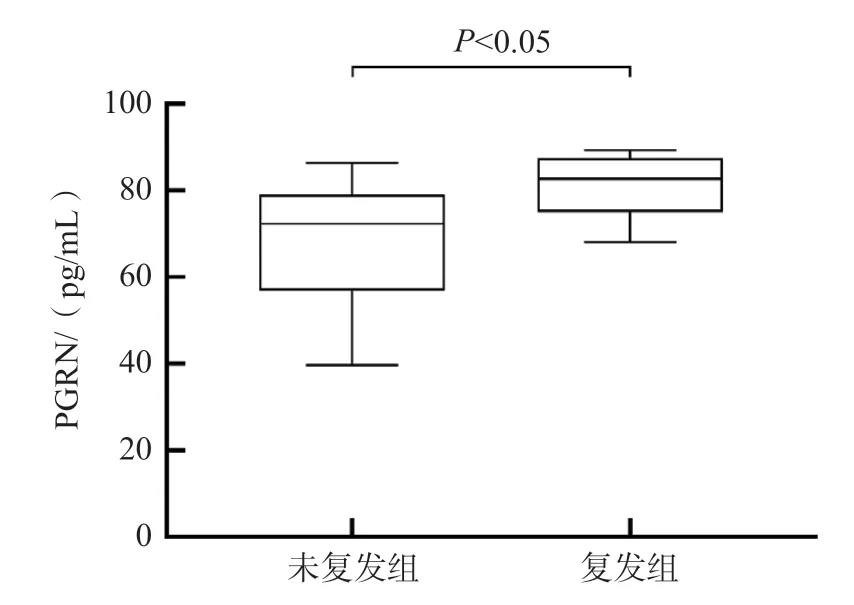
图2 复发组和未复发组血清PGRN水平的比较
ROC曲线分析结果显示,血清PGRN判断Ⅰ型AIH复发的曲线下面积(area under curve,AUC)为0.78,最佳临界值为80.75 pg/mL,敏感性为62.50%,特异性为83.33%。见图3。
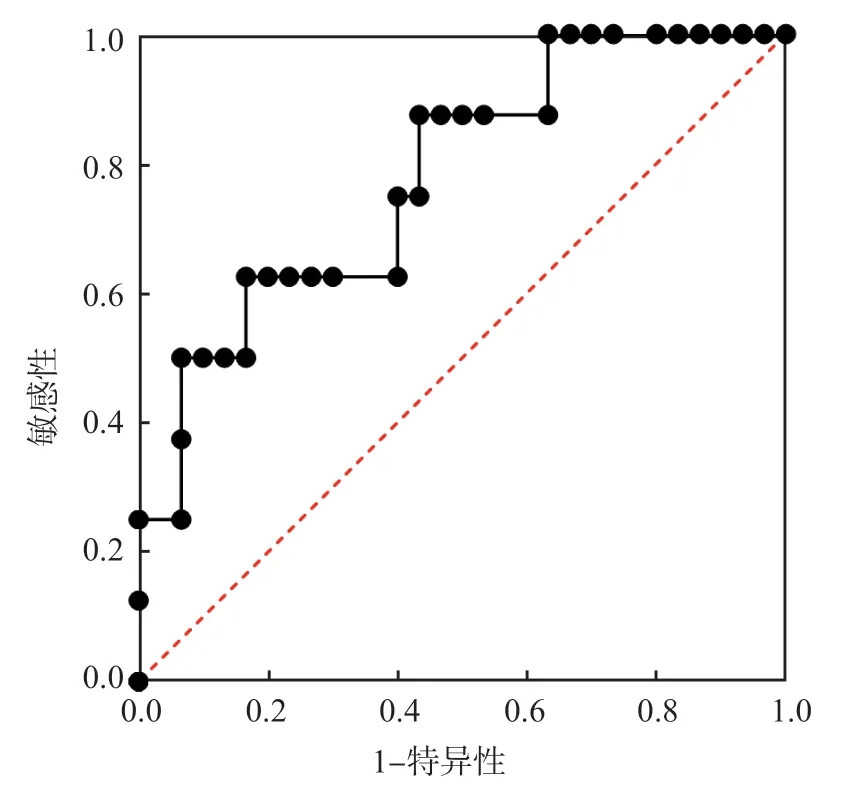
图3 血清PGRN判断Ⅰ型AIH复发的ROC曲线
3 讨论
PGRN最初被鉴定为促进上皮细胞增殖和创伤愈合的生长因子,由7.5个半胱氨酸基序按P-G-F-B-A-C-D-E顺序组成,主要表达于上皮细胞、免疫细胞、神经细胞和软骨细胞中[9]。此外,PGRN也被发现在多种肿瘤中高表达,可能参与了早期胚胎发育、细胞增殖分化、抵抗宿主感染和炎症反应等多种病理生理过程[10-11]。PGRN还可与肿瘤坏死因子受体结合,在机体免疫平衡调控中扮演重要角色[12]。WANG等[13]的研究结果显示,椎间盘退行性变患者PGRN水平异常升高,通过调控炎症作用轴IL-17/IL-10发挥保护作用,其主要的生物学效应为抑制促炎细胞因子IL-17的生成,促进抑炎细胞因子IL-10的分泌。LI等[14]发现,柯萨奇病毒B3感染患者PGRN水平升高,抑制了Th17的分化,使IL-17分泌减少。在结肠炎模型中,PGRN可诱导Treg分化和IL-10分泌,发挥保护作用[15]。由此可见,PGRN可能是通过调控IL-17/IL-10平衡来参与炎症性疾病的发生、发展。
IL-17/IL-10失衡目前已被证实与AIH密切相关。LIANG等[5]的研究结果显示,活动期AIH患者IL-17水平显著升高,IL-10水平显著降低,与本研究结果一致。但在AIH患者中,IL-17/IL-10失衡的调控机制是否与PGRN相关并不清楚。本研究结果显示,活动期Ⅰ型AIH患者血清PGRN水平显著高于正常对照者(P=0.000),这与在皮肌炎[16]、炎症性肠病[17]、类风湿性关节炎[18]和骨关节炎[19]中的变化一致。在这几类疾病中,PGRN均被证实通过抑制炎症反应来发挥保护作用,其高表达可能是机体的代偿效应,但这种代偿效应并不足以控制机体炎症。另外,有研究发现,在糖尿病患者中,虽然PGRN同样上调,但体外试验和动物模型均证实PGRN可通过上调炎症因子IL-6、内质网应激和细胞自噬途径诱导胰岛素耐受,导致糖耐量受损[20]。TANAKA等[21]也发现,系统性红斑狼疮患者PGRN水平显著升高,且与IL-6呈正相关(rs=0.47,P<0.000 1);细胞实验结果表明,PGRN可促进IL-6的分泌,参与了系统性红斑狼疮的致病机制。AIH患者中高表达的PGRN是发挥保护作用还是促进炎症作用,有待于进一步在动物模型中通过过表达和基因敲除实验加以证实。本研究还发现,PGRN与IL-17、GGT、IgG和IgM均呈正相关(r=0.410、0.489、0.596、0.525,P<0.05),与IL-10无相关性(r=-0.297,P>0.05),提示PGRN或可作为反映Ⅰ型AIH患者炎症程度和肝脏损伤程度的指标之一。
本研究结果显示,Ⅰ型AIH复发患者血清PGRN水平显著高于未复发患者(P<0.05);ROC曲线分析结果显示,血清PGRN判断Ⅰ型AIH患者复发的最佳临界值为80.75 pg/mL,敏感性为62.50%,特异性为83.33%。与持续缓解的AIH患者相比,复发患者更易发展成肝硬化,出现食道静脉曲张,并因肝功能衰竭致死[22-23]。本研究发现,有1例Ⅰ型AIH患者治疗后血清PGRN水平高于治疗前,追踪发现该例患者为复发患者;另有2例AIH患者血清PGRN水平下降不明显,推测可能与患者对免疫治疗方案敏感性较低有关。由此可见,血清PGRN水平可能有助于判断AIH的复发情况。
值得注意的是,目前用于检测PGRN的酶联免疫吸附试验试剂盒并不能区分全长PGRN和颗粒蛋白片段。与全长PGRN不同的是,颗粒蛋白片段是发挥促炎效应的[24]。因此,在某些疾病中,PGRN可能被加工成为颗粒蛋白片段,导致不同疾病之间的研究结论出现差异。此外,PGRN在不同疾病中发挥的作用可能也有一定的差异。因此,后续我们将进一步扩大样本量,从mRNA和蛋白水平检测PGRN表达的变化,并通过动物模型探讨PGRN在AIH中的可能作用机制。
综上所述,Ⅰ型AIH患者血清PGRN水平升高,且与AIH的疗效和复发有关,或可作为评价肝脏炎症反应程度、损伤程度和疾病复发的指标。

