南极磷虾中各赋存形态氟在大鼠肝的蓄积及对肝损伤研究
李佳欢,谢昌健,康瑞宁,张 旺,王彦波,杨 青,朱兰兰
(1. 山东理工大学,山东 淄博 255000;2. 荣成泰祥食品有限公司,山东 威海 264309)
南极磷虾(Euphausia superba),是生活于南冰洋水域的一类小型甲壳类浮游动物。南极磷虾蛋白质含量占60%~65%(以干样计),富含虾青素、微量元素等多种营养物质,还含有丰富的维生素、甲壳素和各类消化酶[1-2],且南极磷虾储量巨大,因此,南极磷虾在生物医药等领域具有广阔的应用前景。
南极磷虾中虽然含有丰富的蛋白质和多种微量矿质元素,Soevik L 等人[3]研究表明南极磷虾中氟的含量很高,整虾氟含量可达2 400 mg/kg(干重计),且主要分布于甲壳中,在捕捞贮运加工过程中会从甲壳不可逆迁移到肌肉组织中[3-4],高于普通食品数百倍。氟是一种具有双阈值性质的微量元素,其化学性质活泼,易在体内发生变化,使体内存在复杂的氟形态,不同形态的氟对迁移路径[5]、毒性[6-8]等均有影响。南极磷虾中氟的赋存形态经历了较长的发展过程,很多研究人员对南极磷虾中氟的赋存形态和其含量进行了进一步的探索[4,9-11],所以南极磷虾无论是被当作动物饲料还是作为人类的食物,其所含氟的生物毒性和其在动物、人体中的蓄积规律都是不可忽视的问题。
南极磷虾的高氟含量不仅限制了它的加工和安全食用,也是南极磷虾产业发展的一个枷锁,探索南极磷虾中氟的蓄积相关研究已经成为国内外学者关注的焦点。
有关南极磷虾中氟的存在形态有研究人员按样品的不同处理方法对氟的形态进行划分,也有人直接采取土壤中氟的分类方法应用于南极磷虾中氟的形态分类,南极磷虾中氟主要分布于甲壳中,氟进入到南极磷虾体内后取代壳中羟基磷灰石中的羟基,与其结合形成更稳定的氟磷灰石,从而硬化虾壳,给磷虾提供更加强大的保护作用[12]。Peng Y 等人[13]对南极磷虾外壳无机盐中氟化物的组成及含量进行分析,发现南极磷虾外壳灰的主相是磷灰石、甲壳素和蛋白质共存。由于无法对南极磷虾各形态氟在分子层面进行直接分析,所以最初有研究者间接参考土壤和煤中不同形态氟的粗略分类,根据化学性质简单地利用氟在水及酸、碱溶液中的浸提性质将其分类[14-15]。这些分类方法对研究氟的生物利用度有意义,然而还无法准确地划分氟与其他物质的结合机制,而且一些氟成分在不同的溶剂中可以被浸出,因此在食品分析和安全评估领域的应用相当有限。此后,根据其他微量元素的分级特性,研究人员将土壤中的氟分为水溶性氟、可交换氟、铁锰结合氟、有机结合氟和残余氟[5,16]。这种方法细化了氟分离的难易程度,也考虑到了氟与不同成分的结合机制。如果结合食品和土壤的物质和元素组成的差异,适当地改进这种分类方法,可以更好地应用于食品中氟元素的分析。潘建明等人[9]将南极磷虾中的氟分为有机态和非有机态,并发现甲壳中有机氟含量相当高(90%),而且随着时间和酶的作用会将有机氟转化为无机氟,但没有对氟的赋存形态进行具体研究。赵晓君等人[10]利用国际纯粹与应用化学联合会(IUPAC)[17]对化学形态分析定义结合超声逐级提取法,对南极磷虾粉中氟的赋存形态及其含量进行分析研究,结果表明,南极磷虾粉中氟的赋存形态可分为水溶态氟、可交换态氟、氧化态氟、有机束缚态氟和残渣态氟,其含量分别占总氟的15.7%,17.1%,31.7%,21.5%,14.0%。南极磷虾无论是被当作动物饲料还是作为人的食物,其所含氟的急慢性毒性和蓄积规律都是不可忽视的问题。关于急慢毒性方面,侯钟令[18]用南极磷虾粉喂养成年小白鼠14 d,以自来水灌胃为对照,对南极磷虾粉的急性毒性进行评价,最后得到南极磷虾粉经口半数致死量LD50>20 g/kg BW,表明急性毒性为“实际无毒”。赵守涣等人[19]研究了煮南极磷虾和南极磷虾粉的急性毒性,结果显示,小鼠对2 种南极磷虾材料的耐受量分别大于599.04 g/kg BW和62.71 g/kg BW,煮虾中高氟含量可能对肝脏有损伤。张玲等人[20]用含有南极磷虾粉的饲料喂养大鼠3 个月,观察南极磷虾中氟对软组织的影响,结果表明,南极磷虾粉饲养的大鼠肝脏、肾脏、脾脏、脑组织表现出少量病变,但毒性低于氟化钠。Ouyang Z 等人[21]分别用饲料和氟化钠(750 mg/kg) 喂养鸭子28 d。结果表明,氟化钠会对鸭的肝组织产生有害影响。侯钟令[18]对大鼠进行28 d慢性毒性试验,结果表明,南极磷虾粉中的氟没有影响大鼠的脂质代谢,但引起大鼠的氧化应激反应,进而导致了肝和肾的严重损伤。据此,磷虾中氟摄入不会引发急性毒性症状,但是长期摄入则可对受试动物产生肝、肾损伤和硬组织中蓄积等慢性毒性作用。目前对于南极磷虾中氟的慢性损伤的报道较少,但氟化钠导致机体组织慢性损伤的机制研究较多,包括氟化钠引起的氧化应激,氧化应激可以导致肝[22]、肾脏[23]、生殖系统[24]和肺 部[25-26]等功能衰退和结构损伤[27],后续可以根据氟化钠对机体的损伤作用机制开展南极磷虾中不同形态的氟对机体及各器官的损伤机制研究。关于南极磷虾中氟的蓄积问题也受到了研究者的关注,南极磷虾作为饲料对各类生物的影响不完全相同,但大多表现为骨骼上的蓄积对软组织损伤不显著。有研究发现,以南极磷虾为主要食物的鱼类的骨骼氟含量为400~1 200 mg/kg、鸟类和哺乳类骨骼中氟含量为5 700~7 350 mg/kg,证实被消化吸收的氟都蓄积在骨骼中,并未导致骨骼氟中毒,分析可能是由于南极磷虾中的氟在鱼类、鸟类以及一些哺乳类动物体内以低毒形式存在[28]。Moren M 等人[29]通过喂养大西洋鲑鱼、大西洋鳕鱼、虹鳟鱼和大西洋比目鱼含磷虾或两栖动物膳食和含氟化钠(NaF) 的鱼粉膳食的氟积累情况,无论用磷虾或两足动物粉代替的鱼粉的数量如何,都没有观察到负面的健康或生长影响。Karlsen O 等人[30]将南极磷虾粉以0,22%,63%,100%的比例代替饲料连续喂养大西洋鳕鱼9 周后,与野生对照组相比,在肌肉中没发现明显的氟蓄积现。Yoshitomi B 等人[31]通过添加0,15.4%,100.0%的低氟磷虾粉的饲料和以相同比例鱼粉喂养海鱼。发现各试验组中均未见软组织上的改变。但通过提取外骨骼发现氟在海鱼脊椎中积累,并对其生长有抑制作用。高氟含量影响南极磷虾开发应用,但目前关于南极磷虾中氟的蓄积及毒性研究还集中于总氟,对南极磷虾中各型态氟的蓄积研究较少。因此,找到南极磷虾各型态氟蓄积规律尤为重要。通过提取南极磷虾中各型态氟,进行28 d 动物试验,测定肝脏样品各型态氟的富集规律;另取肝脏样品进行组织病理学研究,观察各型态氟对其结构和病变特征,以便进一步研究南极磷虾各形态在肝脏中的蓄积原理和对肝脏损伤的机制提供了参考。
1 材料与方法
1.1 试验动物与材料
健康SD 大鼠70 只,雌雄各占50%,统一体重200±20 g。(应当是雄鼠6 周龄,雌鼠8 周龄。) 由北京华阜康生物科技有限公司提供,质量合格证号:SCXK(京) 2014-0004。受试动物在进行动物试验前适应环境1 周,期间自由采食和饮水,用于南极磷虾中氟在大鼠体内的蓄积规律研究。南极磷虾粉,购自辽宁大连海洋渔业集团,于实验室干燥冷冻贮存。
1.2 氟离子选择电极法测定氟含量
根据《GB/T 5009.18—2003 食品中氟的测定》(2013)[32]中第三法“氟离子选择电极法”对样品中氟含量进行测定,并依据实验室实际条件对相关操作进行合理调整。
1.2.1 缓冲液的配置
称取204 g 三水合乙酸钠,溶解于去离子水中,定容至500 mL,得到3 mol/L 的乙酸钠溶液,贮存于试剂瓶中,备用。称取110 g 二水合柠檬酸钠三钠,溶解于去离子水中,加14 mL 高氯酸,定容至500 mL,得到0.75 mol/L的柠檬酸钠溶液,贮存于试剂瓶中备用。上述3 mol/L乙酸钠溶液和0.75 mol/L柠檬酸钠溶液等体积混合,制得总离子强度缓冲液(ISA),现配现用。
1.2.2 标准贮存液的配置
移液器吸取0.1 mol/L氟离子标准液5 mL,定容至500 mL,得到1.9 mg/L 氟离子标准液贮存液,储存于试剂瓶中备用。
1.2.3 氟离子提取剂的配置
浓盐酸和去离子水按照1∶11 的比例混合均匀,现用现配。
1.2.4 标准曲线的配置
分别取氟离子标准贮存液10,50,500,2 500,5 000 μL 于50 mL 容量瓶中,加入25 mL 总离子强度缓冲液,10 mL 盐酸溶液,使用去离子水定容至50 mL,备用;得到0.038,0.190,1.900,9.500,19.000 mg/L 的氟离子系列梯度质量浓度溶液。
pH 值计切换至mV 模式,连接氟离子选择电极,用去离子水反复冲洗电极头部至pH 值计读数显示250 mV 以上,此后每次测定前均冲洗电极至空白电位250 mV 以上。
使用氟离子选择电极从低到高分别测定上述的梯度浓度氟离子溶液,记录电位值,并做氟离子浓度的常用对数-电位(lg C-mV) 的线性回归方程,即得到氟离子浓度标准曲线。要求标准曲线斜率在-59.15±5 以内,R2>0.999 5。
1.2.5 样品测定
固体样品:准确称取适量(1 g 左右,精确到4 位小数) 样品,使用盐酸溶液10 mL 浸提1 h 以上,期间不断振荡,浸提完成后加入25 mL 总离子强度缓冲液,使用去离子水定容至50 mL,测定电位值,代入标准曲线方程,按照以下公式计算浓度:
式中:X——样品中氟含量,mg/kg;
A——测定液中氟质量浓度,mg/L;
V——测定液总体积,此处为50 mL;
M——样品质量,g。
液体样品:准确量取5.000 0 mL 样品,加入盐酸溶液和总离子强度缓冲液,按照上述方法计算浓度。
1.3 各形态氟虾粉制备
参照赵晓君等人[10]的逐级化学- 超声波提取方法,依据实验室条件对相关方法做出合理调整。取南极磷虾粉加入浸提液,料液比为1∶10,参照图1中步骤进行逐级提取,每一步浸提完成后,于4 ℃下以转速8 000 r/min 离心8 min,保留上清液,经处理后用作动物试验饲喂的含各形态氟的南极磷虾粉,沉淀物进行进一步浸提。采用1.2 中氟测定方法测得各形态氟。

图1 不同形态氟的南极磷虾粉
不同形态氟的南极磷虾粉见图1。
1.4 南极磷虾各形态氟在大鼠肝脏内蓄积情况
参照经济合作与发展组织化学品测试指南[33]第4 节中的407 号试验:在啮齿类动物中进行为期28 d的重复给药口服毒性研究,设计了以下方案:所有老鼠连续饲喂28 d,按照饲喂饲料不同将雌雄鼠各随机分为7 组,每组5 只:水溶态氟虾粉、可交换态氟虾粉、氧化态氟虾粉、有机结合态氟虾粉、残渣态氟组、空白对照组(不添加虾粉)、阳性对照组(氟化钠)。使用1.3 中制备的各形态氟南极磷虾粉饲喂,每日1 次灌胃,高剂量南极磷虾粉组的氟给予量则通过向饮用水中添加100 mg/L 氟化钠来达到。
动物分组情况见表1。

表1 动物分组情况
正常光照下连续喂养28 d,观察并记录动物在试验过程中的活动状态、饮食、粪便和死亡状况。饲喂结束后,用3%的戊巴比妥钠腹腔注射麻醉,然后处死存活动物,剖解,取肝器官组织。采集的器官取1 份,使用1.3 中的方法测定氟含量。另取1 份固定于10%福尔马林溶液中,作为后续做组织病理学切片的样品。
1.5 肝脏组织病理学切片
根据文献[18]报道的南极磷虾中氟有蓄积与肝脏中的趋势,选择受试雌雄鼠肝脏做病理学切片,观察不同形态氟对肝脏的病理学变化,详细过程如下:组织的固定及清洗:使用4%多聚甲醛(PFA) 固定组织,把固定好的组织块切成0.5×0.09 cm3的块,用自来水流水冲洗,再用10%福尔马林溶液固定的肝脏样品10 h 以上,以便能更充分地洗去福尔马林溶液和甲醛。
(1)脱水及透明。将组织块,用不同体积分数的乙醇进行脱水,75%乙醇脱水1 h,80%乙醇脱水1~2 h,90%乙醇脱水1 h,95%乙醇脱水0.5 h,100%乙醇5~30 min,再用50%乙醇+ 50%二甲苯透明30 min。
(2) 浸蜡。先用软蜡1 h 后再用软蜡2 h最后用硬蜡2 h。目的在于把组织中的二甲苯除去。
(3) 组织包埋。首先准备好模具,将组织切面朝下放在模具底部,然后将包埋盒盖在模具上,将融化的蜡倒入模具中,直到蜡从模具中溢出,然后小心地提起模具,将其平放在冷冻台上,让其迅速冷却凝固,约10 min 后取出。
(4) 切片。首先,要对蜡块进行修补,通常修补成梯形,刀具与蜡块的倾斜角度为20~30 °,切片的厚度为4~6 μm。
(5) 展片。切片被分割并置于48 ℃的温水浴中。这时,由于表面张力的作用,切片漂浮在水面上并自然展平,使用粘附的载玻片以一定的角度插入水面,将切片带出,使切片附着在玻片的适当位置,在50 ℃下烤片30 min 以上。
(6) 染色。在苏木精-伊红(HE) 中染色2 min。
(7) 封片。在每张载玻片上的组织上滴上一滴树脂,然后盖一张盖玻片,在烘箱中烘干。
(8) 显微镜观察。在光镜下检查干燥的切片,选择组织结构完整、染色均匀、分辨率高的切片,放在显微镜下观察、拍照和分析。
1.6 统计分析
试验数据统计采用Graph Pad prism 9.0 统计软件,组间比较采用单因素方差分析,数据用平均值±标准误表示,p<0.05 为差异显著,p<0.01 为差异极显著。
2 结果与分析
2.1 各组饲料样品氟含量
用氟离子选择电极法测得的各组饲料样品中各形态氟含量。
各组饲料氟含量见表2。

表2 各组饲料氟含量
2.2 南极磷虾各形态氟在大鼠肝脏内蓄积情况
大鼠在喂养28 d 后,用5%的水合氯醛麻醉,采肝组织,使用氟离子选择电极法测得的各组雌雄鼠肝脏各形态氟含量。
不同形态氟在雌雄大鼠肝脏蓄积情况见图2。
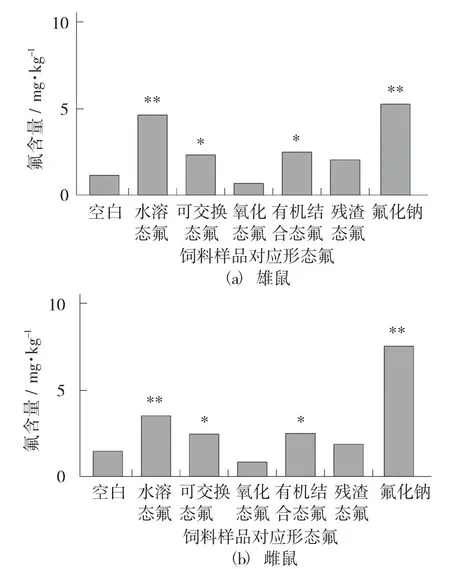
图2 不同形态氟在雌雄大鼠肝脏蓄积情况
由图2 可知,在肝脏中无论雄鼠还是雌鼠,与空白组各形态氟均有不同程度的蓄积,其中极显著的为氟化钠组和水溶态氟,显著的为可交换态氟和有机结合态氟。
2.3 肝脏组织病理学切片
动物试验结束后,立即处死试验动物,解剖各组动物并把各组肝组织固定;另取一份肝脏做组织病理学切片,采用石蜡进行包埋,并用苏木精-伊红染液进行染色处理,然后放置于显微镜下进行观察分析。
不同形态氟对雄鼠肝脏组织病理学变化见图3。

图3 不同形态氟对雄鼠肝脏组织病理学变化
由图3 可知,空白对照组、肝细胞围绕中央静脉规则排列,呈圆形,细胞边界清晰。南极磷虾中各形态氟对雄大鼠肝脏都有不同程度的损伤,其中水溶态氟组大鼠与空白组相比肝小叶和肝窦扩张(○),肝细胞空泡变性,内容物溢出(粗箭头),中央静脉扩张(细箭头);可交换态氟组大鼠出现肝细胞空泡变性以及内容物溢出;氧化态氟组出现少许肝细胞肿大,以及细胞空泡变性;有机结合态氟组中央静脉扩张,周围环绕深蓝色红细胞(□);残渣态氟组出现中央静脉扩张,少许肝细胞肿大;氟化钠组出现中央静脉扩张,周围环绕深蓝色红细胞(□),肝细胞肿大,空泡变性等。
不同形态氟对雌鼠肝脏组织病理学变化见图4。
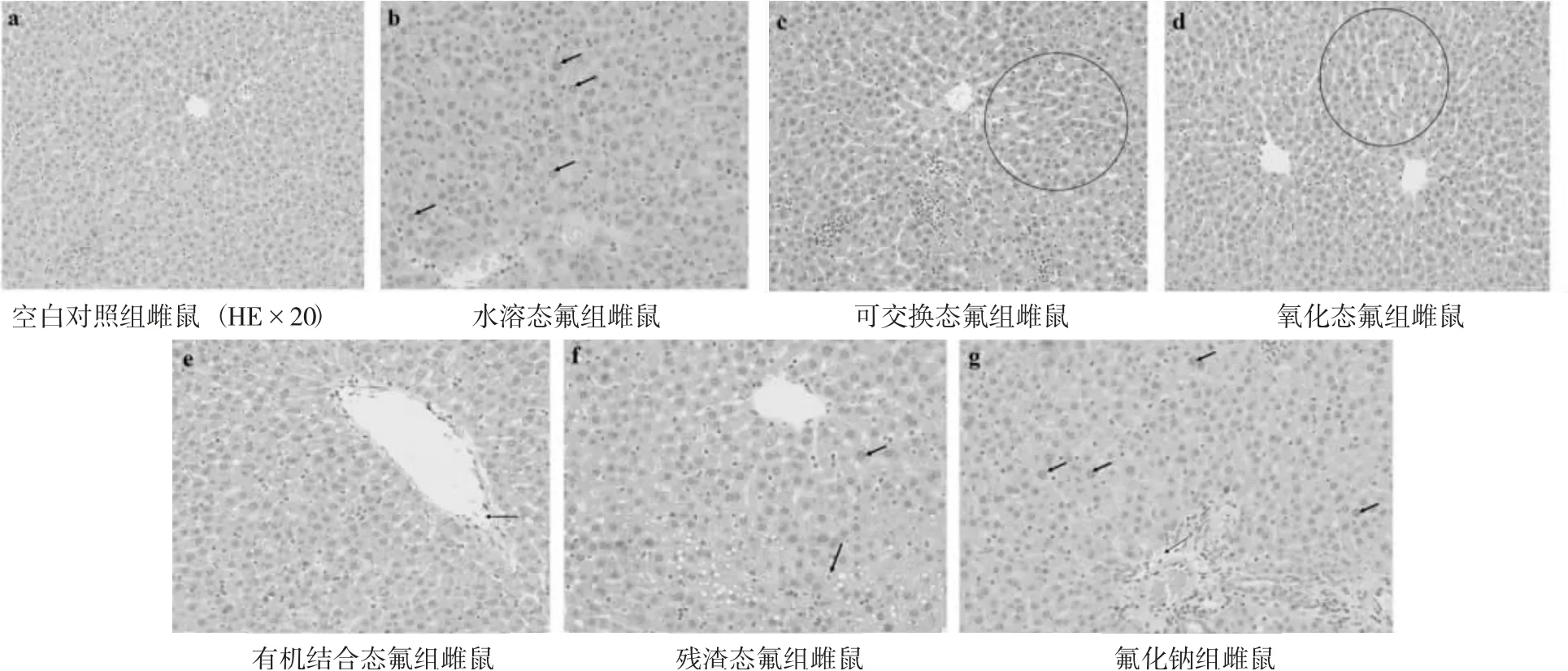
图4 不同形态氟对雌鼠肝脏组织病理学变化
由图4 可知,不同形态氟对肝损伤与雄鼠损伤相似,包括肝小叶和肝窦扩张(○),肝细胞空泡变性,内容物溢出(粗箭头),中央静脉扩张(细箭头),周围环绕深蓝色红细胞等。
3 讨论
经过从南极磷虾中提取各种形态氟喂养大鼠28 d后,雌雄大鼠肝脏中水溶态氟蓄积含量仅次于氟化钠,同时观察肝组织病理切片发现其对雌雄大鼠肝脏有不同程度的损伤。有研究表明,谷胱甘肽以还原型谷胱甘肽(GSH) 和氧化型谷胱甘肽(GSSG) 2 种形式存在于体内,还原型谷胱甘(GSH) 肽是其活性成分,能参与体内的氧化还原过程。在谷胱甘肽转移酶作用下,还原型谷胱甘肽能与过氧化物和自由基结合,来抗衡氧化剂对巯基的破坏,保护细胞膜中的含巯基的蛋白质和含巯基的酶被损害,还可对抗自由基对重要器官的损伤,肝脏主要是通过还原型谷胱甘肽系统抵挡氧化应激带来的损害[34],水溶态氟有明显的积存现象,说明水溶态氟有可能会损害大鼠肝脏中的还原型谷胱甘肽系统,使细胞膜被破坏而在肝脏中蓄积。
肝脏是人和动物最重要的代谢和解毒器官,肝脏参与了全身输注过程中产生的有毒化合物和从环境进入机体的外源性毒素的代谢[35],因此有必要研究各形态氟暴露对肝脏正常功能及代谢的影响。肝细胞中的线粒体在维持肝功能方面起着重要的作用,线粒体呼吸链复合物亚单位是线粒体氧化磷酸化过程中的关键酶,线粒体呼吸链复合物亚单位的异常表达可能导致线粒体功能异常,从而对肝脏细胞造成损伤[36]。有研究表明活性氧和自由基诱导的损伤在肝脏的毒性中起重要作用[37]。全虾粉处理组雄鼠肝脏汇管区发生严重损害,肝细胞被损伤严重而且伴有有点状坏死,雌鼠肝细胞出现大量气球样变性,与文献[20]中观察结果相似,说明在5 种形态氟的共同作用下,可能会对线粒体呼吸链复合物亚单位或者活性氧和自由基或从其他方面产生影响,虽然蓄积并不是很多,但是仍对肝脏造成很大损伤,与文献[35]研究结果相似,根据蓄积情况可以推算水溶态氟对肝脏细胞造成的损伤最大;在水溶态虾粉组,雌雄鼠肝脏都出现一定的炎症和肝细胞毛玻璃样变性和淋巴细胞浸润肝窦,是药物损伤肝细胞的一个典型的特征,表明除水溶性氟以外的4 种形态氟共同作用可以对肝脏造成损害,程度没有5 种形态氟共同作用造成的肝损伤严重,可交换态氟对肝脏的损伤和水溶态氟相比较弱;可交换态氟虾粉组、氧化态氟虾粉组和有机结合态氟虾粉组雌雄鼠肝脏大多都是出现程度不同的炎症,如淋巴细胞浸润肝血窦、中央静脉区扩张,大量淋巴细胞浸润;以上现象说明5 种形态氟都可对肝造成损伤,但是程度不同,且越多不同形态氟之间的共同作用会对肝脏造成更明显的损害;氟化钠组雄鼠出现典型的炎症,雌鼠肝脏出现典型肝细胞气球样变性及炎症,与文献[38]结果相似;在空白组雄鼠肝脏中出现的肝窦扩张,肝细胞溶解破裂,雌鼠肝脏中出现的明显的桥接纤维化,伴有明显炎症,这表明动物饲料中的氟对肝脏有损伤作用。
仅通过观察肝脏病理学切片中肝细胞的形态和特征来研究各形态氟引起肝损伤的作用机制说服力不强,因此有必要采取其他方法进一步分析引起肝损伤的机制。很多研究表明,在氟中毒对机体的损伤中氧化应激作用起着很大的作用[39],机体慢性氟中毒时内脏组织病理学损伤可能与氟诱导机体脂质过氧化作用增强有关联[40];在正常情况下,体内氧自由基的产生和清除是处于一种平衡中,当氧自由基产生过多亦或是抗氧化体系故障时,体内氧自由基代谢就会出现失衡现象,这种现象被称氧化应激作用,活性氧自由基可以与机体内多种生物分子发生反应,破坏正常的组织结构和其功能,造成组织细胞生物膜、蛋白质、核酸等受损;氧自由基能够作用于生物膜中的多不饱和脂肪酸,导致脂质过氧化,最终生成产物MDA;MDA 的测定常常与SOD 活力的测定相互关联,MDA 的高低间接反映了机体细胞受自由基攻击的受损程度,SOD 活力的高低间接反映了机体清除氧自由基的能力高低,保护细胞免受氧自由基损伤,结合SOD 和MDA 的分析结果就可以了解到机体内氧化应激的情况[41]。有研究表明,自由基或其脂质过氧化产物易穿透核膜而对DNA 造成直接损伤,使凋控基因(P53、Bcl-2) 等遭到损坏,干扰细胞正常的生长和死亡平衡,导致细胞凋亡[42]。
4 结论
在肝脏中无论雄鼠还是雌鼠,与空白组相比各形态氟均有不同程度的蓄积,其中南极磷虾中水溶态氟含量仅次于阳性对照组。同时,根据大鼠肝脏组织病理学切片观察到南极磷虾中不同形态氟对肝脏也均有损伤。
总之,南极磷虾中各赋存形态氟的积累及其对大鼠肝脏的影响是一个重要的关注点。研究由这种积累引起的肝损伤对于保护动物和人类健康免受任何负面作用至关重要,需进行进一步研究。不仅要确定南极磷虾中氟的类型和浓度,还要确定暴露于这些物质时肝脏内发生的生化过程。这些研究可以更好地了解氟如何影响生物体,并能够为未来制定有效的预防计划。

