肝内门静脉周围水肿MR征象及潜在临床意义
朱宇晴, 邵志红, 刘卫英, 刘 梦
(上海市静安区市北医院放射科,上海 200435)
肝内门静脉周围水肿(periportal edema, PPE)是指由于各种原因导致肝内门静脉及其分支血管周围间隙扩大、积液或水肿的一种病理表现,可以弥漫或局限,又称门静脉周围晕、门静脉周围轨道征、门静脉周围低密度带、肝内门静脉周围间隙增宽或积液等[1]。以往有关肝内PPE征象的报道多见于CT增强检查。随着MRI技术的广泛应用,MR多序列成像更有利于该征象的显示,但在平时临床工作中该征象及其意义仍容易被忽视。本文旨在回顾性分析上腹部MRI平扫及增强检查病例的影像及临床资料,探讨肝内PPE征象MR检出率、各序列影像表现、分型及其潜在临床意义。
1 资料与方法
1.1 病例选择
收集上海市静安区市北医院放射科2019年3月—2022年4月所有行上腹部MRI平扫及增强检查病例的影像及临床资料。纳入标准为: (1) 所有病例均进行了完整的MR平扫及增强扫描,包括T1加权成像(T1WI)、T2加权成像(T2WI)、弥散加权成像(diffusion-weighted imaging, DWI)、多期增强T1WI;(2) 临床资料完整。
1.2 MRI检查
所有病例均采用荷兰飞利浦公司的Philips Multiva 1.5 T MR扫描。成像序列及扫描参数如下。(1) 双回波快速场回波(dual fast field echo, DUAL FFE)序列横断位T1WI,重复时间(repetition time,TR)=146 ms,回波时间(echo time, TE)=2.3、4.6 ms,层厚为7 mm;(2) 快速自旋回波(turbo spin echo, TSE)序列横断位T2W脂肪抑制像,TR=1 200 ms,TE=80 ms,层厚为7 mm;(3) 回波平面成像(echo planar imaging, EPI)序列横断位DWI: TR=3 000 ms,TE=64 ms,层厚为7 mm,b值包括50 s/mm2、800 s/mm2;(4) T1高分辨各向同性容积激发(T1 high resolution isotropic volume exami-nation, THRIVE)序列多期动态增强横断位T1W脂肪抑制像: TR=4.0 ms,TE=1.9 ms,层厚为5 mm,动脉期、门脉期、延迟期延时时间分别为18、50、90 s,增强扫描对比剂采用钆喷酸葡胺(gadoli-nium-diethylenetriamine pentaacetic acids, Gd-DTPA),剂量为0.1 mmol/kg,流率为33.5 mL/s。
1.3 MR图像及临床资料分析
由1名高年资主治医师和1名主任医师共同阅片,分析病例是否存在肝内PPE征象以及各主要序列上该征象的MR影像表现,同时根据病变范围将其分为肝叶型(局限于肝左叶或右叶内)及全肝型(同时累及肝左、右叶);结合肝内PPE征象阳性病例的临床资料,评价PPE征象及分型的潜在临床意义。分析意见不一致时,由多位高年资医师讨论解决。
1.4 统计学处理
数据采用SPSS 24.0软件进行统计学分析。PPE征象及MR表现采用阳性率表示,PPE分型采用n(%)的分析比较,以P<0.05表示差异有统计学意义。
2 结 果
2.1 临床资料
依据病例选择原则,共计522例纳入研究,其中104例MR存在肝内PPE征象,阳性率为19.9%,104例(男性56例,女性48例)肝内PPE征象阳性病例年龄3095岁,平均年龄为(66±12.9)岁,按照病因分别为肝源性疾病61例(58.6%)、胆源性疾病26例(25.0%)、心源性疾病1例(0.9%),其他疾病16例(15.4%);按照病变范围,其中全肝型98例(94.2%),肝叶型6例(5.8%)。
2.2 肝内PPE征象MR影像表现
肝内PPE的MRI表现为T1WI低信号,T2WI脂肪抑制像稍高信号,低b值DWI(b=50 s/mm2)明显高信号,高b值DWI(b=800 s/mm2)等高信号,当扫描层面与血管走行一致则呈“轨道征”,与血管垂直则表现为“晕环征”,门脉期或延迟期对比增强T1WI脂肪抑制像表现为血管周围低信号,以门静脉期显示更清晰。其中在T2WI脂肪抑制像上,部分细小分支血管“轨道征”、“晕环征”显示不明显,表现血管边缘模糊的稍高信号;在门脉期或延迟期对比增强脂肪抑制T1WI像,近肝门区PPE征象与门静脉周围脂肪分界不清;低b值DWI序列显示肝内PPE征象较T2WI脂肪抑制像及T1WI脂肪抑制像增强序列更敏感,干扰小,其阳性率达100%(图13)。

图1 肝内PPE征象MR影像表现(全肝型)Fig.1 MR imaging findings of intrahepatic PPE sign(whole hepatic lobe type)患者1,女,66岁,急性戊型肝炎,肝功能不全,总胆红素81 μmol/L;A: T2WI脂肪抑制像见门静脉周围高信号,呈“轨道征”,远端分支呈血管周围的模糊稍高信号影;B: 低b值DWI显示门静脉为流空低信号,“轨道征”显示更清晰;C: 门脉期T1WI脂肪抑制增强像显示为血管周围低信号,肝门部PPE征象与肝门周围脂肪分界不清;D: MRCP显示肝内胆管未见增宽
2.3 肝内PPE分型与临床的关系
根据肝内PPE征象在肝叶的分布范围分型,104例阳性病例中,全肝型有98例(94.2%);肝叶型6例(5.8%),两者比较差异有统计学意义(P<0.01)。
104例肝内PPE征象阳性病例中,有81例(77.9%)患者有不同程度的肝功能异常或黄疸。肝源性疾病包括病毒性肝炎、肝硬化、肝转移瘤、药物性肝功能损伤、脂肪肝、巨大肝脓肿、肝脓肿引流术后、肝肿瘤术后、肝肿瘤介入治疗后、肝内胆管结石及自身免疫性肝炎,以病毒性肝炎、肝硬化、肝转移瘤及药物性肝损伤为主,均表现为全肝型,肝源性占比明显高于其他疾病(P<0.05),全肝型明显多于肝叶型(P<0.01);胆源性疾病为胆囊炎及胆总管梗阻,胆总管梗阻中2例为胆总管下端结石,1例为胆总管下端占位病变,全肝型也明显多于肝叶型(P<0.01);心源性疾病和其他疾病(急性胰腺炎、胰腺肿瘤、胃癌化疗后、胃癌肝门部转移、骨髓增生异常移植后、干细胞移植术后、淋巴瘤治疗后)均表现为全肝型,各类型疾病具体分布见表1。
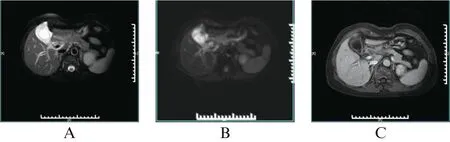
图2 肝内PPE征象MR影像表现(肝叶型)Fig.2 MR imaging findings of intrahepatic PPE sign(liver lobe type)患者2,女,58岁,急性胆囊炎;A: T2WI脂肪抑制像见门静脉右支及其分支周围高信号,呈“轨道征”,远端分支呈血管周围的模糊稍高信号影;B: 低b值DWI显示门静脉为流空低信号,“轨道征”显示更清晰;C: 门脉期T1WI脂肪抑制增强像显示为血管周围低信号,肝门部PPE征象与肝门周围脂肪分界不清

图3 肝内PPE征象MR影像表现(全肝型)Fig.3 MR imaging findings of intrahepatic PPE sign(whole hepatic lobe type)患者3,女,37岁,药物性肝损伤;A: T2WI脂肪抑制像见门静脉主干及左右支周围高信号,呈“轨道征”,远端分支呈血管周围的模糊稍高信号影;B: 低b值DWI显示门静脉为流空低信号,“轨道征”显示更清晰;C: 门脉期T1WI脂肪抑制增强像显示为血管周围低信号,肝门部PPE征象与肝门周围脂肪分界不清
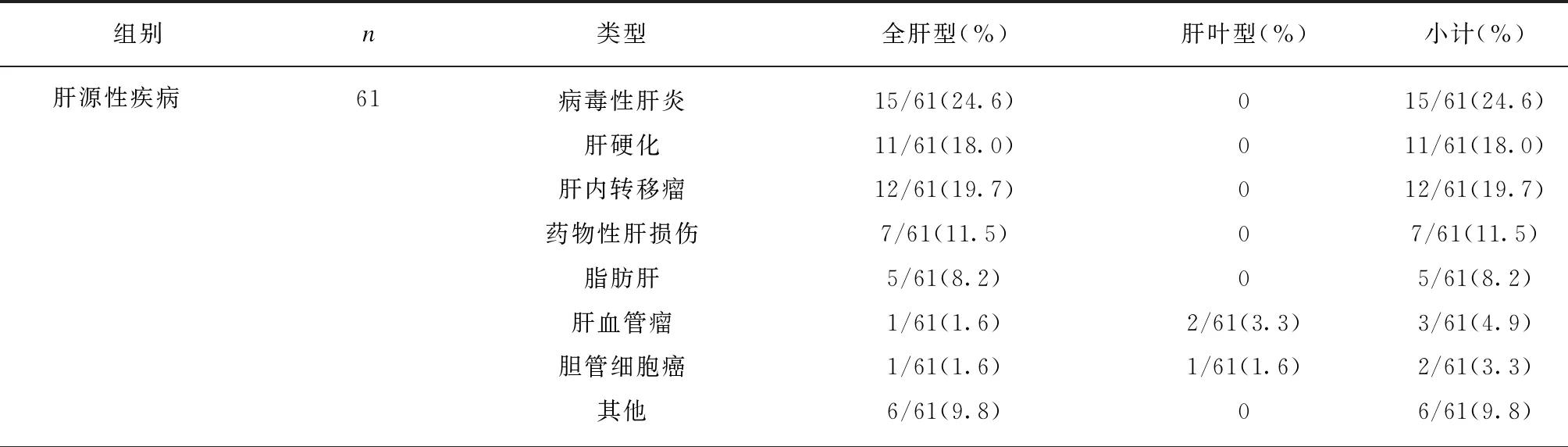
表1 不同类型疾病PPE征象在肝叶的分布类型
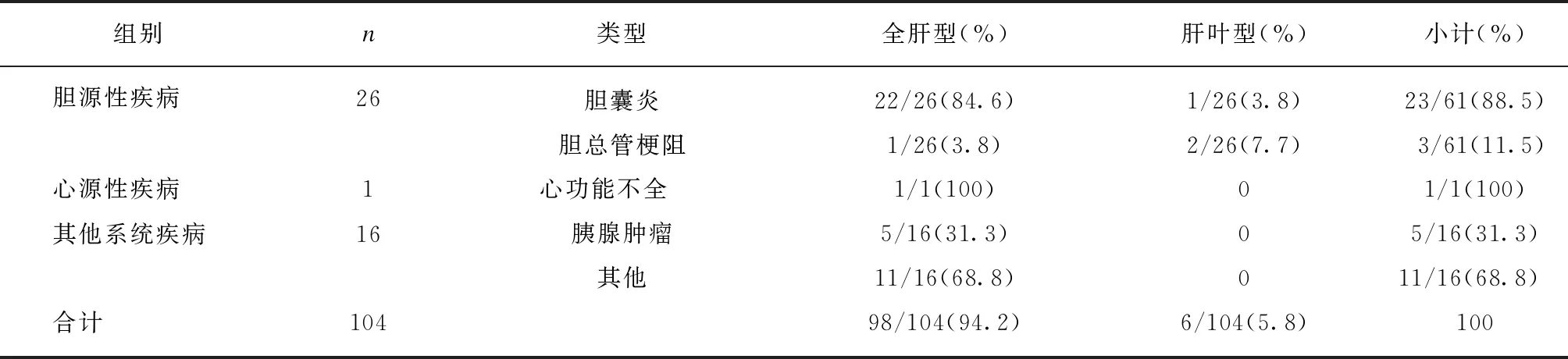
续表
3 讨 论
肝内PPE征象以往多见于CT增强报道[2-3],随着MRI在腹部应用的增多,MRI较好的组织分辨率理论上会更有利于肝内PPE的显示。本研究通过MRI图像的回顾分析发现肝内PPE征象阳性率达19.9%,说明其为一种临床常见的影像征象,再结合病例临床资料分析后发现,肝内PPE征象可能有利于疾病的病因诊断及病情程度的评估。
3.1 肝内PPE病理基础
肝内PPE的病理基础可能为门静脉周围间隙内结构或其周围病变引起的门静脉周围间隙改变,如胆管扩张、门静脉周围肿瘤等[4-6]。
多数学者认为肝内PPE与肝内淋巴动力学与血液动力学改变相关: (1) 各种原因引起的肝内淋巴液生成过多或回流受阻。肝脏或其他脏器疾病累及肝脏时,肝小叶正常结构破坏,经一系列病理生理变化后,致肝静脉压力明显增高,使肝内淋巴液大量生成;肝内外病变压迫或累及肝淋巴管后致其引流不畅、阻塞,可致局部淋巴引流障碍。(2) 外伤导致门静脉周围间隙内残留血液,等外伤血肿清除后,该征象亦会消失[7]。其中肝内淋巴动力异常被认为是PPE的最主要及重要的病理学基础。
3.2 肝内PPE征象MR表现
肝内PPE在MRI的T2WI脂肪抑制像、低b值DWI及T1WI脂肪抑制增强序列均可显示,在前两者均显示为高信号,后者显示为低信号,根据扫描层面与门静脉关系不同,显示为“轨道征”或“晕环征”。在T2WI脂肪抑制像上,门静脉及其分支由于扫描速度与静脉血流方向、血流速度的关系,可以表现为流空效应的低信号,也可表现为流入效应的高信号,表现为低信号时,周围的水肿呈高信号,可表现为典型的“轨道征”或“晕环征”;表现高信号时,与周围水肿信号不易分清,仅表现为血管周围模糊的稍高信号,同时还需要与扩张的肝内胆管相鉴别。在低b值的DWI图像中,由于门静脉均显示为低信号,胆管显示为高亮信号,故更容易识别周围水肿的高信号。在增强T1WI的图像上,由于门静脉及分支表现为高信号,周围水肿表现为低信号,可表现为典型的“轨道征”或“晕环征”,但是上腹部增强检查需要使用对比剂;而低b值DWI序列扫描速度快,门静脉及其分支均为流空的低信号,均可显示为典型的“轨道征”或“晕环征”,PPE征象显示阳性率达100%。另外,在脂肪抑制增强序列中,肝门部肝内PPE与周围脂肪均显示为低信号,不易区分,而低b值DWI的图像排除了脂肪的干扰,可以更准确地显示周围水肿的范围。
部分肝内PPE患者可合并如下异常: (1) 肝门区即腹主动脉旁淋巴结肿大,目前考虑为肝内淋巴液增多、淋巴管压力增高累及肝外所致;(2) 胆囊壁水肿,目前尚无定论,倾向于门静脉高压致胆囊静脉回流受阻,引起胆囊壁水肿、出血及炎性细胞浸润[8]。
肝内PPE征象鉴别诊断: (1) 肝内胆管扩张,与门静脉周围间隙增宽信号相同,但扩张的肝内胆管与肝总管、胆总管相延续,并位于血管一侧,呈“单轨道征”。(2) 肝裂或肝门区血管周围脂肪组织,DWI(b=50 s/mm2)呈低信号,有利于鉴别诊断。
3.3 肝内PPE征象的潜在临床意义
肝内PPE征象见于多种疾病,肝源性疾病为其主要致病原因,根据本组数据显示,以病毒性肝炎、肝硬化及肝内转移瘤为主。对照病理研究发现,慢性活动性肝炎或重症肝炎时,肝细胞明显肿胀,并可见大片状坏死和桥接坏死,坏死区域网状塌陷,并在周边可见结节样再生,再生与坏死并存。当病情严重到肝硬化时,正常肝小叶结构破坏,再生结节和假小叶形成,进而导致肝静脉压力增高,肝内淋巴液大量生成、瘀滞,导致门静脉周围间隙增宽[9-10]。陈天忠[11]、Ito[12]、Tan[13]、王彦[14]等认为肝内病变导致肝门静脉周围间隙增宽早于门静脉高压出现,可以提示早期肝硬化表现。但Ludwig等[15]认为肝内PPE改变对肝纤维化灵敏度较高,特异度中等,需结合其他临床资料。在本组数据中发现,肝内转移瘤常有肝内PPE存在,考虑可能与肝淋巴回流障碍有关。Takaji等[16]研究发现,结肠癌肝内多发转移时,肝内PPE的出现通常提示淋巴水肿,而不一定是肿瘤浸润表现。在本组病例中大部分病例有不同程度肝功能损伤,但肝内门静周围间隙增宽程度与肝功能受损程度是否关联,目前尚无定论。潘传敬等[9]对肝内淋巴管扩张的病理学研究发现,肝内病灶大、范围广时,病理上表现为肝内淋巴管扩张,反之病灶小、范围小时,病理上未观察到淋巴管扩张。陈天忠[11]、牛志斌[17]、李少波[3]等认为肝内淋巴管周围间隙增宽与肝功能损害程度呈正相关。另本组病例中,有多例病毒性肝炎、药物性肝损伤患者肝内PPE征象为唯一的阳性影像学表现。本组病例中无肝移植的病例,沈亚琪等[18]研究显示,肝移植术后病例均出现了门静脉周围间隙增宽的表现,与移植后时间长短不相关,且其他文献报道的肝胆手术后未出现肝内PPE改变,认为肝内PPE为原位肝移植术后的特有征象之一,考虑可能与肝淋巴回流障碍有关。
胆源性疾病引起的肝内PPE改变,考虑为胆囊病变引起肝内淋巴管炎症,致其扩张、水肿及渗出。心源性疾病患者多由中心静脉压升高,进而出现门静脉周围间隙增宽表现。本研究中有部分病例为肿瘤治疗后出现肝门静脉周围间隙增宽,考虑部分化疗患者可能因为补液过多,导致中心静脉压升高,肝门静脉周围间隙增宽。李维等[19]认为胃癌淋巴结转移至腹腔时,肝内淋巴回流受阻,致肝内淋巴管扩张、渗出。
文献显示外伤亦可引起肝内PPE改变,因本组数据无外伤病例,与病例数不足有关。Kuhlemann等[20]认为肝内PPE更易出现于重度创伤患者,但并不一定与肝损伤有关。Kleber等[21]则研究发现严重外伤后即时出现的肝内PPE可以预示创伤生命危险,如心包填塞或(张力)气胸,而继发出现的PPE可能预示创伤和术后并发症,如肺栓塞或呼吸窘迫综合征。
依照影像表现的分型,在本组病例中,以全肝型为主,主要见于肝源性疾病,如病毒性肝炎、肝硬化、肝内转移瘤、心功能不全及其他全身性疾病。肝叶型主要见于肝血管瘤、胆管细胞癌等。根据PPE征象,考虑累及全肝或全身性疾病继发的肝损害、心功能不全更易见于全肝型,而肝叶局限性病变,如胆管细胞癌、血管瘤等更易引起肝叶型改变;另,胆囊炎累及邻近肝时,亦可引起肝叶型PPE。
总之,肝内PPE是一种临床常见的影像征象,MRI包括T2WI脂肪抑制像、低b值DWI及对比增强T1WI有利于该征象的显示及鉴别,尤其是低b值DWI更有利于清晰显示其累及的范围及分型,且肝内PPE征象可能有助于判断其潜在病因及病情程度。

