肥胖减重术后肺功能的变化及可逆性研究
李雅溪, 谢栓栓, 王昌惠
(同济大学附属第十人民医院呼吸科与危重症医学科,上海 200072)
《中国居民营养与慢性病状况报告(2020)》[1]指出中国成年居民超重肥胖率达50.7%,我国肥胖问题现状异常严峻。肥胖威胁人类健康,在呼吸系统主要是由脂肪过多引起呼吸顺应性下降,肺容量下降和呼吸控制改变。减重手术常采用腹腔镜进行消化系统容积的缩减或消化道通路的重建,使患者消化吸收方式转变,达到减重及改善代谢的目的[2-3]。当前微创的术式对呼吸系统影响较少,且术后恢复较快,一般1年后患者减重疗效趋于稳定[4]。
肺功能作为评估呼吸生理和力学变化的重要指标,是研究肥胖对呼吸系统影响的基础。本文分析行减重手术后肥胖患者肺功能的改变特点,通过与健康人群比较,分析各功能的可逆性,明确患者从减重手术中的呼吸获益;尝试分析减重与肺功能指标的相关性,实现从减重方面预测肺功能改善的现实意义。
1 资料与方法
1.1 研究对象
纳入2019年1月1日—2021年12月31日在同济大学附属第十人民医院行减重手术的肥胖患者51例,其中男性18例,女性33例,平均年龄(33.12±11.01)岁,平均身高(169.00±9.39) cm,平均体重(109.91±26.76) kg,平均BMI(38.10±6.39) kg/m2。纳入标准: (1) 年龄为1565岁;(2) 可配合完成肺功能检查;(3) 行减重手术患者应满足: 存在与肥胖脂肪过剩相关的代谢综合征,如2型糖尿病、脂质代谢异常、脂肪肝、心血管疾病、睡眠呼吸暂停综合征等,经其他非手术治疗效果不佳或不能耐受者;(4) 无严重的精神、智力障碍;(5) 患者知情同意。排除标准: (1) 年龄<15岁或>65岁;(2) 存在有呼吸系统基础疾病,如哮喘、慢性阻塞性肺病、肺间质纤维化、胸廓畸形、毁损肺等影响肺功能的疾病;(3) 近3个月新发的心肌梗死、心律失常、脑梗死等;(4) 无法配合完成检查者。同时,收集健康对照组患者76例,其中男性38例,女性38例,平均年龄(33.50±4.85)岁,平均身高(167.88±8.40) cm,平均体重(62.59±8.61) kg,平均BMI(22.11±1.66) kg/m2。本研究已在中国临床试验中心注册(注册号: ChiCTR-OCS-12002381),所有患者的资料收集均征得患者及家属的同意。
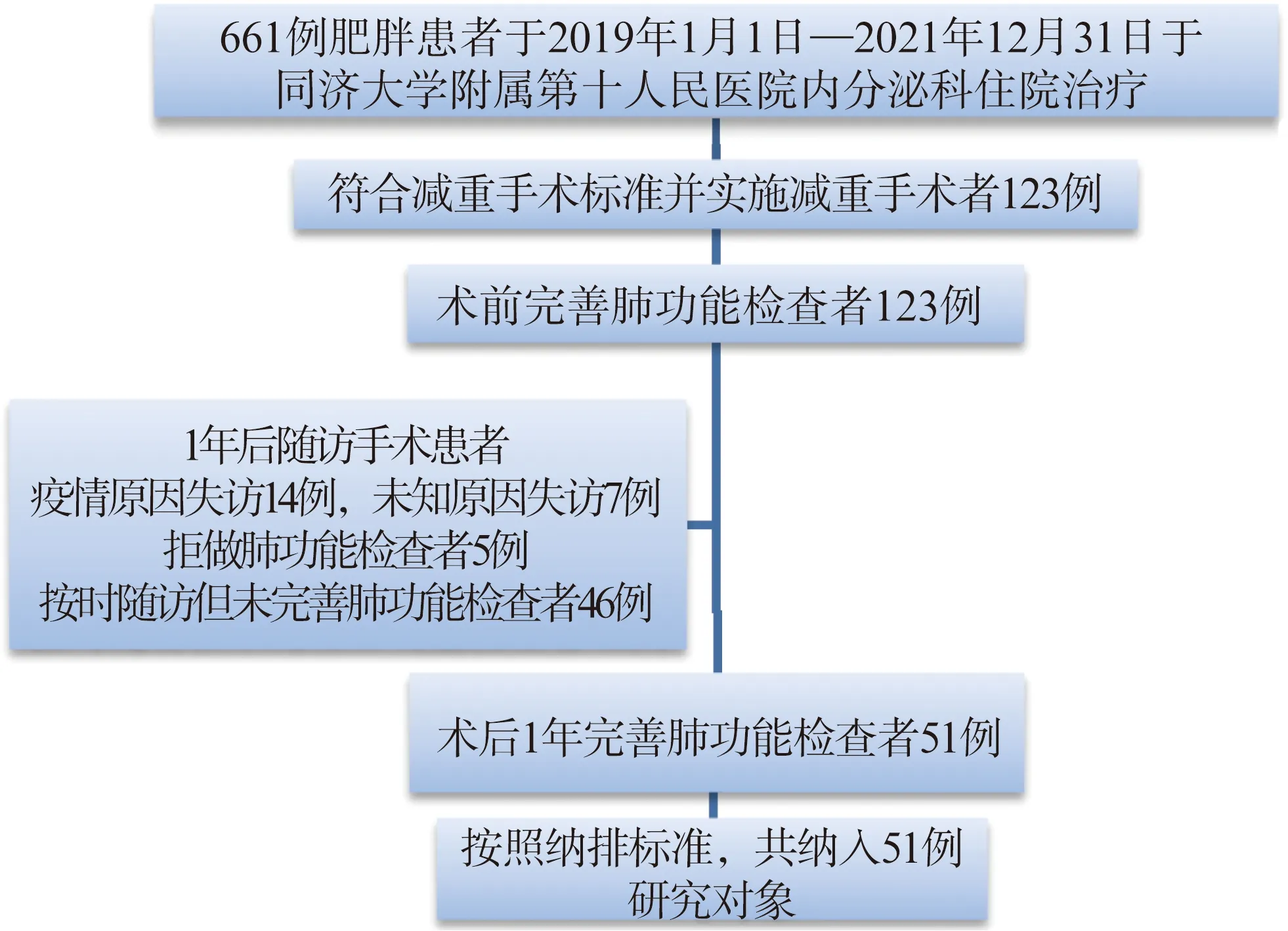
1.2 研究对象筛选流程
1.3 收集指标
收集受试者性别、年龄、身高、体重、BMI、术式、肥胖分布等一般临床资料及肺功能相关指标。
肺功能指标包括以下内容。容量指标: 肺活量(vital capacity, VC)、肺活量实测值/预计值(VC%);深吸气量(inspiratory capacity, IC)、IC%;补呼气量(expiratory reserve volume, ERV)、ERV%;残气量(residual capacity, RV)、RV%;功能残气量(fun-ctional residual capacity, FRC)、FRC%;肺总量(total lung capacity, TLC)、TLC%;通气功能指标: 第一秒用力呼出气容积(forced expiratory volume in 1 second, FEV1)、FEV1%;用力肺活量(forced vital capacity, FVC)、FVC%;一秒率(FEV1/FVC);流速指标: 用力呼出25%肺活量时的呼气流量(maxi-mum expiratory flow at 75% of forced vital capacity, MEF75)、MEF75%;用力呼出50%肺活量时的呼气流量(MEF50)、MEF50%;用力呼出75%肺活量时的呼气流量(MEF25)、MEF25%;最大中期呼气流量(MEF75-25 forced expiratory flow, MMEF)、MMEF%;呼气峰流量(peak expiratory flow, PEF)、PEF%;弥散功能指标: 肺一氧化碳弥散量(carbon monoxide diffusing capacity, DLCO)、DLCO%。
1.4 肺功能检查方法及质量控制
每位受试者均严格依照肺功能的质控标准进行肺量计检查[5]及肺弥散功能的测定[6]。受试前每个患者充分休息,由技术熟练的肺功能技师操作;在检查过程中,严密观察患者的配合情况,及时给予正确的指导,严格把控肺功能检查的质量,保证患者的安全和良好配合,保证测试数据的准确可靠。本研究采用德国耶格公司的MasterScreenTMPFT System肺功能仪。预计值公式标准采用系统ISO Standard公式群。用力肺活量测试时,受检者坐位,保持上身直立,夹紧鼻夹不漏气、口含一次性咬口器连接于肺功能仪,最大深吸气完全,至肺总量位后,尽最大努力和最快速度呼气,至呼气呼不出(残气量位)。过程中用力快速、持续而均匀,重复3次,取理想曲线的最佳值分析。弥散功能的测定,嘱患者先保持正常呼吸,待基线平稳后,令其呼气完全,然后快速均匀吸气至肺总量位(不少于肺活量的85%),摒气保持10 s,后以中等速度持续均匀呼出气体至完全。
1.5 统计学处理
2 结 果
2.1 基线资料及减重疗效
减重手术1年后,患者体重下降(31.41±13.19) kg,BMI下降(11.01±4.00) kg/m2,减重疗效明显,见表1。

表1 基线资料比较
2.2 减重前后肺功能变化
减重1年后,研究对象VC、ERV、TLC、FRC、RV、VC%、ERV%、TLC%、FRC%、RV%,较术前有明显改善(P<0.05),差异有统计学意义。IC、IC%较术前有下降(P<0.05),差异有统计学意义。
通气功能中,FVC、FEV1、FEV1/FVC,FEV1%、FVC%术后1年较术前有明显改善(P<0.05),差异有统计学意义。流量指标中,减重术后1年PEF、MEF75、MEF50、MEF25、MMEF、PEF%、MEF75%、MEF50%、MEF25%、MMEF%较术前均有明显改善(P<0.05),差异有统计学意义。弥散功能中,DLCO、DLCO%减重术后组较术前组有改善(P<0.05),差异有统计学意义,见表2、3。

表2 减重手术前后肺功能指标比较(绝对值)

表3 减重手术前后及术后与健康对照组肺功能指标比较(实测值/预计值)
2.3 ΔBMI与肺功能各指标改善量的相关性分析
减重手术后患者肥胖状况优化,肺功能指标改善,为研究BMI改善状况与肺功能各指标间的关系进行相关分析。结果显示ΔBMI与MEF25、RV、FRC存在中等程度相关。结果见表4。

表4 ΔBMI与肺功能各指标改善量的相关性
2.4 减重术后与健康对照基线资料及肺功能指标比较
减重术后患者与健康对照组相比,基线资料性别、年龄、身高无差异,具有可比性,见表1。减重手术1年后患者体重均值为(78.50±20.12) kg,BMI为(27.08±5.11) kg/m2,较健康人群体重仍偏胖,但此时术后患者VC%、ERV%、FVC%、FEV1%、MEF25%、MMEF%、FRC%、RV%、DLCO%较健康对照组更高,PEF%较健康对照组低,差异有统计学意义(P<0.05)。IC%、FEV1/FVC%、MEF75%、MEF50%、TLC%与健康组差异无统计学意义(P>0.05),见表3。
3 讨 论
肥胖人群肺和胸壁的力学特性发生显著改变[7-8],同时存在脂质代谢异常,肺泡表面活性物质减少[9],肺泡趋于塌陷。肺、胸壁和整个呼吸系统顺应性下降[10-13],呼气储备容量和肺静息容量大幅减少。此时,肥胖人群通过深吸气,加强呼吸肌肉做功来克服吸气阻力,IC代偿性地增加,保证足够的通气量。肥胖患者静息时肺容积缩小,呼吸位于肺压力-容积曲线的低位拐点之下,肺弹性阻力明显增大,肺泡剪切力增大,肺顺应性下降,呼吸做功增加。
假设肥胖是肺力学和功能变化的主要驱动因素,减重将逆转肺功能的变化。当肥胖程度改善,胸腹腔的限制减少,胸廓顺应性改善。同时脂质代谢异常纠正,脂蛋白混合物-肺泡表面活性物质的生成及发挥作用恢复,肺泡表面张力和弹性阻力下降,肺顺应性改善。呼吸模式随减重趋于正常,肺容量明显改善,VC、TLC增加。减重术后呼气末气管塌陷和空气潴留减少,从呼吸生理的角度解释了FRC、ERV的恢复[14],因此,IC无需进行过多代偿,表现为明显下降[15-17]。同时,胸腹腔脂肪堆积减少,胸腔压力减少,外周气道陷闭及微小肺不张状况明显改善,通气指标FEV1、FVC、FEV1/FVC提高[18],患者在肺通气方面的功能增强。
减重直接导致呼吸负荷减轻,呼吸肌疲劳缓解,呼吸肌肉活动效率增加,PEF增加是呼吸肌力恢复与气道通畅程度改善的反映[19-21]。MMEF、MEF50、MEF25作为小气道功能的判定指标[22],减重后的改善,与诸多研究中减重后患者反映外周气道阻力R5(5 Hz时气道阻力)降低[21,23]的结论相一致。外周阻力减小,小气道通畅性改善,各流量指标升高。究其原因呼吸系统阻力具有容量依赖性,肥胖导致的低容量影响气道开放,减重使容量限制解除,气道阻力明显下降。
减重后患者肺功能各指标均有不同程度的改善,提示肥胖引起的肺功能变化可逆。MEF25、FRC、RV对肥胖敏感,肥胖程度的增加引起肺部顺应性的下降,在初期就表现出功能残气量、残气量的变化;肥胖对胸廓的压迫,微小气道更容易地接收到胸内压力增加的信号而产生反应,MEF25下降。同样,体重减轻时这些指标更敏感地作出反应,并表现出与ΔBMI的相关性。减重疗效越好,MEF25、RV、FRC的改善越明显。
为明确减重患者在疗效稳定后肺功能是否完全可逆,恢复到健康人群水平,本研究将术后1年的患者与健康人群进行比较。发现部分指标已与健康水平无差异;PEF减重后仍低于健康人群,是膈肌及其他呼吸肌肉肌力或活动效率仍受限的表现;其余指标优于健康人群。VC、FEV1、DLCO肥胖减重后人群比健康人群更佳,提示其肺通气功能和换气功能可逆并优于健康人群。肥胖多合并高血压、高脂血症、糖尿病等代谢疾病。高血压引起心血管病变,冠状动脉硬化是肺功能下降的独立危险因素[24];高脂血症可激活脂肪酸诱导的炎症,损伤气道及肺[25];胰岛素水平升高可引起气道平滑肌形态和功能的异常,增强气道反应性,降低肺功能[26]。代谢因素是影响肺功能的重要因素[27]。减重后代谢疾病及炎症状况改善,呼吸道及肺得益于内环境的重塑而发生积极变化,肺功能将提高。总之,肥胖人群减重后,体重减轻引起的机械效应和内环境代谢免疫的改善共同作用,对肺功能产生1+1>2的效果。表现为减重后部分人群的体重即使没有完全恢复正常标准,但多项肺功能指标优于健康人群水平。
本研究的不足,其一,由于疫情影响手术患者减少及失访情况增多,收集的研究对象数量较少,尚不能对人群分层进行深入研究;其次,为了区分机械和代谢的影响,需要更科学严谨的研究设计对减重代谢手术后各项指标进行观察记录分析,用于全面评估减重手术对肺部的积极和消极影响。另外,使用更先进的技术来测量肺功能指标,或许会更清楚地阐明肥胖对呼吸系统的影响。
本研究的亮点在于,全面关注了反映气道功能的各流量指标,特别是小气道病变作为当前多种疾病早期受累的表现,在临床有重要的应用意义。减重对小气道功能的正向影响提示减重对呼吸生理和力学方面的利好。同时减重后肺功能的逆转为呼吸系统疾病中存在的“肥胖悖论”提出了可能的切入点,这有赖于更多的研究论证。此外,本研究不仅聚焦减重前后肺功能的变化,更关注肥胖减重人群与健康人群的差别。即使减重手术后部分人群体重仍偏重,但肺功能的可逆表明其社会功能和躯体功能的恢复,对于肥胖人群重建信心的社会意义重大。
——肺活量测定用于无症状吸烟者气道阻塞筛查

