LMR、NLR与肺癌患者病理分型及免疫治疗疗效的关系研究
张舒舒, 王辉, 冯正阳, 史可君
肺癌起病隐匿,早期无典型临床症状,多数肺癌患者确诊时已为中晚期[1-2]。肺部功能较差,不可通过手术根治性切除,放/化疗联合分子靶向药物免疫治疗是临床挽救中晚期肺癌患者生命的主要手段[3-4]。机体系统性炎性反应参与多种肿瘤的发生、发展,其中淋巴细胞/单核细胞比值(lymphocyte/monocyte ratio,LMR)、中性粒细胞/淋巴细胞比值(neutrophil/lymphocyte ratio,NLR)是炎性因子的重要代表,已被证实可作为胰腺癌、食管癌、胃癌等实体瘤的独立预后因素,有效评估临床疗效及预后[5-7]。但LMR、NLR与肺癌患者病理分型及免疫治疗疗效相关性研究不多。本研究通过探讨LMR、NLR与肺癌患者病理分型及免疫指标疗效的关系,为临床早期辨别肺癌病理类型、监测疗效提供参考依据,现报道如下。
1 资料与方法
1.1 一般资料
收集2019年1月至2021年1月苏州大学附属第二医院肿瘤科收治的200例肺癌患者定义为研究组,纳入标准:①经临床活检穿刺诊断为肺癌;②外科评估结果:不可通过手术根治性切除;③无放化疗、免疫治疗禁忌证,且接受4个周期以上的免疫治疗;④治疗前1周内及治疗4个周期后血常规报告及影像学资料完整。排除标准:①治疗前2周内服用过影响淋巴细胞、单核细胞或中性粒细胞的激素类药物;②既往接受过抗肿瘤治疗;③合并急性或慢性感染、免疫系统疾病、血液系统疾病或神经性疾病;④合并其他恶性肿瘤或依从性较差。研究组男124例、女76例,年龄41~75岁、平均年龄(65.27±3.25)岁。同期于医院进行体检的100例健康志愿者为对照组,男60例、女40例,年龄40~78岁、平均年龄(65.30±3.19)岁,研究组、对照组一般资料差异无统计学意义(P>0.05),有可比性。本研究符合相关医学伦理规定,经本院医学伦理委员会批准。
1.2 免疫治疗疗效评价标准
肺癌患者接受一线化疗联合分子靶向药物免疫治疗4个周期后评估免疫治疗疗效:完全缓解:靶病灶完全消失,肿瘤标志物正常;部分缓解:靶病灶最大径之和较治疗前减少≥30%;疾病稳定:靶病灶最大径之和较治疗前减少<30%或较治疗前增加<20%;疾病进展:靶病灶最大径之和较治疗前增加≥20%或出现新病灶。疾病控制率=(完全缓解例数+部分缓解例数+疾病稳定例数)/总例数。
1.3 方法
1.3.1 LMR、NLR检查方法 采集受试者空腹静脉血5 ml,采用迈瑞CRP-M100特定蛋白免疫分析仪(深圳迈瑞生物医疗电子股份有限公司)检测血液中淋巴细胞计数、单核细胞计数、中性粒细胞计数,计算LMR、NLR。
1.3.2 分组 根据受试者工作特征曲线(receiver operating characteristic,ROC)中LMR、NLR预测肺癌患者免疫治疗疗效的最佳临界值,将高于LMR最佳临界值的肺癌患者定义为高LMR组、低于LMR最佳临界值的肺癌患者定义为低LME组,高于NLR最佳临界值的肺癌患者定义为高NLR组、低于NLR最佳临界值的肺癌患者定义为低NLR组。
1.4 观察指标
①比较研究组、对照组LMR、NLR;②比较疾病控制肺癌患者、疾病进展肺癌患者LMR、NLR;③分析LMR、NLR与肺癌患者病理分型及免疫治疗疗效的关系。
1.5 统计学方法
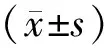
2 结果
2.1 研究组、对照组LMR、NLR比较
研究组LMR、NLR均高于对照组,差异均具有统计学意义(P<0.05)。见表1。

表1 研究组、对照组LMR、NLR比较
2.2 疾病控制肺癌患者、疾病进展肺癌患者LMR、NLR比较
疾病控制肺癌患者组LMR、NLR均低于疾病进展肺癌患者组,差异均具有统计学意义(P<0.05)。见表2。
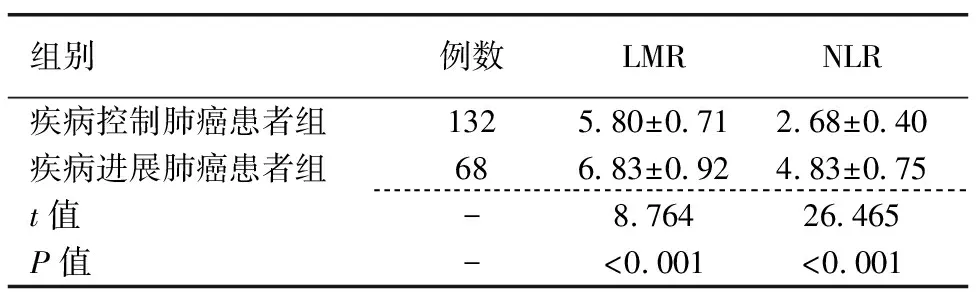
表2 疾病控制肺癌患者、疾病进展肺癌患者LMR、NLR比较
2.3 ROC分析LMR、NLR预测肺癌患者免疫治疗疗效的最佳临界值及分组结果
ROC曲线结果显示,LMR、NLR预测肺癌患者免疫治疗疗效的最佳截断值分别为6.27、3.86,见图1。将LMR高于6.27的60例肺癌患者纳入高LMR组,其余140例肺癌患者纳入低LMR组,NLR高于3.86的72例肺癌患者纳入高NLR组,其余128例肺癌患者纳入低NLR。
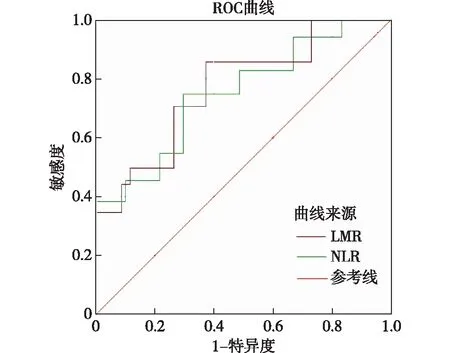
图1 LMR、NLR预测肺癌患者免疫治疗疗效ROC曲线图
2.4 LMR、NLR与肺癌患者病理分型及免疫治疗疗效的关系
高LMR组和低LMR组,高NLR组和低NLR组之间性别、年龄、TNM分期差异无统计学意义(P>0.05);高LMR组和低LMR组、高NLR组和低NLR组患者病理类型间差异,均具有统计学意义(P<0.05);高LMR组疾病控制率(33.33%)低于低LMR组(80.00%),高NLR组疾病控制率(36.11%)低于低NLR组(82.81%),组间差异均具有统计学意义(P<0.05)。见表3。
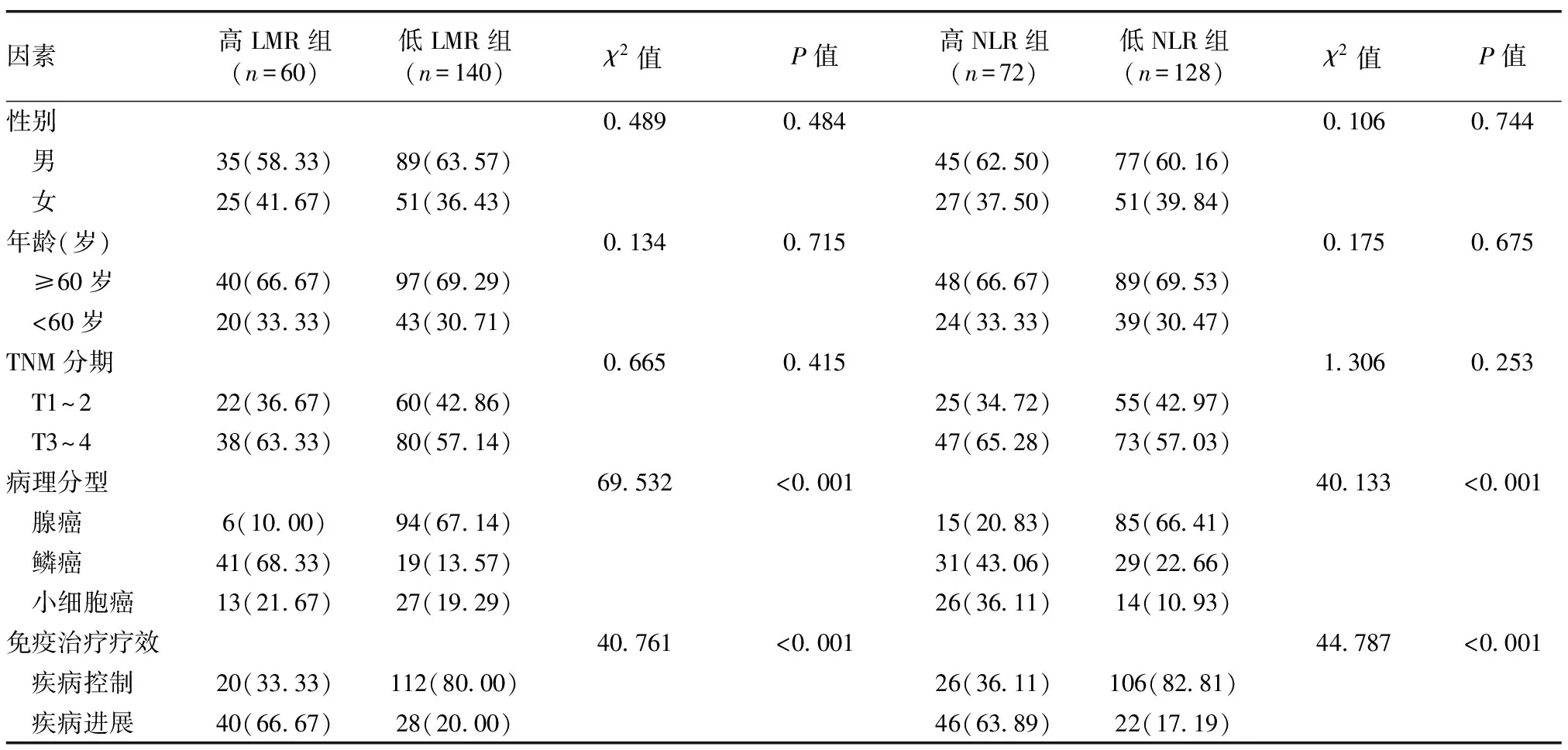
表3 LMR、NLR与肺癌患者病理分型及免疫治疗疗效的关系[例(%)]
3 讨论
目前,与放化疗结合的免疫治疗是中晚期肺癌患者提高生存率的有效手段[8-9]。研究表明[10-11],机体全身炎性反应与肿瘤增殖、侵袭及转移相关,且随着肿瘤分化程度的发展,促肿瘤的炎性反应会压制机体抗肿瘤免疫,即炎性反应的发生可促进肿瘤细胞增殖、侵袭。本研究以接受免疫治疗的肺癌患者为研究对象,进一步探讨LMR、NLR与肺癌病理分型及免疫治疗疗效的相关性。
肿瘤微环境中常聚集大量免疫细胞,作为炎性反应重要指标的淋巴细胞可直接杀伤肿瘤细胞,同时可通过介导机体免疫应答分泌多种免疫因子参与机体抗肿瘤免疫[12];单核细胞进入肿瘤微环境后分化为与肿瘤相关的巨噬细胞,产生肿瘤坏死因子α、血管内皮生长因子等促进肿瘤微血管生长,加速肿瘤细胞侵袭、转移,同时单核细胞可直接提供营养因子促进肿瘤细胞发展[13];中性粒细胞可释放基质金属蛋白酶(matrix metalloproteinase,MMPs)、弹性蛋白酶(neutrophil elastase,NE),其中MMPs降解细胞基底膜后可破坏组织学屏障,增强新血管的生成,促进肿瘤增殖;NE有助于维持肿瘤表皮生长因子受体活性,继而抑制机体肿瘤免疫,促进肿瘤侵袭及转移[14-15],检测LMR、NLR可反映肺癌患者体内炎症水平及免疫功能情况。本研究通过比较肺癌患者、健康人群的LMR、NLR发现,研究组LMR、NLR均高于对照组,提示LMR、NLR高水平可能促进了肿瘤细胞增殖、侵袭,临床可进一步探讨LMR、NLR动态变化预测肺癌患者远期预后的价值。本研究结果显示,疾病控制肺癌患者LMR、NLR均低于疾病进展肺癌患者,提示LMR、NLR高表达促进肺癌疾病进展,宿主抗肿瘤免疫反应主要依靠淋巴细胞释放淋巴因子以激活抗肿瘤免疫反应,单核细胞刺激肿瘤细胞产生趋化因子而促进肿瘤发展。LMR升高意味着外周血淋巴细胞相对增加或单核细胞相对减少,证实了淋巴细胞、单核细胞在肺癌发生中的作用,与梁丽江等[16]研究结论一致。中性粒细胞在炎性反应中不仅可靶向肿瘤细胞,同时分泌肿瘤生长因子、趋化因子,刺激血管生成,与Punjab等[17]等得出结论相近,NLR升高意味着中性粒细胞相对增加或淋巴细胞相对减少,此时机体抑制肿瘤的免疫反应较弱,不益于肺癌患者预后。临床可进一步探索LMR、NLR在其他恶性肿瘤疾病进展中发挥的作用。
炎性反应指标的高低与肿瘤微环境密切相关,对于肺癌、胃癌等实体肿瘤患者来说,高LMR、NLR提示肿瘤具有侵袭性、转移性,LMR、NLR变化可能与肿瘤负荷、活性相关[18-19]。本研究通过ROC曲线分析LMR、NLR预测肺癌患者免疫治疗疗效的最佳临界值,并依据最佳临界值将肺癌患者分组,结果显示高LMR组和低LMR组、高NLR组和低NLR组患者病理类型存在差异,其中低LMR组腺癌占比大于高LMR组、低NLR组中腺癌占比大于高NLR组,检测LMR、NLR可辅助临床判定肺癌病理分型。此外,本研究高LMR组疾病控制率(33.33%)低于低LMR组(80.00%),高NLR组疾病控制率(36.11%)低于低NLR组(82.81%),提示LMR、NLR与肺癌患者免疫治疗疗效相关,且LMR、NLR低的肺癌患者免疫治疗疗效较好,LMR、NLR变化有助于临床评估中晚期肺癌患者预后。近期一项研究发现[20],晚期肺癌患者接受免疫治疗后,低NLR组不良预后发生风险低于高NLR组,但随访发现,部分患者NLR有上升趋势,分析与本研究结果差异的原因可能是NLR最佳临界值不同,且免疫治疗周期不同对机体炎性反应的影响不同,临床可扩大样本量进行多中心临床试验进一步探讨NLR动态变化对肺癌患者远期预后的预测价值。
综上所述,LMR、NLR与肺癌患者病理分型及免疫治疗疗效相关,检测LMR、NLR可在评估肺癌患者的病情发展及治疗效果中发挥一定的作用。

