癌相关成纤维细胞外泌体通过抑制铁死亡促进前列癌恶性侵袭
赵军, 毛亮, 沈继杰, 孙宏斌
铁死亡是一种铁依赖性细胞死亡模式,特征改变是脂质过氧化导致活性氧(reactive oxygen species,ROS)大量累积及谷胱甘肽过氧化物酶4(GPX4)的失活,机制特征不同于细胞凋亡等其他细胞死亡方式。GPX4是铁死亡关键调控蛋白[1], 在前列腺癌中呈高表达[2]。下调其表达可引发肿瘤细胞铁死亡,是肿瘤治疗中区别于传统疗法的新策略,已引起临床极大关注。多个研究发现microRNA-15a、microRNA-214-3p等小分子mRNA抑制物参与调控前列腺癌铁死亡[3-4]。癌相关成纤维细胞(CAFs)是肿瘤微环境中基质细胞的主要成分,可通过传递外泌体miR-522抑制铁死亡促进胃癌化疗耐药[5]。在前列腺癌中,CAFs与GPX4高表达及与铁死亡的关联性还未可知。课题组前期已经报道CAFs在体外和体内实验条件下可显著促进前列腺癌细胞增值和侵袭[6],本研究拟观察CAFs来源的外泌体(CAFs-exo)是否通过调控前列腺癌铁死亡促发前列腺癌细胞增殖和迁移。
1 资料与方法
1.1 一般资料
1.1.1 细胞 人前列腺癌细胞株22rv1和PC-3 购自中国科学院细胞库。前列腺癌新鲜组织取自南京市第一医院泌尿外科行前列腺癌根治术患者,由病理科医生确诊取材,获得富含肿瘤区域的癌组织及癌旁组织,本研究经伦理委员会批准,获患者知情同意。
1.1.2 主要试剂及仪器 1640培养基、胎牛血清、胰蛋白酶购均自美国Gibco公司;无外泌体血清购自美国System Bioscience公司;肿瘤组织解离液购自德国Miltenyi公司;Transwell小室、Mgtrigel 基质胶购自美国Corning公司;α-SMA、FSP-1、Vimentin、E-cadherin、N-cadherin、β-catenin、Actin、NFR2、ACSL4、GPX4、GAPDH一抗购自中国Proteintech公司,FAP一抗购自美国Cell Signaling Technology公司,IgG二抗购自中国Biosharp公司;铁死亡诱导剂Erastin购自美国Medcheemexpress公司;ROS检测试剂盒、细胞死亡PI检测试剂盒购自中国KeyGEN 公司;线粒体膜电位(mitochondrial membrane potentia,MMP)检测试剂盒购自中国 Beyotime公司;DxFLEX流式细胞仪、超速离心机、酶标仪购自德国,BECKMAN公司;荧光显微镜购自德国Zeiss公司;Western blot电泳仪购自中国Tanon公司。
1.2 细胞培养和鉴定
1.2.1 CAFs和NFs培养 按课题组已建立的方法[6],收集前列腺癌癌组织和癌旁新鲜组织,无菌PBS液冲洗2次,于超净台中将组织样本剪碎至2 mm大小,组织解离液消化30 min,1 000rpm离心5 min,弃上清,加入含有10%胎牛血清的1640培养基中重新悬浮,并传递到培养皿中,洗去组织碎片和没有贴壁的细胞,每3~4 d更换培养液传代1次,取第二代到第六代细胞进行实验研究。
1.2.2 CAFs和NFs表型鉴定 免疫荧光和Western blot检测NFs和CAFs中α-SMA、FAP和FSP-1蛋白表达水平。免疫荧光实验步骤为:将细胞接种到24孔板,贴壁后4%多聚甲醛固定15 min,1% TritonX-100冰上通透15 min,加入5%的BSA溶液(含有0.2% TritonX-100)37 ℃封闭1 h,加入1∶200的α-SMA、FSP-1、FAP一抗,4 ℃孵育过夜,然后用TBST洗3次,然后加入稀释好的荧光二抗,37 ℃孵育1.5 h,TBST洗3次后,取出细胞爬片置于载玻片上用DAPI染细胞核,在荧光显微镜下观察荧光强度。
1.2.3 前列腺癌细胞培养 取液氮中保存的前列腺癌细胞22rv1和PC-3,于37 ℃水浴锅中迅速解冻,加入完全培养基中和冻存液,1 000 rpm离心5 min,弃去上清,加入含有10%血清的1640完全培养基,吹打混匀后,加入培养瓶中,置于培养箱中培养。
1.3 外泌体提取和鉴定
1.3.1 外泌体提取 超速离心法提取外泌体。使用无外泌体血清培养CAFs和NFs,收集上清液,在10 000 g下离心30 min去除碎片,然后在超速离心机110 000 g下离心120 min,弃去上清液,从沉淀物中收集外泌体并重新悬浮在PBS中,置-80 ℃冰箱保存。所有步骤均在4 ℃环境下进行。
1.3.2 外泌体鉴定 ①Western blot检测TSG101、CD63、CD9蛋白表达;②透射电镜:将外泌体置7.2%戊二醛液4 ℃固定过夜,PBS液冲洗后置1%四氧化锇室温固定60 min,包埋于10%明胶,戊二醛固定后切成<1 mm3小块。按酒精梯队脱水(酒精浓度分别为30%,50%,70%,90%,95%和100%),环氧丙烷交换纯醇,Quetol-812环氧树脂(浓度分别为25%,50%,75%和100%)与环氧丙烷混合浸润标本,包埋并聚合(35 ℃ 12 h,45 ℃ 12 h,60 ℃ 24 h)。徕卡UC100切片机切割超薄切片(6 nm),经乙酸铀酰和柠檬酸铅染色后在FEI Tecnai T20透射电镜中观察外泌体形态;③纳米颗粒跟踪技术(nanoparticle tracking analysis,NTA):将外泌体以5 mg/L的浓度重悬于PBS中,进一步将悬液稀释100~500倍。在环境温度下手动将样品注入样品室。每个样品都配置有488 nm激光器和高灵敏度sCMOS相机,通过收集纳米颗粒散射光信号,拍摄一段纳米颗粒在溶液中做布朗运动的影像,对每个颗粒的布朗运动进行追踪。最后,使用NTA分析软件计算出外泌体的半径和浓度。
1.4 细胞迁移和侵袭实验
用不含血清的1640培养基稀释22rv1和PC-3细胞,接种至Transwell小室,加入100 μL基质胶和培养基的混合物(比例1∶7),置37 ℃恒温培养并凝固2 h,每个小室加入1×105个细胞悬液200 μL,每组分别加入PBS、CAFs-exo和NFs-exo,外泌体终浓度为10 mg/L,将小室放入24孔板中,每孔加入600 μl含有1 μmol/L Erastin 的1640完全培养基,置37 ℃恒温培养箱24 h。PBS清洗,4%多聚甲醛固定Transwell小室15 min,结晶紫染色15 min,PBS液清洗,倒置显微镜下观察拍照,image J软件分析比较各组细胞迁移以及侵袭的细胞数并统计分析。
1.5 细胞划痕实验
在6孔板中接种22rv1和PC-3细胞,待细胞生长汇合至90%,用10 μL枪头配合直尺在每孔单层细胞上竖痕,使细胞形成伤口模型,PBS清洗两遍去除划痕处细胞,在显微镜下观察并拍照记作0 h,加入含有1 μmol/L Erastin的1640培养基,每组分别加入PBS、CAFs-exo、NFs-exo,外泌体浓度为10 mg/L,24 h后在显微镜下观察细胞划痕的愈合程度并拍照。
1.6 平板克隆实验
将约500个22rv1和PC-3细胞接种到6孔板中,37 ℃恒温培养2周。去除培养液,PBS清洗,加入4%多聚甲醛固定细胞,加入结晶紫染色,观察细胞菌落数量并拍照。
1.7 ROS水平、细胞死亡、线粒体膜电位检测:评估细胞铁死亡相关指标
1.7.1 ROS水平检测 按ROS检测试剂盒步骤进行。所检测的细胞数<5×105/ml,去除培养液,加入含有10 μmol/L DCFH-DA的无血清培养液,在37 ℃避光的细胞培养箱中培养30 min。使用激发波长488 nm和发射波长525 nm测量荧光,每组的平均荧光强度表示细胞内ROS的量。
1.7.2 细胞死亡检测 将细胞均匀地生长在12孔板中,10 μmol/L Erastin处理后收集细胞,重新悬浮在流管中(50 000个细胞/管),与2 μL的PI试剂孵化10 min,流式细胞仪分析死亡细胞情况。
1.7.3 线粒体膜电位(MMP)检测 将细胞均匀地生长在6孔板中,按照试剂商说明用适量的TMRE工作液孵育15 min,用PBS去除残留的TMRE,收集标记的细胞,通过荧光信号的强弱来检测MMP的变化,MMP降低荧光强度减弱。使用酶标仪检测细胞荧光强度,其激发波长为550 nm,发射波长为575 nm。
1.8 Western blot实验 胰蛋白酶消化细胞后离心,RIPA裂解液提取细胞总蛋白,BCA法测量蛋白浓度。加入SDS上样缓冲液,100 ℃水浴中煮沸15 min,蛋白充分变性后将样品上样到SDS-PAGE凝胶中电泳,转PVDF膜上,5%脱脂牛奶封闭膜2 h,加入1∶2 000一抗稀释液4 ℃孵育过夜,TBST洗膜3次后,加入1∶5 000稀释的二抗在摇床上室温孵育2 h,TBST洗膜3次,每次15 min,配置化学发光液,曝光机下曝光。
1.9 统计学分析
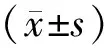
2 结果
2.1 CAFs原代培养及表型鉴定
CAFs和NFs均阳性表达特征蛋白α-SMA、FAP和FSP-1,但CAFs荧光染色强度(图1)及蛋白表达量(图2)均高于NFs。
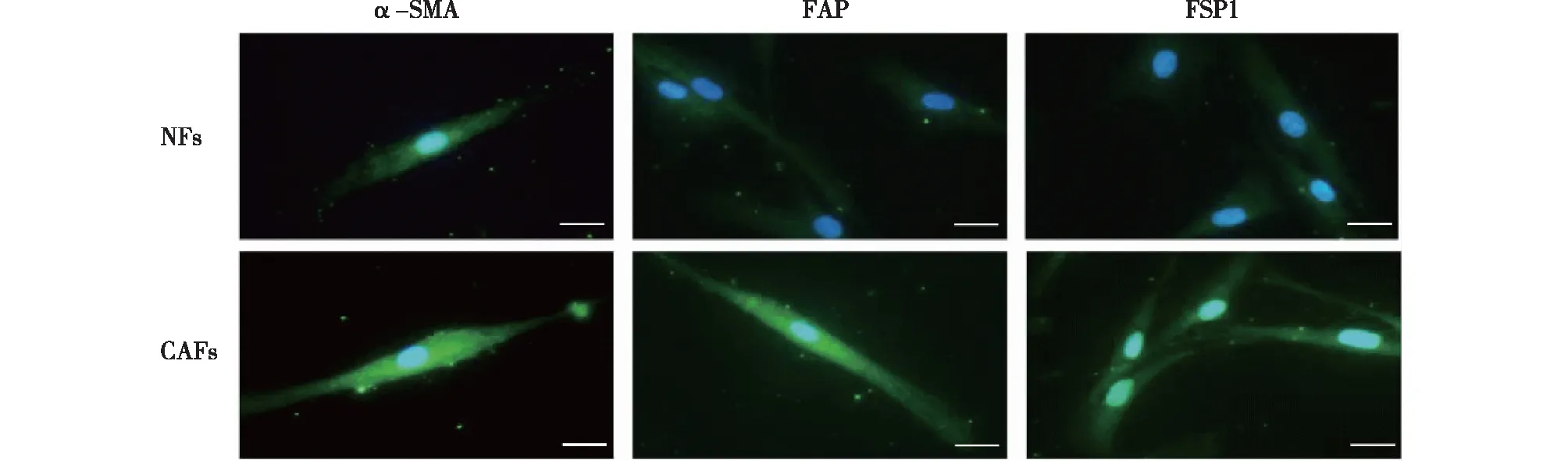
图1 免疫荧光鉴定NFs和CAFs的结果 细胞呈长梭形或不规则三角形,放射状生长,细胞铺满瓶底后相互交织,细胞间几乎没有间隙,CAFs和NFs均阳性表达特征蛋白α-SMA、FAP和FSP-1,CAFs中α-SMA、FAP以及FSP1的荧光强度高于NFs,比例尺为50 μm
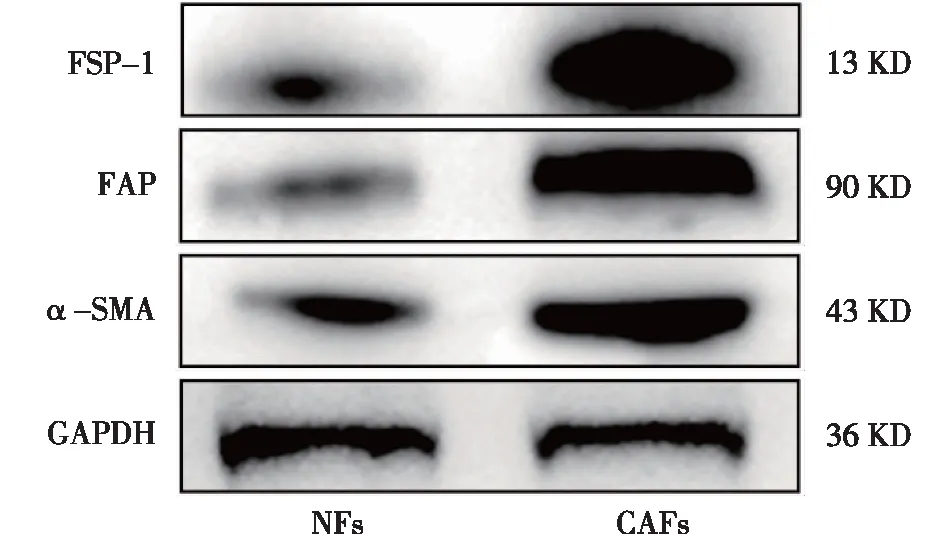
图2 Western blot鉴定NFs和CAFs表面标记物α-SMA、FAP、FSP-1表达 CAFs中α-SMA、FAP以及FSP-1的蛋白表达量均高于NFs
2.2 外泌体鉴定
CAFs-exo和NFs-exo均呈典型的球形膜状结构(图3),粒径大多为30~150 nm(图4),Western blot检测示特征性蛋白CD9、CD63、TSG101均表达阳性(图5)。
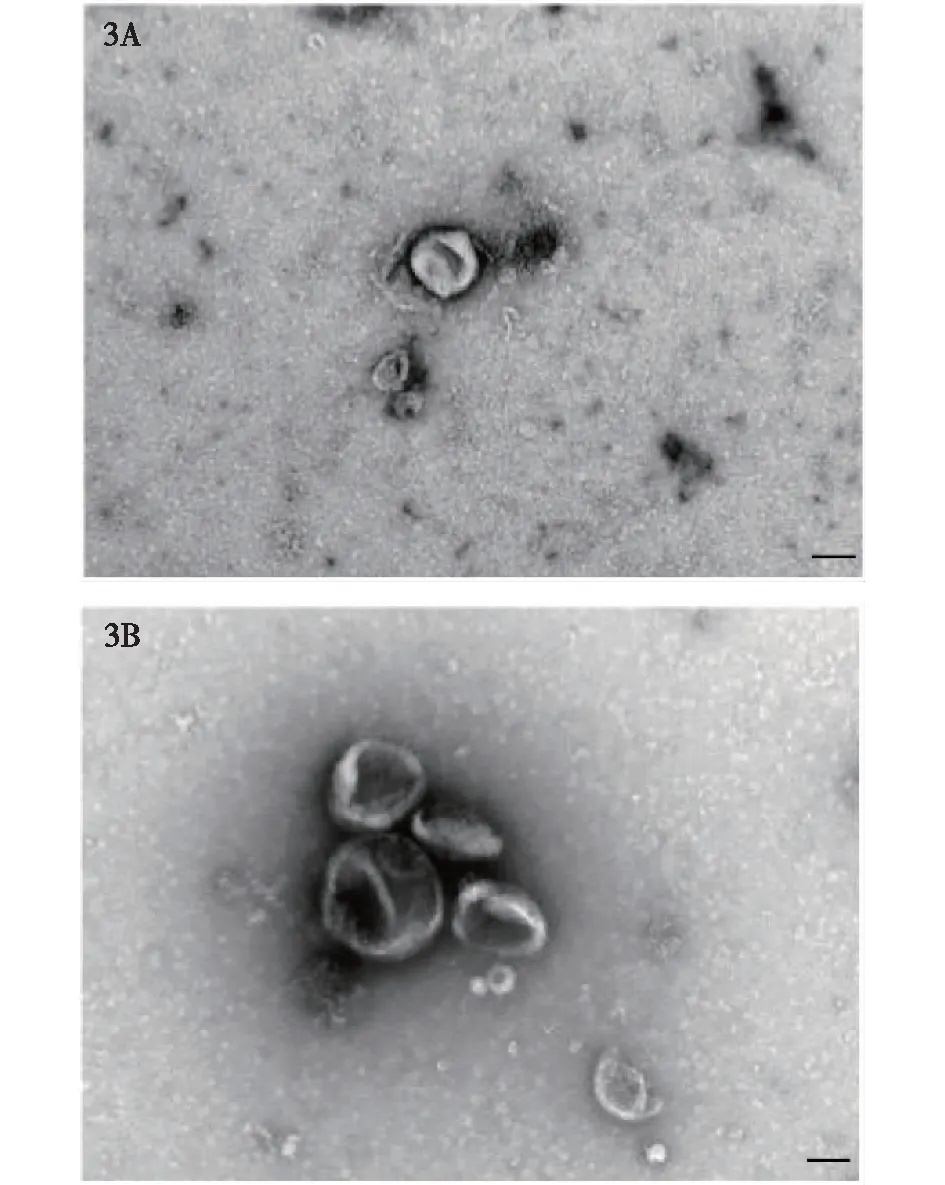
图3 透射电子显微镜下外泌体的形态 NFs(3A)和CAFs(3B)的外泌体形态都呈球形膜状结构,比例尺为100 nm
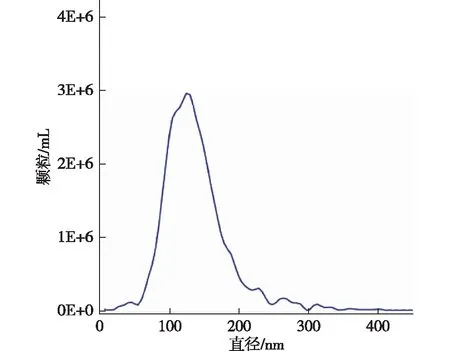
图4 纳米颗粒跟踪分析外泌体的直径
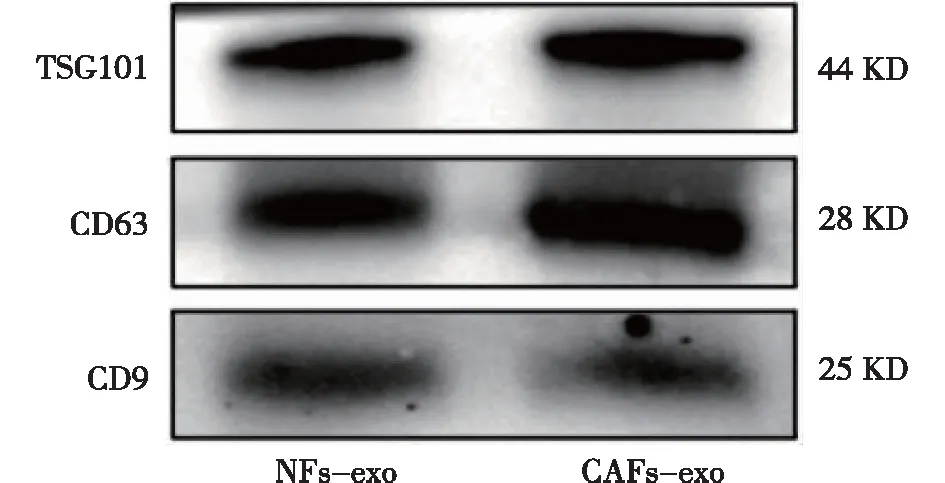
图5 Western blot检测NFs和CAFs外泌体的表面标志蛋白 NFs和CAFs的外泌体均表达TSG101、CD63和CD9标志蛋白
2.3 CAFs-exo抑制Erastin诱导的铁死亡
用铁死亡诱导剂Erastin分别处理前列腺癌细胞22rv1和PC-3,相比于未处理的对照组癌细胞,均呈现铁死亡特征改变,ROS水平升高(P<0.001)、细胞死亡数目增加(P<0.001),线粒体膜电位下降(P<0.001)(图6)。分别予CAFs-exo和NFs-exo共培养处理细胞, NFs-exo组相较于 Erastin组,ROS水平、细胞死亡率以及线粒体膜电位,差异均无统计学意义(P>0.05);而CAFs-exo组相较于 Erastin组和NFs-exo组,ROS水平下降(P<0.001),细胞死亡率下降(P<0.001),膜电位水平升高(P<0.01)(图6)。
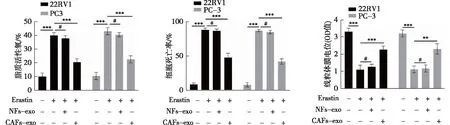
注: **为P<0.01;***P<0.001,#为P>0.05
Western blot显示, NFs-exo组相较于Erastin组,NRF2、ACSL4和GPX4蛋白表达水平差异无统计学意义(P>0.05);而CAFs-exo组相较于 Erastin组和NFs-exo组,NRF2表达水平降低(P<0.05),ACSL4表达水平降低(P<0.01),GPX4表达水平升高(P<0.01)(图7)。

注:*为 P<0.05,**为 P<0.01,#为P>0.05
2.4 CAFs-exo抑制铁死亡促进细胞增殖和迁移
Transwell实验示,以Erastin组为参照,加入CAFs-exo、NFs-exo共培养后,NFs-exo组相较于Erastin组,前列腺癌细胞22rv1和PC-3的迁移、侵袭以及克隆形成数,差异无统计学意义(P>0.05)(图8~10)。CAFs-exo组相较于Erastin组和NFs-exo组,可促进前列腺癌细胞的迁移(P<0.001)和侵袭(P<0.001)(图8),细胞迁移能力增加(P<0.01)(图9),细胞克隆形成数增加(P<0.01)(图10)。

注:比例尺为100 μm;**为P<0.01,***为 P<0.001,#为P>0.05
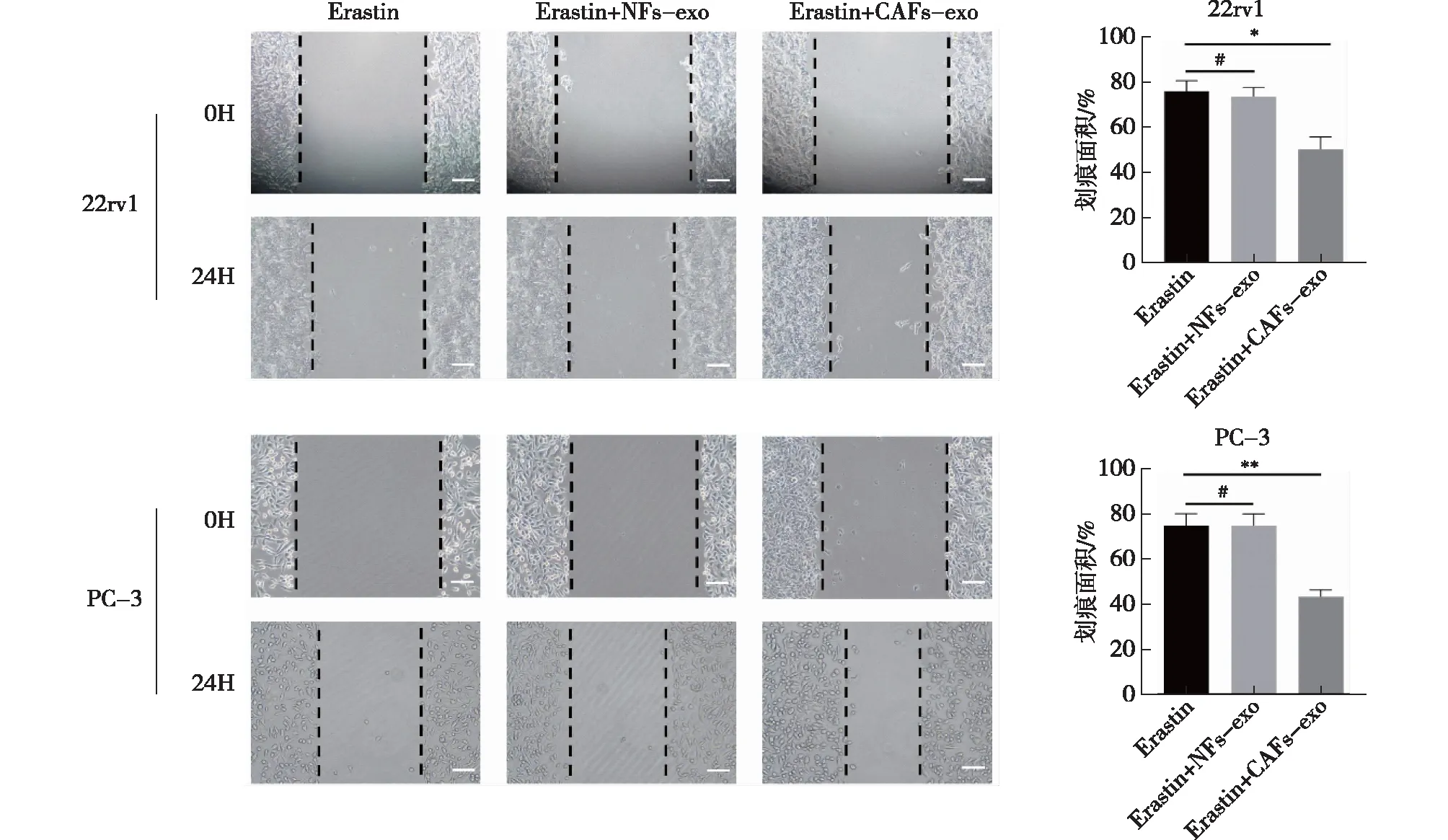
注:比例尺为 100 μm;*为 P<0.05,**为 P<0.01,#为P>0.05
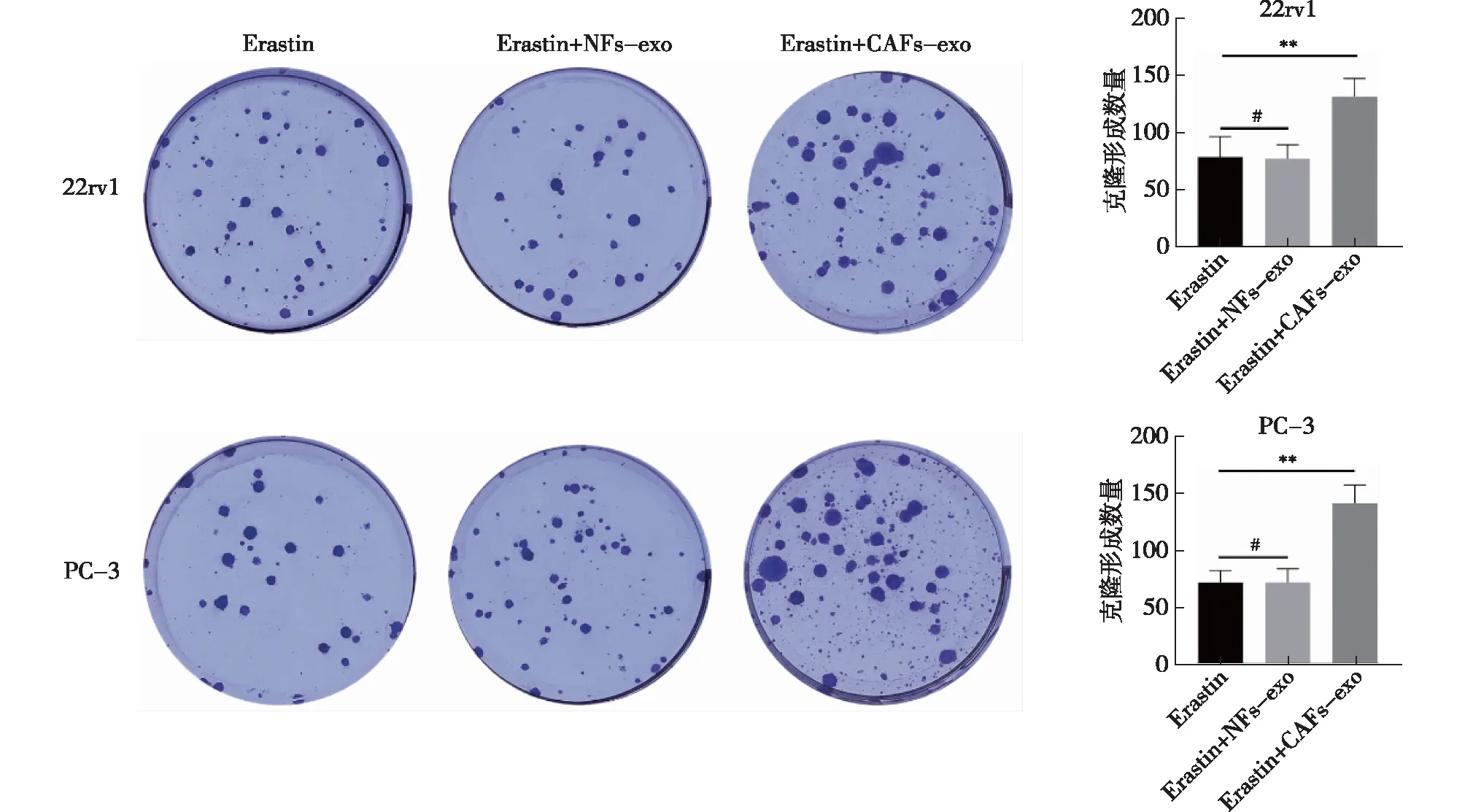
注:**P<0.01;#为P>0.05
2.5 CAFs-exo抑制铁死亡促进上皮间质转化
用CAFs-exo和NFs-exo分别处理前列腺癌细胞细胞22rv1和PC-3,CAFs-exo组EMT转化增强,呈现E-cadherin表达水平下降(P<0.01),N-cadherin表达水平增高(P<0.001)、β-catenin表达水平增高(P<0.05)和Vimentin表达水平增高(P<0.001),而NFs-exo组蛋白水平变化,差异无统计学意义(P>0.05)(图11)。
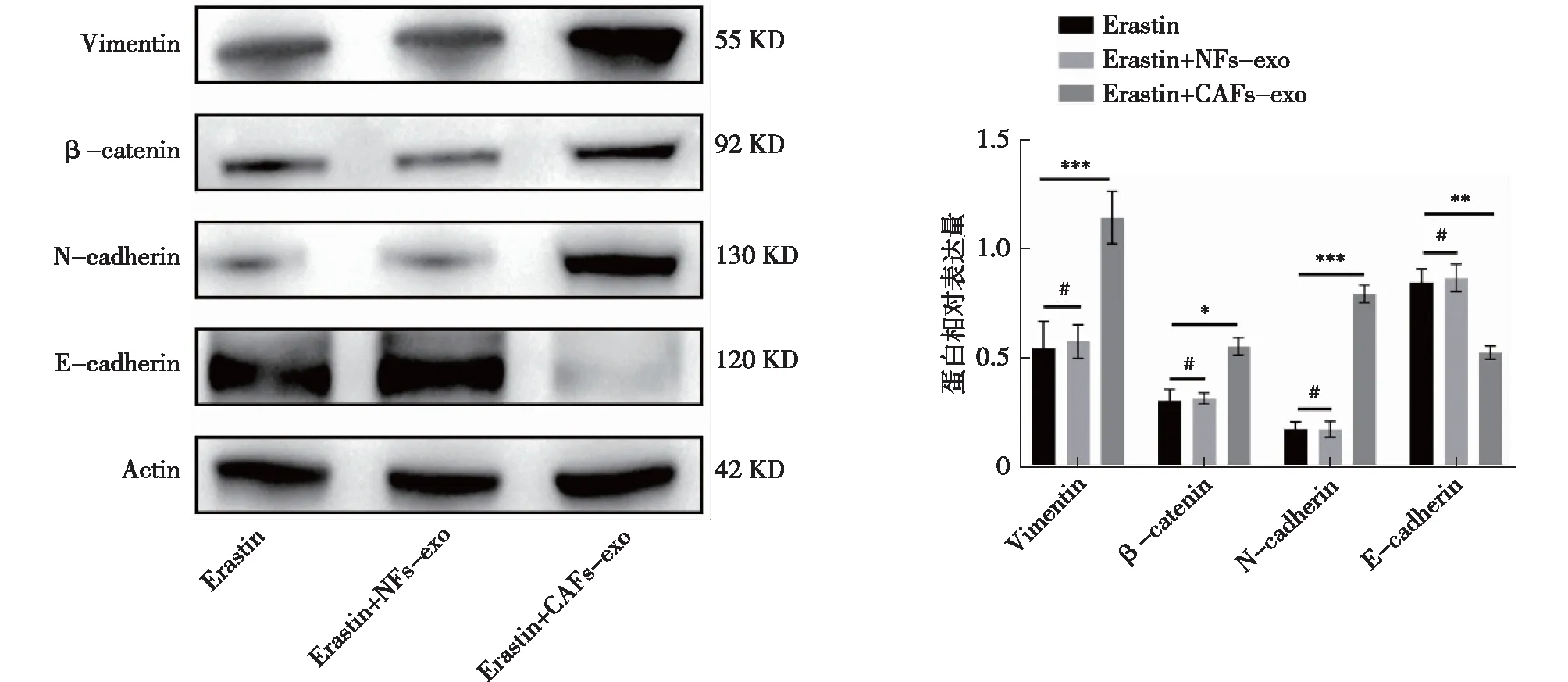
注:*P<0.05,**P<0.01,***P<0.001,#为P>0.05
3 讨论
铁死亡是铁依赖可调节性细胞死亡模式,机制特征和细胞凋亡不同。GPX4是谷胱甘肽合成酶的关键酶,可通过减少脂质过氧化负调控肿瘤细胞铁死亡,发挥促癌作用。最近的研究表明,铁死亡与前列腺癌病因机制有关,microRNA-214-3p、microRNA-324-3p等一些小分子miRNA被证实可靶向调控GPX4诱发前列腺癌细胞铁死亡发挥抗癌作用[4,7],已成为前列腺癌治疗的一种可行方案。
CAFs是肿瘤微环境中最重要的基质细胞,可通过传递核酸、蛋白质等信号分子调控肿瘤发生和进展。文献报道,CAFs来源的外泌体可增加Snail表达促进胰腺癌细胞增殖并诱导吉西他滨耐药[8];在结肠癌中,CAFs外泌体可增强癌细胞干性和上皮-间质转化促进结肠癌细胞的转移和化疗耐药[9]。对前列腺癌的研究表明,CAFs外泌体miR-423-5p可通过调控TGF-β信号通路靶向GREM2促进前列腺癌化疗耐药[10],但CAFs外泌体对前列腺癌铁死亡的影响及与GPX4高表达的关联性还未可知。
本研究成功分离并原代培养癌组织CAFs和癌旁基质NFs,经免疫荧光实验和Western blot证实CAFs较NFs高表达α-SMA、FAP和FSP-1特征蛋白;通过超高速离心法分别提取出CAFs-exo和NFs-exo,再分别将CAFs-exo、NFs-exo和Erastin诱导后的22rv1和PC-3细胞共培养。研究发现,Erastin可诱导22rv1和PC-3细胞出现铁死亡的特征,表现为细胞内ROS累积、细胞死亡数量增加以及线粒体膜电位的下降。经CAFs-exo共培养处理后,CAFs-exo呈现出显著抑制Erastin导致的细胞内脂质ROS累积并部分逆转线粒体膜电位水平的作用,同时细胞死亡率明显减少;Western blot发现铁死亡调控蛋白GPX4表达增高而NRF2、ACSL4水平下调,显示源于CAFs的外泌体可通过调控铁死亡机制发挥促进癌细胞增值的作用,该作用也显现出22rv1和PC-3细胞迁移以及侵袭能力的增强。本研究结果证实CAFs来源的外泌体确实可通过抑制细胞铁死亡的机制在前列腺癌疾病进展中发挥调控作用,而NFs-exo对此无明显影响。
Wnt/β-catenin信号通路是促进肿瘤上皮-间质转化进而促进肿瘤进展的主要原因,在多种恶性实体瘤中被发现有异常激活。研究表明,LncRNA GHET1可调节AKT/mTOR和Wnt/β-catenin信号通路促进宫颈癌临床进展[11]。在前列腺癌中,SIRT3可通过Wnt/β-catenin信号通路调控前列腺癌细胞侵袭和转移[12]。本研究发现CAFs来源的外泌体与Erastin诱导后的22rv1细胞共培养,以Erastin为对照,22rv1细胞呈现E-cadherin表达水平下调而N-cadherin、β-catenin、Vimentin水平上调的现象,NFs外泌体对此无显著影响。E-cadherin水平的下调显著增加癌细胞侵袭能力[13],表明CAFs-exo可通过抑制铁死亡机制促进前列腺癌细胞增强EMT及转移能力。
综上所述,本研究初步证实CAFs分泌的外泌体可通过抑制铁死亡促进前列腺癌细胞增殖、迁移和上皮-间质转化,是前列腺癌进展的重要调控机制。但具体是何种外泌体通过何种物质发挥调控作用需进一步分子测序和功能研究。

