新辅助免疫化疗联合手术治疗局部晚期食管鳞癌患者病理学完全缓解预测模型
杨亚蓝,宗上纲,王峰
(1.郑州大学第一附属医院 肿瘤科,河南 郑州 450000;2.河南省医学科学院,河南 郑州 450000)
食管癌是常见的消化道恶性肿瘤之一,其发病率和病死率较高[1]。食管鳞状细胞癌(esophageal squamous cell carcinoma,ESCC)是中国食管癌最常见的病理类型。对于局部晚期食管癌患者,手术仍是目前治疗的主要手段,但接受单纯手术治疗患者的长期生存并不理想,5 a生存率仅25%[2]。目前证据表明,新辅助放化疗联合手术治疗可以延长局部晚期食管癌患者的总体生存期,其在ESCC患者中的治疗作用仍有待深入研究[3]。随着免疫治疗时代的到来,免疫治疗联合化疗已成为晚期ESCC一线治疗的新标准[4-5],免疫药物加入局部晚期ESCC新辅助治疗梯队备受关注。目前,新辅助免疫化疗(neoadjuvant immunochemotherapy,nICT)仅在临床研究中被推荐用于局部晚期ESCC患者,可观察到其安全性和临床获益[6-8]。病理学完全缓解(pathologic complete response,pCR)被认为是反映新辅助治疗疗效的重要指标,与术后生存相关。目前尚缺乏预测局部晚期ESCC患者nICT后pCR的可靠指标,进一步探索pCR相关指标对个性化预测局部晚期ESCC患者nICT疗效具有重要意义。
炎症是肿瘤微环境的重要特征,其可以反映肿瘤的免疫状态,且与不良预后有关。研究表明,淋巴细胞[9]、中性粒细胞与淋巴细胞比(neutrophil to lymphocyte ratio,NLR)[10-11]、血小板与淋巴细胞比(platelet to lymphocyte ratio,PLR)、系统免疫炎症指数(systemic immune-inflammation index,SII)[12]和淋巴细胞与单核细胞比(lymphocyte to monocyte ratio,LMR)[13]等已被报道与食管癌新辅助治疗的pCR和预后相关。此外,预后营养指数(prognostic nutritional index,PNI)作为一种简单、易行的营养检测指标也被广泛运用于临床,且被证实与多种恶性肿瘤预后相关[14]。目前这些炎症和营养指标在ESCC患者治疗中的指导意义尚未明确。本研究回顾性分析炎症和营养指标及临床病理特征与接受nICT的局部晚期ESCC患者疗效的相关性,并据此建立一种新的列线图模型,以准确有效地预测局部晚期ESCC患者nICT的pCR,并为治疗方式的合理选择提供参考。
1 对象与方法
1.1 研究对象回顾性分析2020年2月至2022年4月在郑州大学第一附属医院接受nICT后接受根治性手术的局部晚期ESCC患者。纳入标准:术前病理检查诊断为ESCC;基于计算机断层扫描和超声内镜证实临床分期为Ⅱ~ⅣA期(可切除的局部ESCC);nICT后,经根治性手术实现肿瘤完全切除;年龄≤80岁,一般情况良好,心、肺等器官功能正常;医疗和随访记录完整。排除标准:感染、自身免疫性疾病或血液系统疾病;同期或既往患恶性肿瘤;因严重不良事件而无法接受免疫治疗。本研究共纳入符合标准的局部晚期ESCC患者131例。
1.2 方法
1.2.1炎症和营养指标计算方法 收集所有患者nICT前1周内空腹采集外周静脉血的血小板、中性粒细胞、淋巴细胞、单核细胞计数和血清白蛋白。根据之前发表的研究,系统免疫炎症指数等于中性粒细胞计数乘以血小板计数除以淋巴细胞计数[12],预后营养指数等于血清白蛋白值加5乘以外周血淋巴细胞计数[14]。
1.2.2治疗方法 患者每3周接受注射用卡瑞利珠单抗(江苏恒瑞医药股份有限公司,国药准字S20190027)联合新辅助化疗。在每周期第1天静脉滴注卡瑞利珠单抗200 mg(对基线期体重<50 kg的受试者,每次3 mg·kg-1)。新辅助化疗有2种方案:多西他赛联合奈达铂;紫杉醇联合顺铂或奈达铂。经过2周期的nICT后,行食管癌切除术(腹腔镜胸腔镜McKeown术)。
1.2.3临床病理资料 收集初诊时患者的性别、年龄、合并症、临床分期、肿瘤位置、肿瘤分化程度、血清肿瘤标志物癌胚抗原(carcinoembryonic antigen,CEA)、糖类抗原125(carbohydrate antigen 125,CA125)、糖类抗原199(carbohydrate antigen 199,CA199)、糖类抗原724(carbohydrate antigen 724,CA724)以及患者术后病理资料。手术切除组织标本的病理检验由医院2名以上病理学老师独立评估。肿瘤退缩分级基于美国病理学家学会的标准[15]。肿瘤分期基于美国癌症联合委员会TNM分期系统[16]。
1.2.4结局及随访 主要临床终点为原发肿瘤的病理反应。切除肿瘤标本无残留,肿瘤细胞和淋巴结转移,即肿瘤退缩分级为0的患者被认为达到了pCR。所有患者治疗后均接受随访,医院定期检查包括常规体检、肿瘤标志物和胸部CT检查。最后一次随访完成于2022年7月。
1.3 统计学方法采用R软件(4.2.0版本)和IBM SPSS 26.0统计软件处理数据。计数资料采用χ2检验,计量资料采用t检验,通过受试者工作特征(receiver operating characteristic curve,ROC)曲线确定血液学指标的最佳临界值。利用R语言“glmnet”包进行最小绝对收缩和选择算子(least absolute shrinkage and selection operator ,LASSO)回归,以避免共线性。应用单因素和多因素逐步向前logistic回归分析pCR的预测因子并建立列线图。绘制校准曲线评估预测模型与实际结果的一致性,采用ROC曲线下面积(area under curve,AUC)和决策曲线分析(decision curve analysis,DCA)评估预测模型的区分度和临床有效性。P<0.05为差异有统计学意义。
2 结果
2.1 临床特征共有131例局部晚期ESCC患者经nICT后接受手术切除术。pCR组33例,非pCR组98例。两组患者的临床TNM分期比较,差异有统计学意义(P<0.05),其他一般资料比较,差异无统计学意义(P>0.05)。见表1。
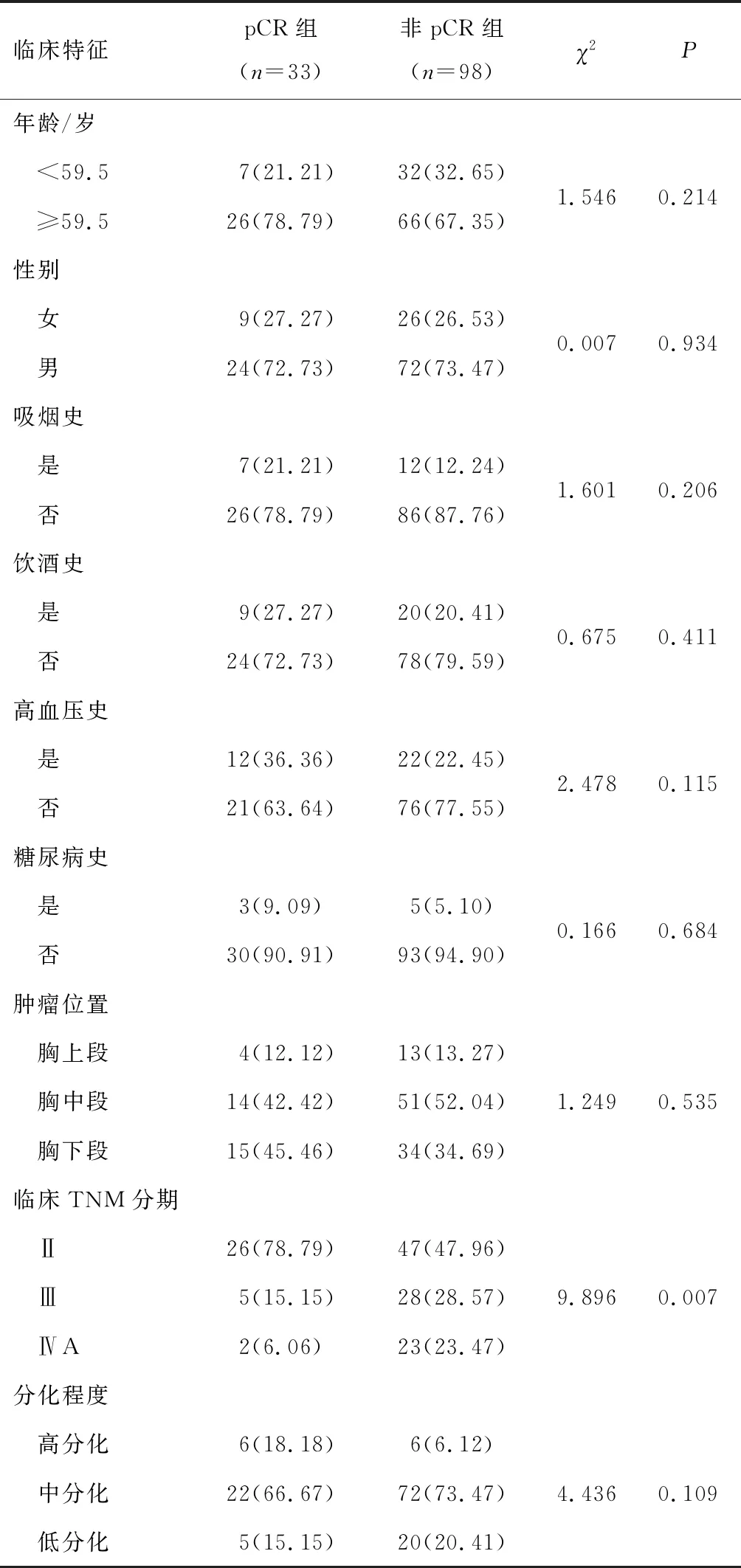
表1 131例局部晚期食管鳞状细胞癌患者临床特征[n(%)]
2.2 基于病理学缓解程度分组评估血液学指标并筛选关键指标pCR组和非pCR组患者中性粒细胞计数、淋巴细胞计数、单核细胞计数、PNI、LMR、CA125、CA199、CEA比较,差异有统计学意义(P<0.05)。见表2。相关性热图显示部分血液学指标及临床特征之间存在相关性(图1A)。为避免共线性,通过LASSO回归确定将14个关键特征纳入后续分析(图1B、1C)。单因素logistic回归分析表明,临床TNM分期、中性粒细胞、淋巴细胞、单核细胞、LMR、CA125、CA199、CEA是pCR的影响因素(P<0.05)。多因素逐步向前分析纳入P<0.100的因素,结果显示临床TNM分期、LMR、PNI和CEA是nICT治疗局部晚期ESCC患者pCR的独立预测因子(P<0.05)。见表3。

表2 pCR组和非pCR组患者炎症和营养、肿瘤标志物指标的比较[n(%)]
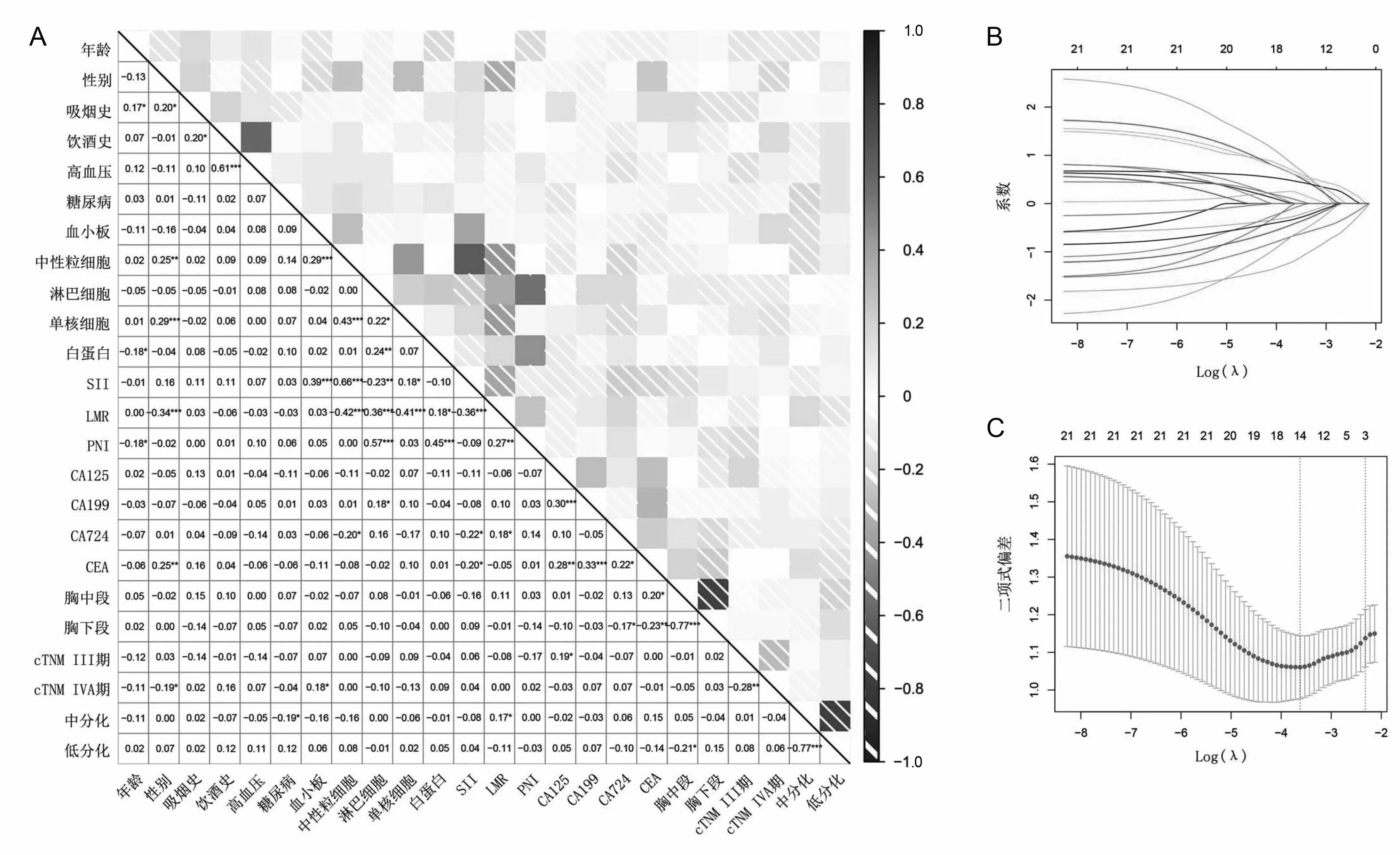
A为相关性图;B为LASSO系数分布图;C为十倍交叉验证。
2.3 pCR预测模型的建立及评价根据多因素筛选结果建立预测模型,并以可视化列线图展示(图2A)。Calibration 校正曲线显示列线图的预测概率与实际概率一致性良好(图2B)。ROC曲线分析表明AUC值为0.81,模型的区分度较高(图2C)。DCA曲线显示,该列线图可使患者在临床实践中获益(图2D)。

A为列线图模型;B为Calibration校正曲线;C为ROC曲线;D为DCA曲线。
3 讨论
目前,手术治疗仍是局部晚期食管癌患者的主要治疗手段,nICT仅在临床研究中被推荐[2,17]。相关报道显示,nICT联合化疗与新辅助同步放化疗疗效相当,并可观察到其安全性和高pCR率[6-8]。基于此,本研究立足寻找简单、经济、可靠的指标,以预测局部晚期ESCC患者经nICT治疗后达到pCR的概率,这对指导局部晚期ESCC的个性化治疗具有重要意义。
既往食管癌新辅助放化疗研究中发现,治疗前NLR被认为是pCR的不利影响因素[10],PLR、SII则被证明与不良预后有关[12],治疗后淋巴细胞减少[9]及治疗前NLR[11]是pCR的不利因素,而治疗后较高的白蛋白则有利于达到pCR[18]。这些证据表明,炎症水平和营养状态与食管癌新辅助治疗的疗效和预后有关。基于上述研究结果,这些标志物有希望成为局部晚期ESCC患者接受nICT反应的预测因素。本文主要研究了SII、LMR、PNI、常见血常规参数及肿瘤标志物对局部晚期ESCC患者nICT的临床价值。本研究结果显示,pCR组观察到较高水平的淋巴细胞计数、中性粒细胞计数、单核细胞计数及较低水平的LMR。淋巴细胞是肿瘤特异性免疫反应的重要成分,具有肿瘤特异性和杀伤性,较高水平的淋巴细胞可能有利于免疫调节并发挥抗肿瘤杀伤作用[9]。中性粒细胞具有很强的异质性,其不仅可以通过产生活性氧、活性氮发挥细胞毒性杀伤肿瘤细胞,也可通过诱导DNA氧化损伤和遗传不稳定性、促上皮间充质转化、促血管新生、产生中性粒细胞外诱捕网等途径导致肿瘤的进展和转移[19]。既往研究表明,外周血NLR与食管癌不良预后相关,但中性粒细胞与局部晚期食管癌nICT后疗效的关系鲜有报道[19]。单核细胞作为先天免疫细胞具有吞噬、清除损伤和衰老细胞以及免疫反应和抗原呈递的功能,这或许在一定程度上有益于免疫治疗发挥作用[20]。
多因素分析结果表明临床TNM分期、LMR、PNI和CEA是nICT治疗局部晚期ESCC患者pCR的独立预测因子。目前,探究局部晚期ESCC患者nICT后pCR的预测因素的研究较少。本研究构建的预测模型较另一项研究[21]更简洁,且预测能力更好。一项接受免疫联合化疗的小样本食管癌队列研究[22]仅探讨基线和不同治疗周期后炎症指标对治疗反应的区分度,并未构建合适的预测模型以指导临床。此外,另一项研究结果[13]表明分化程度高、临床分期低与较高的pCR率相关,进一步证实了本研究的猜想。但在其研究中较高的LMR有利于达到pCR,这与本文得到的结果矛盾。此外,本研究构建的模型纳入营养指标PNI。高PNI为预测pCR的独立有利因素,这提示肿瘤患者的营养情况与治疗效果有关,适当的营养支持治疗对治疗期的肿瘤患者意义重大。肿瘤标志物包括CA125[23]、CEA和CA199[24]已被报道与食管癌的不良预后有关。在达到pCR的患者可观察到低水平的CA125、CA199、CEA。多因素分析结果也显示CEA较高不利于达到pCR,治疗前高水平的肿瘤标志物与局部晚期ESCC患者nICT治疗效果较差可能有关。
此外,本研究还存在一定的局限性。作为单中心回顾性研究,缺乏外部验证且病例数较少,这些因素会导致一定程度的偏倚,并且限制预测模型的适用性。此外,关于这些炎症和营养指数的基本生物学和免疫机制尚未完全阐明,这在一定程度上解释了从不同研究中得出的有争议的结果。尽管存在上述局限性,该预测模型在一定程度上可以对局部晚期ESCC患者接受nICT的疗效分层,为局部晚期ESCC患者治疗方式的合理选择提供参考。

