PLR、GP88、PGK-1对腹腔镜根治性前列腺癌切除术患者预后的预测效能*
关 锐,韩宝帅,李 慧
陕西省汉中市人民医院:1.检验科;2.泌尿外科;3.输血科,陕西汉中 723000
前列腺癌属于男性泌尿系统常见恶性肿瘤之一,具有发病率及病死率较高的特点,严重威胁男性生命健康[1]。根治性前列腺癌切除术是目前国内外公认的最有效的治疗局限性前列腺癌的方法,随着微创技术的发展,腹腔镜根治性前列腺癌切除术(LRP)成为局限性前列腺癌患者的首选方案[2]。然而,因盆腔结构复杂,手术完全切除病灶的难度大,患者术后易出现肿瘤残留或复发,继而对患者预后产生影响。因此,需及时评估行LRP患者的预后情况。目前,临床上主要是通过血清前列腺癌特异性抗原(PSA)预测患者术后预后,但该指标受多种因素的影响,单独用于评估患者预后效果并不十分理想[3]。故此,寻找特异度和灵敏度高的血清学生物标志物进行LRP预后预测有助于及时治疗,改善患者预后。血小板/淋巴细胞比值(PLR)是近年来广泛应用于临床的反映机体炎症及免疫状态的重要指标之一,具有预测恶性肿瘤患者预后转归的作用[4]。血清颗粒蛋白88(GP88)是一种和恶性肿瘤发生、发展及预后有关的肿瘤相关性蛋白之一,已有研究证实其在恶性淋巴瘤患者中存在异常升高,并和患者治疗后预后有关[5]。磷酸甘油酸激酶1(PGK-1)属于糖酵解通路关键酶之一,可通过促进1,3-二磷酸甘油酸朝3-磷酸甘油酸方向转变,从而调控脱氧核糖核酸复制及损伤修复等过程,在多种恶性肿瘤组织中均存在异常表达,且和肿瘤发生、发展及预后密切相关[6],但其与LRP患者预后的关系研究报道较少。鉴于此,本文通过研究PLR、血清GP88、PGK-1对LRP患者预后的预测效能,旨在为LRP患者预后评估提供参考依据,现将结果报道如下。
1 资料与方法
1.1一般资料 选取2018年2月至2020年2月在本院接受LRP治疗的93例前列腺癌患者作为研究对象。纳入标准:(1)经病理活检确诊,且符合《中国前列腺癌早期诊断专家共识》[7]相关诊断标准;(2)成年男性;(3)接受LRP治疗;(4)临床资料完整;(5)前列腺癌TNM分期(2017 AJCC 第八版)为T1~T3。排除标准:(1)术前接受过放、化疗等治疗;(2)患有心血管疾病、肺功能不良等显著增加手术危险性的疾病;(3)预期寿命<10年;(4)患有严重出血倾向或血液凝固性疾病;(5)合并系统性炎症疾病或其他恶性肿瘤;(6)研究期间因故退出或随访失访。本研究经本院伦理委员会审核并批准,且所有患者均签署知情同意书。
1.2方法 (1)收集患者临床资料:包括年龄、体质量指数(BMI)、吸烟、饮酒、肿瘤最大径、Gleason评分、临床T分期、血清PSA水平、肿瘤侵犯精囊及切缘阳性情况。(2)样本采集:所有患者于术前1 d及术后7 d抽取空腹静脉血4 mL,离心处理(离心半径为10 cm,离心时长10 min,离心速度3 000 r/min)后,获取上层血清置于-80 ℃冰箱中待测。(3)PLR及血清GP88、PGK-1水平检测:通过7060型全自动生化分析仪(日本日立公司)检测患者血小板计数及淋巴细胞计数,并计算二者比值即PLR。其中血清GP88、PGK-1水平检测采用酶联免疫吸附试验,所有操作步骤严格按照试剂盒(美国罗氏生物技术公司)说明书完成。(4)采用免疫组化法确定Gleason评分[8]:前列腺癌组织被分为主要分级区和次要分级区,根据腺体分化程度,每区按5级评分(第1级1分,分化好;每递升1级增加1分;第5级5分,为未分化),Gleason评分是将主要分级区和次要分级区的评分相加,评分越高预示细胞分化程度越低,恶性程度越高,预后越差。
1.3随访 对所有患者均进行为期2年的随访,包括电话随访和门诊复查,患者术后每隔1个月进行1次电话随访,每隔3个月患者于门诊接受复查,包括磁共振扫描、PSA检查及直肠指检。复发定义:直肠指检有硬物或PSA连续2次>10 ng/mL,结合前列腺系统性穿刺活检,病理检测为阳性诊断判断为前列腺癌复发。记录随访情况,将复发及死亡记作预后不良,存活且无复发记作预后良好[9]。按照随访结局的差异将所有患者分成预后良好组及预后不良组。

2 结 果
2.1患者基线资料 接受LRP治疗的93例前列腺癌患者年龄44~88岁,平均(66.94±8.23)岁;BMI为 19~32 kg/m2,平均(22.50±2.13)kg/m2;吸烟46例,饮酒57例;Gleason评分5~10分,平均(7.65±2.01)分;肿瘤最大径2~5 cm,平均(4.12±0.21)cm;临床T分期:T1期27例,T2期21例,T3期45例。
2.2患者手术前后PLR及血清GP88、PGK-1水平比较 术后患者PLR及血清GP88、PGK-1水平均低于术前(P<0.05)。见表1。
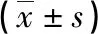
表1 患者手术前后PLR及血清GP88、PGK-1水平比较
2.3不同预后患者PLR及血清GP88、PGK-1水平比较 随访2年,无失访病例。根据随访结局,将患者分为预后良好组52例,预后不良组41例(复发38例,死亡3例)。预后不良组PLR及血清GP88、PGK-1水平均高于预后良好组(P<0.05)。见表2。
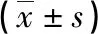
表2 不同预后患者PLR及血清GP88、PGK-1水平比较
2.4LRP患者预后的单因素分析 单因素分析发现,Gleason评分、临床T分期、血清PSA水平、肿瘤侵犯精囊、切缘阳性均和LRP患者预后有关(P<0.05);而年龄、BMI、吸烟、饮酒以及肿瘤最大径均和LRP患者预后无关(P>0.05)。见表3。
2.5LRP患者预后影响因素的多因素Logistic回归分析 将LRP患者预后作为因变量,赋值如下:预后不良=1,预后良好=0。以表3中差异有统计学意义的指标作为自变量,赋值如下:Gleason评分、血清PSA水平均为原值输入;临床T分期:T1~T2期=0,T3期=1;肿瘤侵犯精囊:无=0,有=1;切缘阳性:否=0,是=1,以此建立多因素Logistic回归模型,采用逐步后退法(α出=0.10,α入=0.05)分析结果显示,Gleason评分上升、临床T3期、血清PSA水平上升、肿瘤侵犯精囊、切缘阳性均是LRP患者预后不良的危险因素(P<0.05),见表4。

表3 LRP患者预后影响因素的单因素分析或n(%)]

表4 LRP患者预后影响因素的多因素Logistic回归分析

组别nGleason评分(分)临床T分期T1/T2T3血清PSA(ng/mL)肿瘤侵犯精囊切缘阳性预后良好组527.02±1.0533(63.46)19(36.54)17.42±3.9610(19.23)5(9.62)预后不良组418.45±1.2615(36.59)26(63.41)23.11±4.3721(51.22)16(39.02)χ2/t5.9696.6316.5723.24911.342P<0.0010.010<0.0010.001<0.001
2.6PLR及血清GP88、PGK-1对LRP患者预后不良的预测效能 以预后不良组为阳性样本,以预后良好组为阴性样本,建立ROC曲线预测分析模型,探讨PLR及血清GP88、PGK-1 3项指标单独及联合检测对LRP患者预后不良的预测效能。联合应用时建立回归预测模型:Log(P/1-P)=-0.154+0.639×PLR+0.873×血清GP88水平+0.520×血清PGK-1水平。结果显示:3项指标联合检测的曲线下面积(AUC)及灵敏度、特异度、准确度均高于各指标单独检测。见表5、图1。

表5 PLR以及血清GP88、PGK-1对LRP患者预后不良的预测效能

图1 PLR及血清GP88、PGK-1对LRP患者预后不良预测效能的ROC曲线
3 讨 论
前列腺癌属于男性常见恶性肿瘤,即使在早期接受根治性手术治疗,仍有复发的风险,导致患者预后不良[10]。LRP具有微创、并发症较少及术后恢复较快等优势,目前已在临床上得到广泛应用,治疗效果明显优于传统开放性手术,且更易被患者接受[11]。然而,LRP患者术后极易出现切缘阳性,继而发生周围组织浸润或(和)远处转移,进一步对患者预后造成负面影响[12]。因此,有效预测LRP患者预后转归具有积极的意义。
PLR是被临床广泛应用的炎症指标,具有获取简单、无须侵入性操作的优点,有研究证实,PLR有作为前列腺癌筛查指标的价值,且与前列腺癌病理特征相关[13]。GP88是一种是一种相对分子质量为88×103糖蛋白生长因子,目前已被证实其在多种肿瘤的发生、发展过程中具有重要的生物学效应,有研究发现GP88在前列腺癌组织中呈阳性表达[14]。PKG1是糖酵解的关键酶,可介导癌细胞增殖和迁移,有证据表明PKG1与前列腺癌的骨转移密切相关[15]。故研究PLR、GP88、PGK-1和LRP患者预后的关系有望为LRP患者预后评估提供新的靶点与思路。
本文结果发现,93例患者术后PLR及血清GP88、PGK-1水平均低于术前。考虑可能和手术切除肿瘤病灶有关。此外,预后不良组PLR及血清GP88、PGK-1水平均高于预后良好组,差异有统计学意义(P<0.05),提示随着上述3项指标水平的升高,LRP患者预后越差。本研究的多因素Logistic回归预测模型也进一步证明了此发现。考虑PLR是由血小板及淋巴细胞计算而来的一项炎症指标,PLR的升高反映了血小板所依赖的促肿瘤反应加强,同时淋巴细胞参与的抗肿瘤免疫反应减弱,最终对患者预后产生不利影响[16]。同时,PLR水平的升高反映了血小板/淋巴细胞比值的平衡被打破,继而刺激大量血管内皮生长因子、活性氧及炎症细胞因子的生成,进一步抑制T淋巴细胞功能及自然杀伤细胞功能,促进免疫抑制环境的建立,最终导致肿瘤细胞的转移及复发,影响预后[17]。GP88可通过对蛋白激酶B及丝裂原活化蛋白激酶表达进行调控,继而影响肿瘤细胞锚定、迁移及侵袭。有报道指出,对GP88表达进行抑制后,肿瘤细胞体外迁移、侵袭及自主生长能力显著减弱,说明GP88表达上升,肿瘤细胞侵袭及转移能力可能增强,进一步参与前列腺癌的发生、发展,增加临床治疗难度,最终导致预后不良[14]。PGK-1可通过影响CXC趋化因子配体12(CXCL12)-CXCR4信号通路,进一步调控基质金属蛋白酶-2及基质金属蛋白酶-3的表达,间接参与了肿瘤血管的生成,引起前列腺癌细胞的侵袭及转移,导致预后不良[18]。同时,PGK1属于胞内蛋白之一,可通过催化1,3-DPG转变成3-DPG,继而产生一个分支的腺苷三磷酸,且其表达受氧张力的影响,随着表达的增加反映了肿瘤的厌氧生长性更强,增殖、分化速度更快[19]。
此外,经单因素分析发现,Gleason评分、临床T分期、血清PSA水平、肿瘤侵犯精囊、切缘阳性均和LRP患者预后有关。经多因素Logistic回归分析发现,Gleason评分上升、临床T3期、血清PSA水平上升、肿瘤侵犯精囊、切缘阳性均是LRP患者预后不良的危险因素,结果与既往研究相符[20]。
ROC曲线分析结果显示,PLR及血清GP88、PGK-1预测LRP患者预后不良的AUC均超过0.7,3项指标联合检测的AUC达0.861,提示上述指标预测LRP患者预后不良的效能较好,且3项指标联合检测效能更佳,其中3项指标联合检测的灵敏度和特异度分别为0.878、0.846,表明3项指标联合有潜力成为预测LRP患者预后不良的新指标。其中PSA水平作为LRP患者预后不良的标准观察指标之一,其表达水平受多种因素的影响,可能导致其预测结果出现不准确、敏感性低等问题,使其预测价值有限[21]。
综上所述,PLR及血清GP88、PGK-1水平上升和LRP患者预后不良有密切的关系,检测上述3项指标有助于评估患者预后。

