批分析(多管同测)法检测低浓度新型冠状病毒核酸*
雷 震,斯志娟
南昌大学附属感染病医院/南昌市第九医院:1.输血科;2.检验科,江西南昌 330002
实时荧光聚合酶链反应(PCR)用于感染性疾病的诊断(病原体检测)具有快速、简便、准确、高通量等优势。近年来,核酸检测相关产业链的各个环节更是迅猛发展,但假阴性问题也一直困扰着疫情防控各方面。临床意义上的假阴性是指患者的临床症状及影像学证据高度疑似新型冠状病毒(SARS-CoV-2)感染疾病,而SARS-CoV-2核酸检测多次或始终为阴性[1]。引起假阴性的原因较多,包括试剂、检测、采样、储存运送、疾病病程阶段及病毒变异等因素,导致样本中无病毒或病毒载量低于试剂的检测下限[1-6]。实时荧光PCR具有较高的检测灵敏度[7],只需1 copy靶序列进入实时荧光PCR扩增体系,经过若干次循环扩增后,就能检测到靶核酸扩增信息。因此,决定检测下限的因素只有进入实时荧光PCR扩增体系的实际样本量。笔者采用批分析(多管同测)的方法增加实际进入扩增体系的样本量,以提高检测灵敏度及低浓度样本的检出率。现将结果报道如下。
1 材料与方法
1.1样本来源 SARS-CoV-2全基因组假病毒质控品(广州市赛腾医疗科技有限公司产品,批号:20210901),水平3(L2),阳性。该产品以假病毒为载体,覆盖经过修饰优化后的SARS-CoV-2靶标基因,包括ORF1ab基因、N基因、E基因和S基因等。
1.2仪器与试剂 SLAN-96S全自动医用PCR分析系统(上海宏石医疗科技有限公司产品);SARS-CoV-2核酸实时荧光PCR检测试剂盒(圣湘生物科技股份有限公司产品,批号:2021155),靶区域为SARS-CoV-2 ORF1ab及编码核衣壳蛋白N基因的特异性保守序列;样本释放剂(圣湘生物科技股份有限公司产品,批号:2021004-2);细胞保存液(圣湘生物科技股份有限公司产品,批号:12021003)。
1.3方法
1.3.1系列梯度浓度样本盘的选择 用细胞保存液将质控品稀释为1︰10、1︰100、1︰1 000梯度浓度样本,用SARS-CoV-2核酸实时荧光PCR检测试剂(样本释放剂裂解法释放核酸,一步法)检测梯度浓度样本,各平行检测3管;然后选择3管均阳性的1︰10浓度样本,倍比稀释形成系列梯度浓度样本盘S1(1︰10)、S2(1︰20)、S3(1︰40)、S4(1︰80)、S5(1︰160)、S6(1︰320)、S7(1︰640)。
1.3.2批分析(多管同测)法检测 用SARS-CoV-2核酸实时荧光PCR检测试剂(样本释放剂裂解法释放核酸,一步法)检测梯度浓度样本盘样本S1~S7共7个浓度,每批各浓度平行检测6管,共检测6批次。最终每个浓度得到6个批分析结果,36个单管检测结果。
1.3.3阳性判断标准 单管:ORF1ab基因检测到典型的S型扩增曲线,且Ct值<40判断为ORF1ab基因阳性;N基因检测到典型的S型扩增曲线,且Ct值<40判断为N基因阳性。批分析:单靶标基因阳性管数≥1的批次判断为该靶标基因批阳性。
1.3.4SARS-CoV-2核酸实时荧光PCR检测试剂基本信息 SARS-CoV-2核酸实时荧光PCR检测试剂扩增循环参数见表1。样本释放剂10 μL加样本10 μL,用移液器吸打3-~5次混匀,静置10 min后,加入PCR混合液(SARS-CoV-2-PCR-反应液26 μL加SARS-CoV-2-PCR-酶混合液4 μL)上机扩增。检测通道:FAM(ORF1ab区域)、ROX(N基因);HEX(内标)。

表1 SARS-CoV-2核酸实时荧光PCR检测试剂扩增循环参数

2 结 果
2.1不同浓度ORF1ab基因与N基因Ct值比较 各浓度有Ct值(有光滑的S型扩增曲线,Ct值<45)管Ct值均值见表2;各浓度有Ct值管Ct值均值折线图见图1;所有测定管中有Ct值管Ct值折线图见图2。ORF1ab基因与N基因在低浓度水平(1 copy/管)Ct值存在较大差异,S2~S7全部批次中呈典型“S”型扩增曲线的检测管ORF1ab基因平均Ct值为40.4±10.6,Ct值>40的占61.64%,最大Ct值为44.08,而N基因平均Ct值为36.96±1.07,最大Ct值为39.48。不同浓度ORF1ab基因与N基因Ct值比较,差异均有统计学意义(P<0.05)。

图2 所有测定管中有Ct值管Ct均值折线图
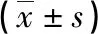
表2 不同浓度ORF1ab基因、N基因Ct值比较
2.2单管分析与批分析阳性检测情况比较 由表3~4可知,ORF1ab基因单管分析与批分析阳性检出率分别为S1(50.00%/100.00%)、S2(47.22%/100.00%)、S3(16.67%/66.67%)、S4(13.89%/66.67%);N基因单管分析与批分析阳性检出率分别为S1(100.00%/100.00%)、S2(91.67%/100.00%)、S3(61.11%/100.00%)、S4(30.56%/83.33%)、S5(27.78%/100.00%)、S6(11.11%/50.00%)、S7(5.55%/33.33%)。ORF1ab基因S1、S2、S3、S4浓度单管分析与批分析阳性检出率比较,差异有统计学意义(P<0.05),N基因S3、S4、S5、S6、S7浓度单管分析与批分析阳性检出率比较,差异有统计学意义(P<0.05)。与单管分析比较,批分析在低浓度核酸样本检测中有更高的阳性检出率。

表3 单管分析与批分析阳性检测情况(n)

批次nS4ORF1ab基因N基因S5ORF1ab基因N基因S6ORF1ab基因N基因S7ORF1ab基因N基因160301010026120302013622010000461001000156120301006603010000合计365110100402

表4 单管分析与批分析阳性检测率比校[n(%)]

批次nS4ORF1ab基因N基因S5ORF1ab基因N基因S6ORF1ab基因N基因S7ORF1ab基因N基因单管阳性365(13.89)11(30.56)0(0.00)10(27.78)0(0.00)4(11.11)0(0.00)2(5.55)批阳性64(66.67)5(83.33)0(0.00)6(100.00)0(0.00)3(50.00)0(0.00)2(33.33)χ28.5096.069011.37405.60004.605P<0.05<0.05>0.05<0.05>0.05<0.05>0.05<0.05
3 讨 论
在实时荧光PCR中,Ct值是指荧光强度大于最小检出水平(即荧光阈值)时的PCR循环数[7]。它是实时荧光PCR的基本参数,是获得准确且重现性好的数据的基础。影响Ct值的因素包括进入扩增体系靶核酸的数量和靶核酸的扩增效率,当进入扩增体系的靶核酸数量恒定时,影响Ct值的因素就只是靶核酸的扩增效率。影响扩增效率的因素较多[3],包括引物/靶核酸的特性与变性、退火、延伸温度,扩增体系环境(参与扩增反应各成分的相对量,尤其是TaqDNA聚合酶/靶核酸比例等),扩增仪器性能(包括扩增仪孔间温度的不均一性、信标荧光的检出效能等),临床标本中TaqDNA聚合酶抑制物去除不完全,扩增体系中扩增试剂的有限和扩增产物的抑制等。
有研究比较分析国产SARS-CoV-2核酸实时荧光PCR检测试剂盒检测性能发现,部分试剂检测弱阳性标本时N基因呈现单阳结果,研究者认为试剂因素可能有:(1)与引物设计有关;(2)与各位点灵敏度有关[8-9];SOLA等[10]认为可能是冠状病毒ORF1ab基因copy数相对于N基因、S基因和E基因等编码结构蛋白的基因copy数更低;多靶标同管扩增可能由于多种引物互相竞争而影响某个靶标点检测的灵敏度[1]。本研究显示,ORF1ab基因与N基因在低浓度水平(1 copy/管)阳性检出率及Ct值均存在较大差异,S2~S7全部批次中呈典型“S”型扩增曲线的有Ct值检测管ORF1ab基因平均Ct值为40.4±1.06,Ct值>40的占比为61.64%,最大Ct值为44.08,而N基因平均Ct值为36.96±1.07,最大Ct值为39.48。笔者认为:(1)ORF1ab基因的引物靶核酸的特性导致其扩增效率低于N基因;(2)仪器对ORF1ab基因的信标荧光FAM的检出效能低于N基因的信标荧光ROX。笔者在另外一组检测低浓度乙型肝炎病毒(HBV) DNA的实验中Ct值>40的占比为60%,其与ORF1ab基因都是FAM荧光信标[11]。这可能是临床单管阳性的重要原因之一。本研究的标本是假病毒质控物,ORF1ab基因与N基因分属2段序列,在低浓度时出现较多的单基因阳性。本院未保留SARS-CoV-2核酸阳性样本,无法检测临床阳性样本。在临床阳性样本中,ORF1ab基因与N基因应该有多数的并行结果。
本研究显示在低浓度区域,2种基因阳性检出率均明显高于单管分析。PCR试验中扩增产物的量以指数方式增加,只要反应管中有1 copy靶核酸,就能将其扩增至能检出的水平。因此,只需增加批分析的扩增管数就可提高PCR试验的灵敏度。本研究在现有商品检测试剂的基础上,采用批分析(多管同测)的方法,增加单批次检测时实际进入扩增体系的样本量,以提高检测灵敏度。即采用商品试剂,按试剂盒要求提取核酸模板,在扩增分析时,每个样本同时扩增多管,将整个分析批视为一个批扩增体系。如此,在不改变单管扩增体系的条件下,实际提高了进入批扩增体系的原始样本量,从而使检测灵敏度显著提高。圣湘生物可提供磁珠法和样本释放剂法2种核酸提取方法。与磁珠法比较,采用样本释放剂法操作更简单,研究结果更容易呈现。在临床检测中,用磁珠法富集核酸后再多管批扩增分析可得到更高的灵敏度。
综上所述,批分析(多管同测)法可以提高低浓度核酸样本的阳性检出率,在临床有提高检测灵敏度需求时可以采用此方法。

