消毒剂卫可施用对猪粪污厌氧消化系统运行及微生物多样性的影响
邓觅,钟华,夏嵩,吴永明*,李荣富,金丹凤,梁培瑜
(1.江西省科学院微生物研究所,南昌 330096;2.武汉大学水利水电学院,武汉 430072;3.江西省科学院能源研究所,南昌 330096)
非洲猪瘟(African swine fever,ASF)蔓延对我国养猪行业产生巨大冲击,消毒作为一种可有效切断病原微生物传播途径和控制传染病的重要防疫手段,导致消毒剂用量激增,进而造成大量消毒剂残留于猪场粪尿并随粪尿一同流入后端废水处理系统,从而对以“微生物作用”为主体的废水处理系统产生不利影响,导致出水水质变差[1-2]。
当前猪场常用的消毒剂主要包括碱类、醛类、卤素类、酚类和氧化剂等,其主要是通过使微生物的蛋白质、酶、核酸结构发生致死性改变,使酶系统和细胞结构受损,从而抑制细胞代谢机能[1]。近些年,练植婵等[3]、吴园园[4]和张京景等[5]报道了多种残留消毒剂对厌氧发酵系统的影响,并指出过量消毒剂会抑制CH4产生且会降低COD、NH3-N 等污染物去除效果,但这些研究均未从微生物层面对这些现象进行分析。基于当前畜禽养殖粪污处理,关于微生物多样性的研究多集中于重金属和抗生素等方面[6-8],而有关高剂量残留消毒剂对厌氧发酵过程中微生物多样性变化的影响研究甚少。在非洲猪瘟尚未得到遏制的情况下,可以预见今后消毒剂在各类环境介质中将普遍存在且浓度将逐年增加,因此,本文选择一款杀菌效果明显的国际知名、且使用广泛的商品消毒剂——卫可(VirkonTM,主要成分是过硫酸氢钾)作为研究对象[9],从CH4产量[10]、COD 等理化指标[11]和微生物群落的结构及组成[12]等角度出发,探讨上述多尺度效应与微生物响应的关系,评估猪场常用消毒剂大量使用对厌氧发酵系统造成损伤的程度,揭示消毒剂对厌氧菌群间的相互作用关系,以期为指导猪场疫(病)情期间消毒剂的合理使用提供新的参考。
1 材料与方法
1.1 试验材料
厌氧消化污泥取自未受消毒剂影响的南昌某规模化养猪场厌氧发酵罐高活性污泥;新鲜猪粪取自南昌某规模化猪场育肥猪正常排泄物,未接触消毒剂。
1.2 试验设置
消毒剂浓度:基于联合国粮农组织(FAO)公布的《非洲猪瘟——发现与诊断(中文版)》、农业农村部2021 年5 月6 日发布的《非洲猪瘟疫情应急实施方案(第五版)》以及卫可生产厂家推荐的1∶200 兑水使用浓度[9,13-14],并结合消毒剂使用后经猪舍冲洗水稀释及环境滞留、降解等影响,最终选定卫可质量浓度分别为0.05%和0.5%,以探究其对厌氧消化系统的影响。每组试验设3个重复。
试验组设置:空白组为超纯水中添加接种污泥,以评价接种污泥的生物活性,记为Blank 组;对照组为新鲜猪粪添加接种污泥,记为CK组;试验组为新鲜猪粪添加接种污泥后分别添加质量浓度为0.05%和0.5%的卫可,记为L组和H组。
反应条件设置:采取一次性投料的厌氧湿式发酵方式,选择卫可消毒剂,在XT5018GP 型全自动甲烷潜力测试系统(AMPTS Ⅱ,瑞典Bioprocess Control 公司,见图1)中开展试验[15]。接种污泥(驯化的厌氧污泥,VSS含量0.015 2 g·mL-1)和物料(不含消毒剂的新鲜猪粪,VSS 含量0.209 1 g·g-1,湿质量)按挥发性固体(VSS)比2∶1 进行混合[16],通过添加一定量的超纯水以保证总固体(TS)浓度为2%,并将400 g上述混合物加入到500 mL 玻璃反应瓶(厌氧消化单元)中,于中温(37±0.5)℃水浴加热,通过电机自动控制搅拌循环(5 min 搅拌,5 min 停止),直至当天产气量不足累计产气量1%,视为试验结束[15]。接种时,在玻璃反应瓶内接入500 mL·min-1氮气流,保持1 min 左右,保证整个反应体系处于严格的厌氧环境。
1.3 样品的采集与分析
CH4的收集:AMPTS Ⅱ装置(图1)配备有可控温的发酵单元,内含NaOH溶液+石蕊指示剂的CO2吸收瓶(图1a),15组分辨率为10 mL的微量气体流量计组阵(图1b),可实现整个厌氧发酵周期连续全自动批量采集CH4,并通过内置的温度及压力传感器自动校正数据,获取精确的气体流量等数据[16]。

图1 全自动甲烷潜力测试系统(AMPTS Ⅱ)Figure 1 Automatic methane potential test system Ⅱ
理化指标及污泥样本收集:在启动期(第0 天)和结束期(第12 天)测定pH,并从各玻璃反应瓶(厌氧发酵单元)中取15 mL摇匀后的泥水混合样本,在4 ℃下,于离心机中以3 000g离心分离5 min,取底泥0.5~1.0 g 保存于无菌离心管中,离心管先放入液氮中,后于-80 ℃保存,用于微生物多样性分析;上清液用于测试COD、NH3-N、TN 和TP 等理化指标,对应测定方法依次参照《HJ 828—2017》《HJ 535—2009》《HJ 636—2012》和《GB 11893—1989》。
微生物多样性分析:按照Xu 等[17]和Benay 等[18]报道的方法,采用E.Z.N.A.®土壤DNA 提取试剂盒(Omega,美国)对样品微生物群落总DNA 进行提取,使用1%的琼脂糖凝胶电泳检测DNA 的提取质量,并通过NanoDrop2000测定DNA的浓度和纯度;待检验合格后,以338F(5′-ACTCCTACGGGAGGCA GCAG-3′)和806R(5′-GGACTACHVGGGTWTCTA AT-3′)为引物,对16S rRNA 基因V3~V4 区进行PCR 扩增,使用NEXTFLEX Rapid DNA-Seq Kit 建库,利用Illumina公司的MiSeq PE300 平台测序,以分析厌氧活性污泥中微生物多样性的变化。
1.4 数据处理分析
采用Origin 8.5 和GraphPad Prism 软件进行数据处理和差异显著性分析,P<0.05 表示差异显著;微生物多样性数据处理借助上海美吉生物云平台完成[19]。
2 结果与分析
2.1 消毒剂对厌氧消化产甲烷特征的影响
由图2a和图2b可知,空白组持续产气12 d,累计产气量达(85.10±3.99)mL,表明接种污泥具有较高的活性[13]。CK 组初始阶段快速产气,无明显迟滞期。与CK 组相比,试验组显示厌氧消化系统中卫可的存在会影响CH4的产生,且表现出明显的剂量关系。由图2b 可知:CH4产生量在L 组和H 组受到抑制,产量分别比CK 组降低了7.53%(P>0.05)和92.60%(P<0.001);对于产气周期,L 组和H 组分别为12 d 和1 d,较CK组(10 d)分别延长20%和缩短90%。由图2a可知,CK 组、L 组和H 组的产气高峰时间分别出现在第3天、第3天和第1天,其最高日产CH4量分别为(128.15±0.35)、(102.93±8.11)、(39.07±1.07)mL·d-1,单位质量可挥发性有机物(猪粪的VSS)对应的最大产CH4速率依次为(23.54±0.06)、(18.90±1.49)、(7.73±0.01)mL·g-1·d-1,相应地,消化结束后总产CH4量分别为(104.51±1.93)、(96.64±7.80)、(7.73±0.01)mL·g-1。
如图2c所示,通过对反应时间和CH4产率的数据拟合发现,除H 组外(产CH4仅1 d)的整个厌氧消化产气过程满足准一级动力学方程[20],并具体表现为:Blank 组、CK 组和L 组的准一级动力学拟合方程分别为G(t)=15.387 55(1-e-0.47078t)、G(t)=114.131 23(1-e-0.26678t)和G(t)=108.935 23(1-e-0.2246t),相关系数(R2)依次为0.990 0、0.980 7 和0.980 0,对应的理论CH4产率(G∞)分别为15.39、114.13 mL·g-1和108.94 mL·g-1,与实测的(15.63±0.73)、(104.51±1.93)mL·g-1和(96.64±7.80)mL·g-1相近;同时,产CH4速率常数也因消毒剂的添加受到抑制,由CK组的0.267 d-1下降到L组的0.225 d-1。由此可见,卫可会抑制厌氧消化产CH4的性能,并表现出明显的剂量关系。
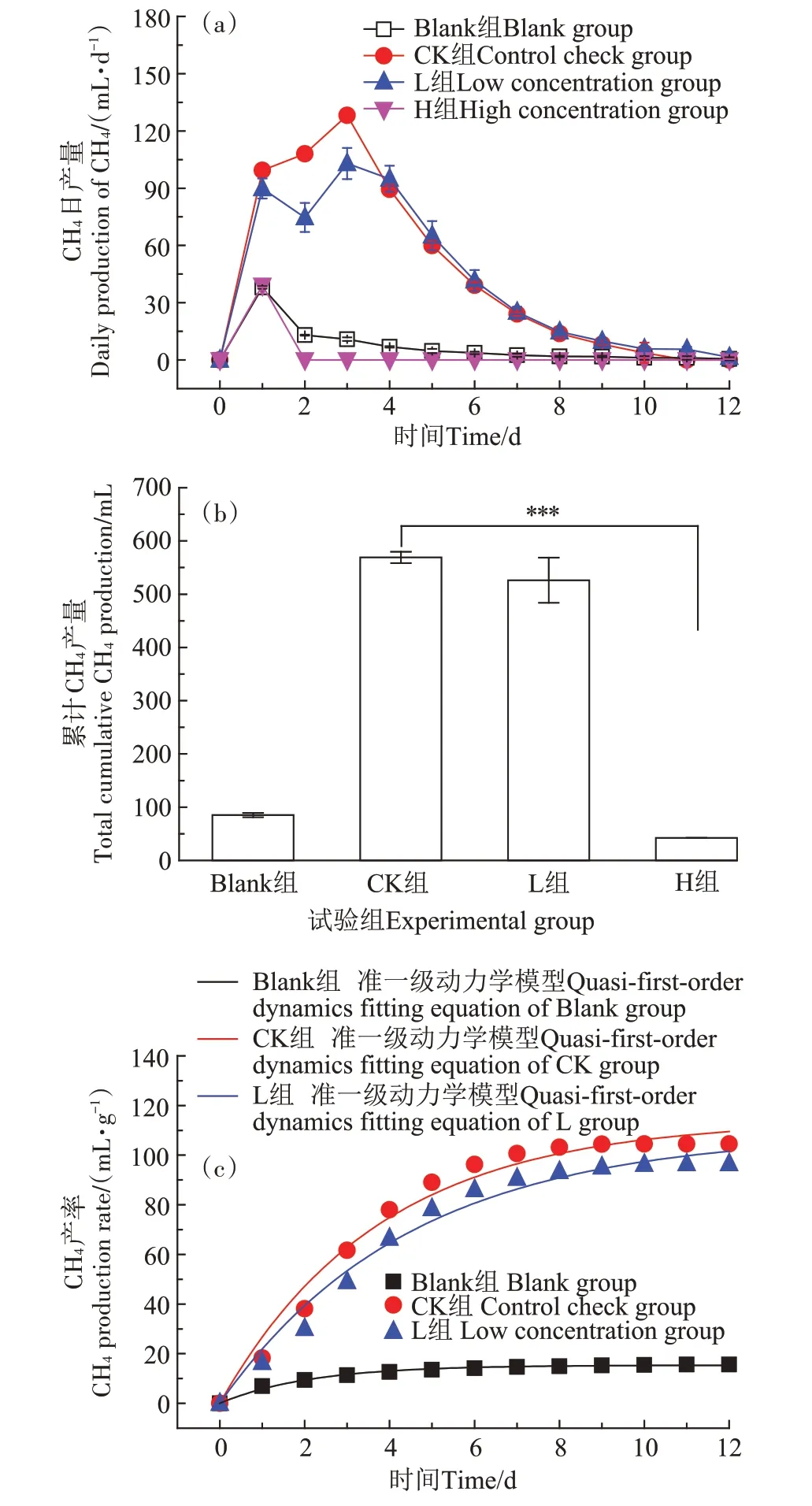
图2 卫可对厌氧消化产甲烷特征的影响Figure 2 Effect of VirkonTM on the characteristics of methane production from anaerobic digestion
2.2 消毒剂对厌氧消化过程中理化性质的影响
由图3可知,无论是刚加入消毒剂的启动期(第0天),还是反应的结束期(第12 天),卫可对厌氧消化液中的COD、TP、NH3-N、TN 和pH 值5 个理化指标均有显著影响,且其作用是快速、持久的。具体表现为:相较于CK 组,H 组对反应体系中的5 个理化指标均表现出极显著影响(P<0.01 或P<0.001),L 组则仅对pH值造成显著性下降。COD 表现出与卫可剂量呈正相关,在第0 天,L 组和H 组比CK 组[(669.50±4.33)mg·L-1]分别高出16.48%和148.77%(P<0.001),而第12 天反应结束时,L 组和H 组比CK 组[(506.50±2.50)mg·L-1)]分别高出11.91%和368.97%(P<0.001),由图3a可见,经过厌氧消化反应后,CK组和L组的COD均呈现正常的下降现象,而H 组的COD 反而大幅升高;对于TP,在第0 天和第12 天时L 组中TP 浓度的提升效果不显著,但H 组中TP 浓度分别高达(151.99±7.34)mg·L-1和(293.25±4.61)mg·L-1,比CK组分别高出214.11%(P<0.001)和498.12%(P<0.001),表明卫可在厌氧环境下也会促进磷的释放;NH3-N 和TN 整体呈现出相似的变化趋势,随着反应时间的进行,浓度逐渐上升,但相较于CK 组,L 组的NH3-N 和TN 释放效应不显著,H 组则呈现显著性增加,在第0 天,H组NH3-N 和TN 浓度分别为(203.47±4.31)mg·L-1和(350.02±6.61)mg·L-1,比CK组高出64.79%(P<0.001)和68.77%(P<0.001),到第12 天时,对应的NH3-N 和TN 浓度分别达到(302.27±2.80)mg·L-1和(426.88±8.21)mg·L-1,比CK 组高出44.37%(P<0.01)和53.30%(P<0.001),表明卫可在厌氧环境下会促进氮素的释放;对于pH 值,则表现出明显的剂量效应,卫可含量越高,系统pH 值越低,但反应前后变化较小,在第0 天和第12 天,H 组的pH 值分别为(5.73±0.04)和(6.08±0.02),较CK 组分别低1.45(P<0.001)和0.99(P<0.001)。综上可知,卫可会导致厌氧发酵液中COD 不降反升,且大幅促进TP、NH3-N 和TN 的释放,同时伴随pH值的下降。
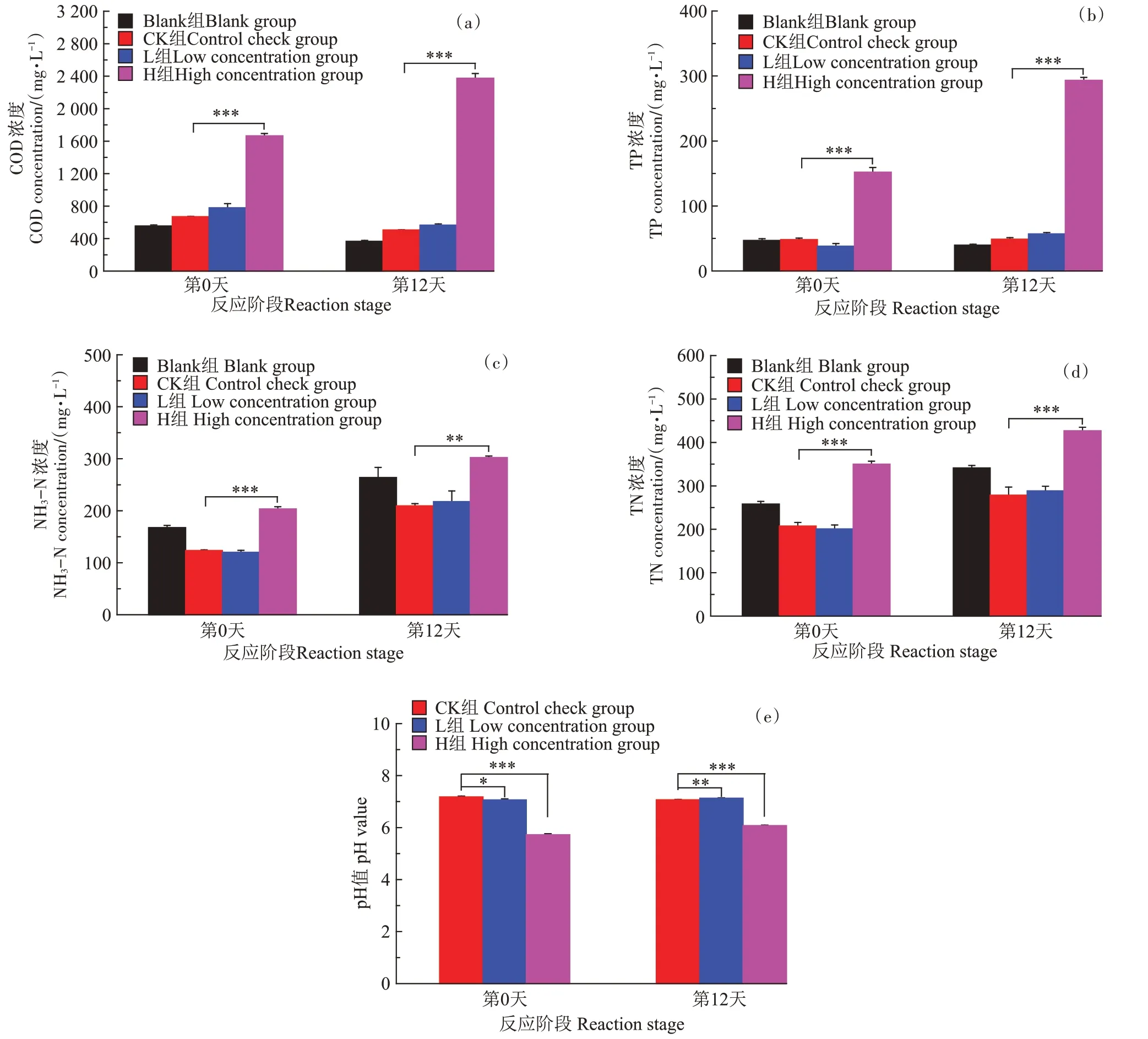
图3 厌氧发酵前后理化性质的变化Figure 3 Changes of physicochemical properties during anaerobic fermentation
2.3 微生物多样性特征分析
2.3.1 微生物群落组成特征
通过对18个样品进行高通量测序,共获得791 710条高质量序列,每个样品33 313~74 828 条,平均50 874 条。所有样品共获得51 个门、98 个纲、212 个目、362个科、699个属、1 200个种和2 172个OTU。
2.3.2 微生物群落丰度和多样性分析
对合格序列均一化处理后,选择Sobs、Simpson、Shannon、Ace 和Chao 等α 多样性分析指数,对厌氧发酵前后微生物群落的丰富度和多样性进行评估,具体见表1。
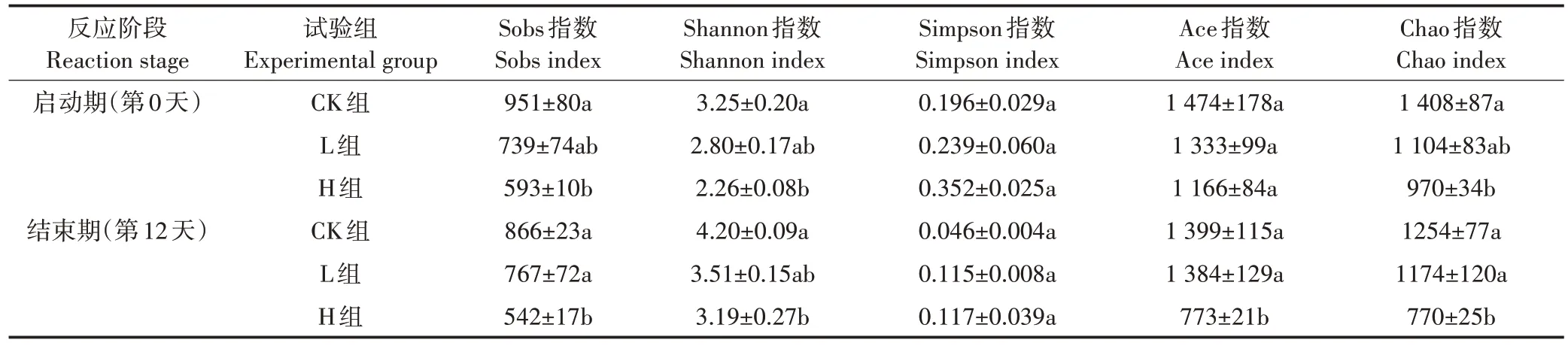
表1 不同处理组在厌氧发酵前后细菌群落多样性指数变化(OTU水平)Table 1 Changes of bacterial community diversity index in different treatment groups during anaerobic fermentation(OTU level)
由表1 知,作为反映微生物菌群丰度的Ace 和Chao 指数,无论是刚加入卫可的第0 天,还是反应结束的第12天,L组和H组均比CK组低,且反应时间越长其抑制效果越明显,反应结束时H 组的Ace和Chao指数分别为(773±21)和(770±25),显著低于CK 组对应的(1 399±115)和(1 254±77)(P<0.05)。而针对反映微生物菌群多样性的Shannon 和Simpson 指数,无论是第0 天还是第12 天,Shannon 指数均表现为L 组和H 组低于CK 组,Simpson 指数则与之相反,且表现出与消毒剂之间明显的剂量关系,其中高的Shannon指数和低的Simpson 指数代表高的菌群多样性[21]。此外,H 组较CK 组的Shannon 指数显著下降(P<0.05),而Simpson 指数虽然在3 个试验组间无显著差异,但均表现为CK 组<L 组<H 组,说明微生物多样性随着消毒剂剂量的增加而减少(P>0.05),这也进一步表明微生物多样性与微生物丰度的结果相似。
2.3.3 微生物群落组成分析
从门水平和属水平分析不同试验组在厌氧发酵前后微生物群落组成差异,结果见图4。由图4可知,不同试验组中微生物菌群的组成明显不同,且厌氧发酵结束后对应优势菌门也有所改变。
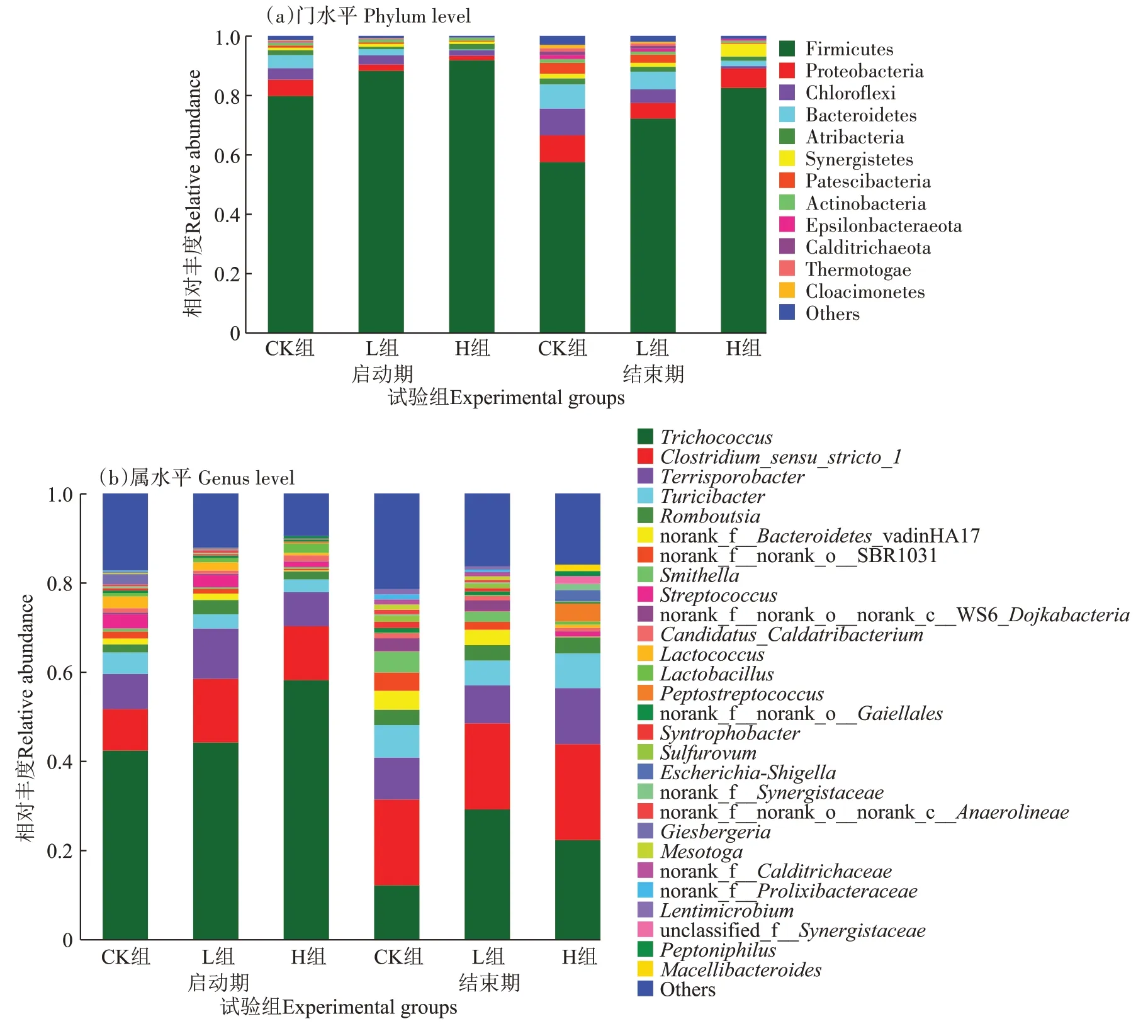
图4 卫可消毒剂添加下发酵细菌群落变化Figure 4 Fermentation bacterial community changes under VirkonTM disinfectant additions
在门水平,厌氧发酵前后均表现出厚壁菌门(Firmicutes)是第一优势菌群,其在启动期和结束期时的占比分别为79.72%(CK 组)、88.21%(L 组)、91.77%(H 组)和57.49%(CK 组)、72.14%(L 组)和82.43%(H组),这与黄潇[22]、闫冰等[23]和朱文博等[24]关于厚壁菌门是发酵系统中的优势菌群的结论一致;其次是变形菌门(Proteobacteria)、绿弯菌门(Chloroflexi)和拟杆菌门(Bacteroidetes),其他微生物丰度均低于5%。此外,无论是刚加入卫可的启动期,还是厌氧发酵反应的结束期,厚壁菌门丰度均随消毒剂剂量的增加而增大,变形菌门、绿弯菌门和拟杆菌门则与之相反,随卫可剂量的增加而减少,其中拟杆菌门在刚开始阶段反应最为敏感,短时间内直接由4.39%(CK 组)降低至0.31%(H 组),但到反应结束时会再次上升至1.81%(H 组);而绿弯菌门则由3.89%(CK 组)下降至1.83%(H 组),直至反应结束再次降低至0.81%(H 组)。对于其他关键微生物菌群中的互养菌门(Synergistetes)、热袍菌门(Thermotogae)和阴沟单胞菌门(Cloacimonetes)在添加卫可后变化较为明显,前者由启动期的0.42%(H 组)大幅提升至结束期的4.32%,增幅约10 倍;后两者在高剂量卫可添加下,丰度快速地由未添加消毒剂的0.20%~0.28%(CK 组)降低至0,且直至12 天后的反应结束期,其丰度依然为0,表明热袍菌门和阴沟单胞菌门会因高剂量卫可的添加而消失。
在属水平,优势菌属主要包括束毛球菌属(Trichococcus)、严格梭菌属(Clostridium_sensu_stricto_1)、己酸菌属(Terrisporobacter)、苏黎世杆菌属(Turicibacter)等,其丰度占比分别为12.03%~59.16%、9.20%~22.12%、7.18%~13.06%、2.82%~8.36%。在经厌氧消化后,部分细菌群落在属水平发生了较大变化,束毛球菌属由42.15%~59.26% 降至12.02%~30.37%,且厌氧消化反应前后均表现出消毒剂试验组高于CK 组;也有一些菌属在加入卫可后相对丰度显著降低并在厌氧消化结束后甚至被杀灭,其中吉斯伯格菌属(Giesbergeria)和Lentimicrobium属的丰度就与卫可表现出明显的剂量关系,H 组较CK 组短时间内两菌属丰度明显减少,分别在启动期由2.309%降至0.003%和由0.105%降至0.002%,且厌氧消化结束后均被杀灭(相对丰度为0)。此外,也存在部分菌属丰度显著增加的现象,如消化链球菌属(Peptostreptococcus)在厌氧消化开始时由0.003%(CK 组)快速增至0.385%(H 组),增幅约128 倍,在厌氧消化结束后H 组继续增至4.007%,增幅约10 倍;埃希氏-志贺菌属(Escherichia-Shigella)在厌氧消化开始时由0.070%(CK 组)降至0.002%(H 组),厌氧消化结束后H 组大幅增至2.542%,增幅达1 270 倍;Macellibacteroides在厌氧消化开始时由0.013%(CK 组)降至0.001%(H 组),厌氧消化结束后H 组大幅增至1.445%,增幅达1 444倍。
2.3.4 微生物与厌氧消化理化指标的相关关系
在门水平,选择丰度前20 的菌群,分析其与厌氧消化理化指标之间的相关性,结果见图5。除了厚壁菌门和梭杆菌门(Fusobacteria)与COD 和TP 降解呈极显著正相关外,其余大部分菌门(绿弯菌门、阴沟单胞菌门等)都与COD 和TP 降解呈显著负相关[25]。通过结合图4指出阴沟单胞菌门在添加卫可后其相对丰度增幅约10倍的现象也进一步佐证了TP异常上升的原因。而在NH3-N 和TN 的转化和降解方面,变形菌门、互养菌门、Epsilonbacteraeota 门、梭杆菌门等与之呈正相关,绿弯菌门与TN降解呈显著负相关,其余菌门均不能显著影响NH3-N和TN。
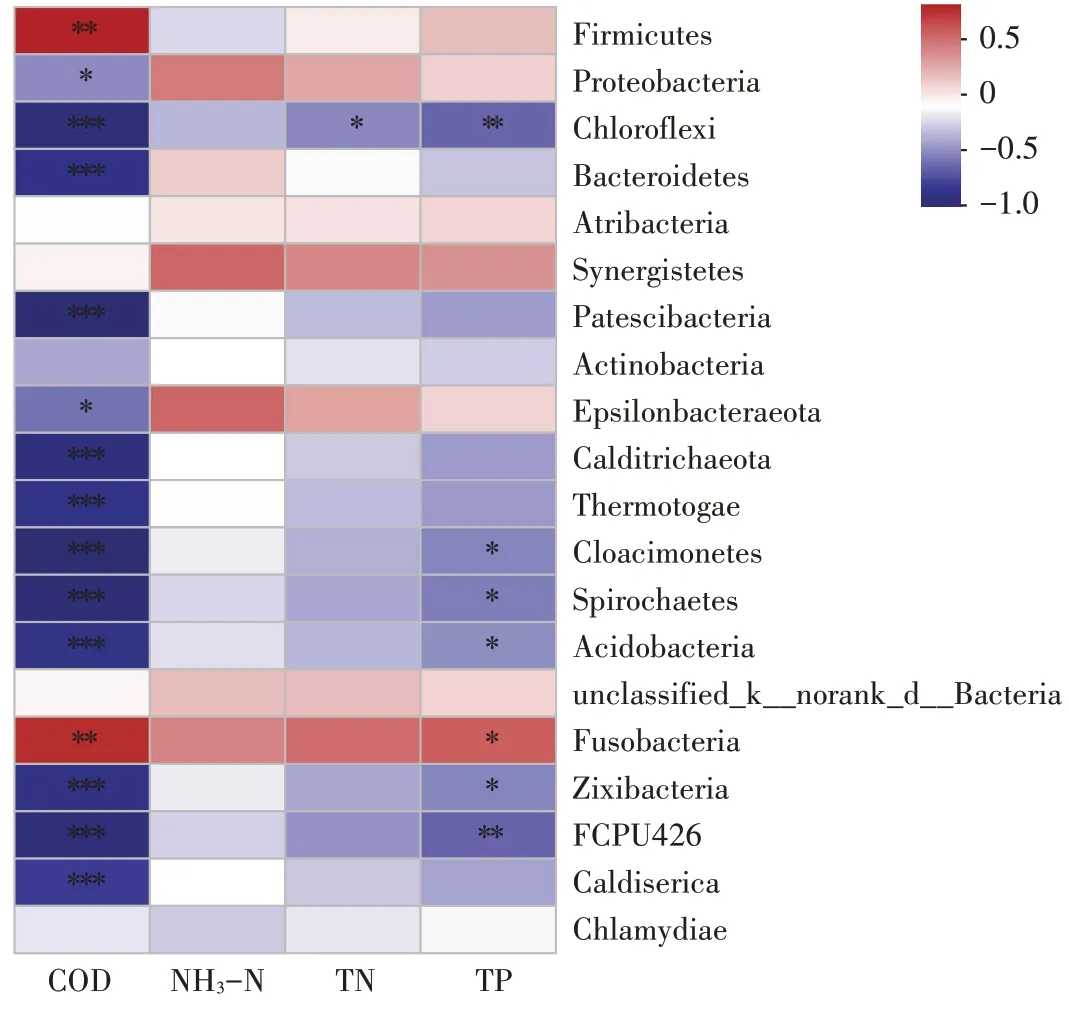
图5 主要微生物菌群与关键理化指标之间的相关性分析Figure 5 Correlation analysis between main microbial flora and key physicochemical indexes
3 讨论
通过围绕不同剂量卫可对猪场粪污厌氧消化影响的研究发现:CK组初始阶段会快速产气,无明显的迟滞期,表明接种物具有较高的活性且对猪粪和厌氧环境条件具有良好的适应性;虽然接种物经过良好的驯化,具有了较高的生物活性,但厌氧消化系统中卫可的存在仍会影响CH4的产生,且表现出明显的剂量关系,结合图2可知,相较CK组,L组和H组会抑制产CH4,且H 组表现出显著差异,而在产气周期上,H 组相对于CK 组也缩短90%,可见,0.5%卫可会明显抑制产气量且极大缩短产气时间。究其原因为过硫酸氢钾作为卫可的主要成分具有强氧化性,这与国内外学者关于其他氧化型消毒剂的研究结果相似,如Eunseok 等[26]指出500、1 500 mg·L-1和3 000 mg·L-1NaClO 使厌氧条件下CH4产率分别下降13%、24%和60%,Yang 等[27]也强调0.03 g·g-1和0.24 g·g-1过硫酸氢钾会导致CH4产量下降约33%和89%,同时毕培等[28]也表明过硫酸钾会通过抑制产甲烷菌活性而使CH4产量下降。此外,结合CH4产率(图2)与COD、TP、NH3-N、TN、pH 等常规理化指标(图3)的变化发现,在刚加卫可的第0天,对于COD,L组和H 组较CK组分别高出16.48%和148.77%,对于TP,分别高出214.11%和498.12%;H 组NH3-N 和TN 浓度分别较CK组高出64.79%和68.77%,同时L组和H组的pH分别较CK组下降1.45(P<0.001)和0.99(P<0.001),据此推测卫可的添加很有可能会导致厌氧消化系统发生快速的水解酸化,使之发酵产生的有机物浓度高于微生物自身的代谢利用能力,从而导致酸化产物积累,而COD、氮、磷的异常升高则很有可能是由卫可的主要成分过硫酸氢钾对微生物细胞的破坏和溶解所造成[26];直至整个厌氧消化反应结束期(第12 天),COD不降反升,且大幅促进TP、NH3-N 和TN 释放的异常现象不仅没有恢复,反而加剧恶化,说明其反应体系中的厌氧微生物活性可能受到卫可的明显抑制甚至失活,而Peter等[29]和王旭东等[30]关于NaClO 和柠檬酸消毒剂对微生物的影响机制可以较好地证明该推测。由此进一步表明,卫可对猪场粪污发酵系统的抑制作用是快速且持久的,其中pH 值降低除了受过硫酸氢钾自身显酸性影响外,更与挥发性脂肪酸的积累密切相关[31]。
此外,通过分析发酵过程中微生物群落功能多样性,可科学评估微生物群落状态与功能变化,进而揭示微生物的生态特征及影响发酵效能的生物因素[10,32]。由表1可知,在不同阶段的厌氧发酵期,卫可均表现出对厌氧系统中微生物多样性的不利影响,在启动期,呈现出抑制微生物多样性(Shannon 和Simpson指数)和物种丰度(Ace和Chao指数),且H 组具有显著抑制性(P<0.05);随着发酵时间延长,就Shannon指数而言,L 组由启动期的(2.802±0.165)增加至结束期的(3.513±0.145),相应地H 组由(2.26±0.08)增至(3.19±0.27),由此表明,试验结束期较启动期增加了微生物菌群多样性和物种丰度。其原因可能在于厌氧发酵初期,卫可对微生物生长有抑制作用,导致微生物群落多样性降低,随着发酵时间的延长,卫可诱导产生了具有显著优势度的抗药性菌群,使得微生物菌群多样性和物种丰度增高[27,31]。同时结合图2a 亦可进一步证明,L 组在添加卫可的前4 d,其产气率均低于CK 组,但第5 天后卫可对微生物的抑制作用减弱,进而出现了其产率与CK组接近的现象。
结合图4 分析可知,在厌氧消化反应前后,添加卫可的试验组均表现出厚壁菌门相对丰度随着反应时间延长而降低,而变形菌门相对丰度则与之相反。其原因可能是由于厌氧过程使系统有机物浓度降低,使得可供厚壁菌门吸收利用的物质减少,从而导致其丰度减小[33];对于变形菌门,正如Hyun 等[34]研究指出其可能是一类兼性或专性厌氧细菌或寡营养菌,其在厌氧环境或有机物质浓度较少的环境下更易存活。对于这两类优势菌门,添加卫可后,无论是启动期,还是结束期,厚壁菌门丰度均随消毒剂剂量增加而增大,变形菌门丰度大体呈现随卫可剂量增加而减小,这表明添加卫可会促进原料(猪粪)或者污泥(微生物)的水解或者裂解,导致厌氧系统中可利用的有机物浓度增高,而结合COD 等理化指标不降反升(图3)和厚壁菌门与COD 降解呈极显著正相关(图5)的现象也可进一步佐证这一可能性[2,26,35]。
4 结论
(1)卫可消毒剂在猪场粪污厌氧消化系统中的质量浓度为0.05%和0.5%时,均会导致猪粪污厌氧消化系统的功能不同程度受损,并表现为:抑制厌氧产CH4效能,对COD、TP、NH3-N、TN 和pH 值5 个理化指标具有显著性影响(P<0.01),并伴随COD 不降反升、大幅促进氮磷释放等异常现象,且该作用是快速、持久的。
(2)高通量测序发现,卫可会导致厌氧系统中细菌群落组成、多样性和丰度发生显著性变化,其中,Shannon 指数均表现为L 组和H 组低于CK 组(P<0.05),Simpson 指数则与之相反,表现为CK<L<H(P>0.05);优势菌门中的厚壁菌门丰度随卫可剂量增加而增大,变形菌门、绿弯菌门和拟杆菌门则与之相反;另外,阴沟单胞菌门会因0.5%卫可而消失。
(3)在丰度前20 的菌门中,厚壁菌门和梭杆菌门与COD 降解呈极显著正相关,变形菌门、Epsilonbacteraeota、互养菌门、梭杆菌门等与NH3-N 和TN 降解呈正相关,同时绿弯菌门与TN降解呈显著负相关。

