满江红对含卡马西平与吉非罗齐的生活污水的净化效果
李胜曙,崔二苹,郑凌云,李松旌,陶甄,胡超,赵志娟,樊向阳*
(1.中国农业科学院农田灌溉研究所,河南 新乡 453002;2.河南省漯河市农水技术推广中心,河南 漯河 462000;3.天津大学地球系统科学学院,天津 300072)
近年来,随着人们生活水平的提高,药品和个人护理品(Pharmaceuticals and personal care products,PPCPs)使用量不断增加。PPCPs 在人体及动物体内难以被完全吸收,未完全代谢部分随污水排入水体及土壤环境,致使这一类新污染物的环境危害日益凸显。目前,我国地表水及污水处理厂进出水中检出的PPCPs 主要有卡马西平(Carbamazepine,CBZ)、吉非罗齐(Gemfibrozil,GEM)、三氯生(Triclosan,TCS)、布洛芬(Ibuprofen,IBP)、萘普生(Naproxen,NPX)等[1-3],检出量虽在ng·L-1至mg·L-1之间,但其长期不断输入环境所带来的暴露潜力不亚于持久性污染物[4]。研究表明,PPCPs 具有一定的生态环境风险,微量水平即可抑制微生物[5-6]、植物[7-9]、动物[10]的生长发育,甚至导致其死亡。近年来,对PPCPs这类新污染物的环境效应及去除研究日益成为热点。吉非罗齐作为一种广泛使用的血脂调节药,常被用于治疗高血脂、冠状动脉等疾病。随着人们生活质量的提升,高血脂人群逐年增加,该药物及其代谢物在污水、水体以及土壤中累积浓度的可能性进一步增大[11],研究发现其在较高浓度下对水生生物(弧菌、水蚤、藻类、金鱼)有一定的危害,甚至影响人类健康[11-12]。卡马西平是一种重要且广泛使用的抗癫痫药物,主要用于治疗癫痫病、治疗中枢神经性尿毒症、抗躁狂抑郁症,也常用于抗心律失常等[13]。随着现代生活节奏快、生活压力大,患病人群逐渐增多,该药品的使用量及生产量仍处于持续增加的态势[14],卡马西平的过度使用不仅会造成环境污染,还会影响人类的健康[15]。
近年来,水生植物被广泛应用于净化高氮、磷的生活污水,并表现出较好的应用前景[16]。满江红是作为我国南方常见的蕨类水生植物,因其生长速度快,且对含氮、磷、COD[17-21]等常规污染物及含双氯芬酸[22]、表面活性剂[23]等典型PPCPs 的生活污水具备良好净化去除效果,在水体污染治理中日益受到重视。目前,关于满江红进行植物修复的研究主要集中在富含氮、磷的生活污水修复或仅对PPCPs 的去除,对PPCPs 及高氮磷复合污染的生活污水修复效果鲜见报道。同时研究表明,PPCPs 的存在可削弱植物对污水中常规污染物的去除效果[24]。为此,本研究以满江红和生活污水中典型PPCPs(吉非罗齐、卡马西平)为研究对象,针对不同PPCPs 含量的生活污水,开展满江红对吉非罗齐、卡马西平及常规污染物的协同去除效果研究,以期探明满江红在不同PPCPs初始浓度生活污水中的生长状况及其污染去除效果,旨在为满江红应用于含PPCPs生活污水的治理提供参考。
1 材料与方法
1.1 试验地点
试验在中国农业科学院新乡农业水土环境野外科学观测试验站智能人工气候室进行,具体环境控制指标设置为光照强度300 μmol·m-2·s-1,光照时间07:00—20:00,白天、夜间温度分别为28、18 ℃,相对湿度60%,CO2含量1 178.5 mg·m-3。
1.2 试验材料
供试植物选择满江红科满江红属满江红Azolla(俗称红萍或绿萍),采自福建省福清市某观测实验站。采集的满江红植株,采用0.5% NaClO 溶液消毒2~3 min,并经超纯水洗涤2 次后转移至20%的Hoagland′s 营养液中驯化培养2 周。选择长势良好且个体差异较小的满江红,采用超纯水冲洗3 次,并用滤纸吸干表面水分后备用。
供试卡马西平和吉非罗齐基本物化参数如表1所示。供试材料均购自上海安谱璀世标准技术服务有限公司,采用甲醇溶解配制母液后冷藏待用。
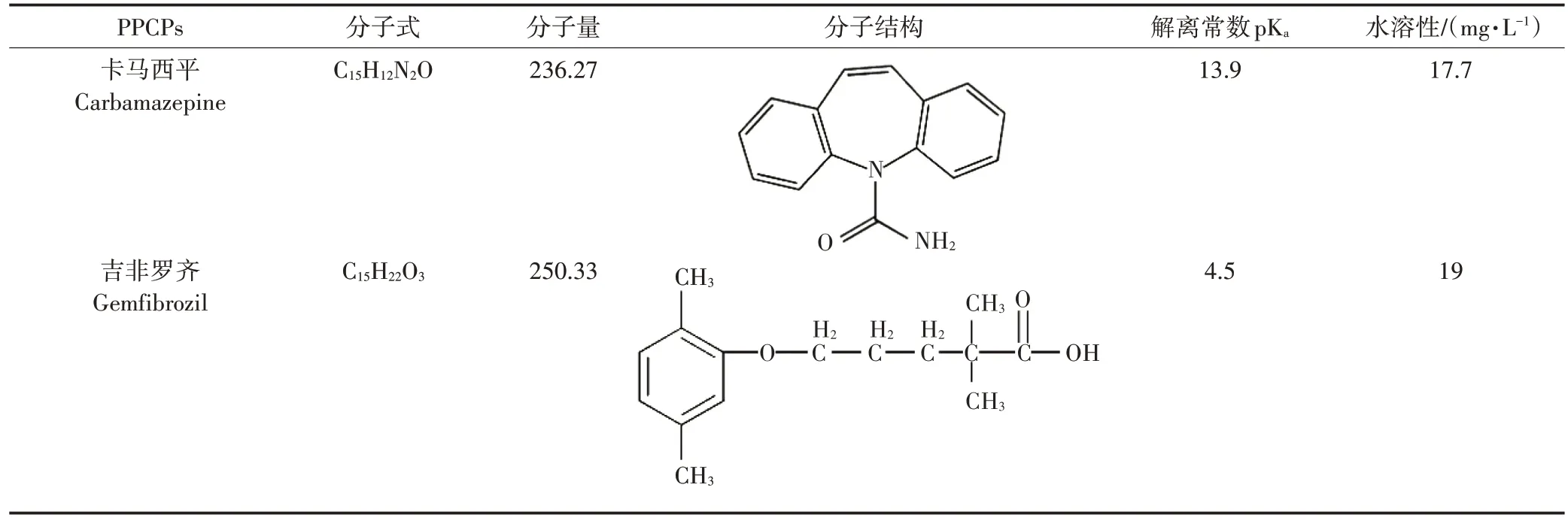
表1 目标PPCPs的基本物化参数Table 1 Basic physicochemical parameters of targeted PPCPs
参考刘伟等[25]、阮晓卿等[26]的研究,供试生活污水基于20%Hoagland′s营养液添加葡萄糖(C6H12O6)、硫酸铵[(NH4)2SO4]等进行配制。配制后生活污水pH值6.26,氨氮(NH3-N)、硝态氮(NO-3-N)、总磷(TP)、化学需氧量(COD)含量分别为36.97、20.66、7.40、346.67 mg·L-1。
由表1可知,卡马西平与吉非罗具有一定疏水性,齐水溶性很小。卡马西平含有一个酰胺基,酰胺在一般条件下水解反应缓慢且需要较强烈的条件,因此卡马西平溶液在一般条件下难以水解;吉非罗齐含有一个羧基,其羟基氧原子上的孤对电子与碳氧双键共轭,因此具有很强的稳定性,难以水解;有研究表明,卡马西平[27-28]与吉非罗齐[29]水溶液在短期内浓度变化不明显,污染物自身的水解反应不影响试验结果。
试验装置为聚丙烯黑色塑料桶,可有效防止光降解,单个试验桶容积1 L。
1.3 试验设计
试验处理主要考虑生活污水中供试PPCPs 的浓度水平,卡马西平、吉非罗齐浓度均分别设置为1、10、100、1 000 μg·L-1,以不添加PPCPs 为对照,共计5个浓度处理。试验开始时向各处理移栽4.00 g 满江红,并添加稀释到相应浓度水平的等体积PPCPs工作液,其中对照处理中加入等体积甲醇以消除误差,同时注入生活污水至500 mL。试验过程中每日固定时间添加超纯水,以保持试验装置中生活污水体积不变。参考稳定塘及人工湿地一般水力停留时间,整个试验周期设计为8 d[30],整个培养周期中,分别在试验当天及第1、2、4、8 天破坏性采集植物样及水样。整个试验周期内进行5 次取样,每次每个浓度取3 个重复,共计75个小桶。
1.4 检测指标及方法
1.4.1 植株生长指标
满江红植物鲜质量采用称重法测定,经超纯水清洗、滤纸吸干表面水分后,记录鲜质量。
本研究运用植物相对生长率及耐受性指数来揭示满江红在不同时期鲜质量对PPCPs 含量的响应规律,以定量评估满江红对生活污水中典型PPCPs的敏感性。其中,植物相对生长率(Relative growth rate,RGR)采用公式1 计算,植物耐受性指数(Tolerance index,TI)采用公式2计算[30]。
式中:BM为满江红鲜质量,g;t为时间,d;P为试验处理编号。
1.4.2 水体中PPCPs含量
水样过0.45 μm 滤膜后,取200 mL滤液装入棕色玻璃瓶中,并加入0.16 g EDTA-二钠盐,调节pH 至6.5~7.0。将HLB 柱(Waters Oasis HLB,200mg/ 6cc)活化后(5 mL 甲醇、10 mL 超纯水),使滤液以5 mL·min-1的流速通过被活化的HLB 柱,待滤液全部通过后,采用5 mL 超纯水淋洗HLB 柱,并用10 mL 甲醇-乙腈混合液(体积比1∶1)洗脱HLB 柱,收集洗脱液。利用氮吹仪将收集的洗脱液浓缩至1~2 mL后,用1∶1的质谱甲醇-水混合液定容至10 mL[31],采用外标法和液相色谱-质谱联用仪检测水中目标PPCPs含量。
液相色谱-质谱联用仪型号为赛默飞U3000-QE。色谱柱为Waters BEH(C18,2.1×100 mm,1.7 μm),柱温设置为40 ℃,样品进样量为1 μL;流动相A相为0.1%甲酸水溶液,B相为乙腈,流速均为0.3 mL·min-1;流动相洗脱梯度见表2。
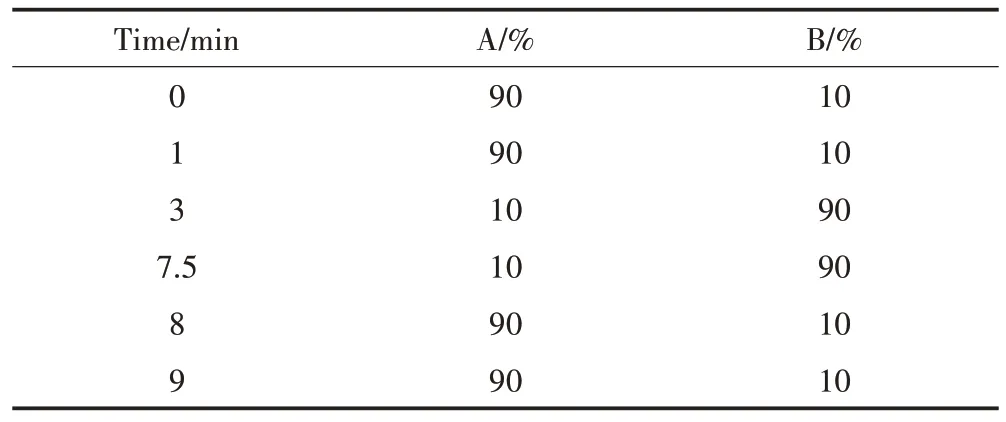
表2 液相色谱流动相洗脱梯度Table 2 Liquid chromatography mobile phase elution gradient
采用点喷雾离子源(ESI),正负离子模式,传输毛细管温度250 ℃,离子源温度350 ℃,雾化器温度325 ℃,电压为3.8 kV,采集模式选用一级高分辨母离子模式。2种PPCPs质谱参数及其回收率见表3。

表3 PPCPs对应的液相二级串联质谱分析参数及其回收率Table 3 Operation parameters and recovery rate of LC-MS/MS analysis corresponding to tested PPCPs
1.4.3 水体pH值及NH3-N-N、COD、TP含量
pH 值采用pH S-1 型酸度计(Oion 奥立龙公司,美国)测定;NH3-N 含量采用纳氏试剂分光光度法测定;-N 含量采用紫外分光光度法测定;COD(以N计)含量采用重铬酸钾氧化法测定;TP(以-P 计)含量采用钼酸铵分光光度法测定[32]。
水体污染物去除率采用公式3计算。
式中:R为污染物去除率,%;C为污水中污染物含量(PPCPs 含量单位为μg·L-1,其余污染物含量单位为mg·L-1)。
1.5 数据分析
采用Excel 2019 进行数据统计,采用SPSS 23 进行数据处理,采用莱文检验进行方差齐性检验,采用Pearson 检验进行拟合优度检验,对不满足正态分布的数据采用Zscore 法对其进行标准化处理,采用Origin 2022制图。
2 结果与分析
2.1 不同初始浓度PPCPs 生活污水对满江红生长的影响
不同PPCPs 浓度水平下满江红相对生长率及耐受指数变化如图1所示。由图1可知,各培养周期内,不同初始PPCPs 浓度处理对满江红相对生长率及耐受指数的影响差异均达到显著水平(P<0.05),其中1 000 μg·L-1PPCPs 处理下满江红相对生长率及耐受指数最低,出现叶片发黄、根须脱落、鲜质量减少现象。满江红相对生长率及耐受指数随PPCPs 浓度增加而显著降低(P<0.05),1、10 μg·L-1PPCPs 处理下满江红相对生长率及耐受指数显著高于对照(P<0.05),100、1 000 μg·L-1PPCPs处理显著低于对照(P<0.05)。
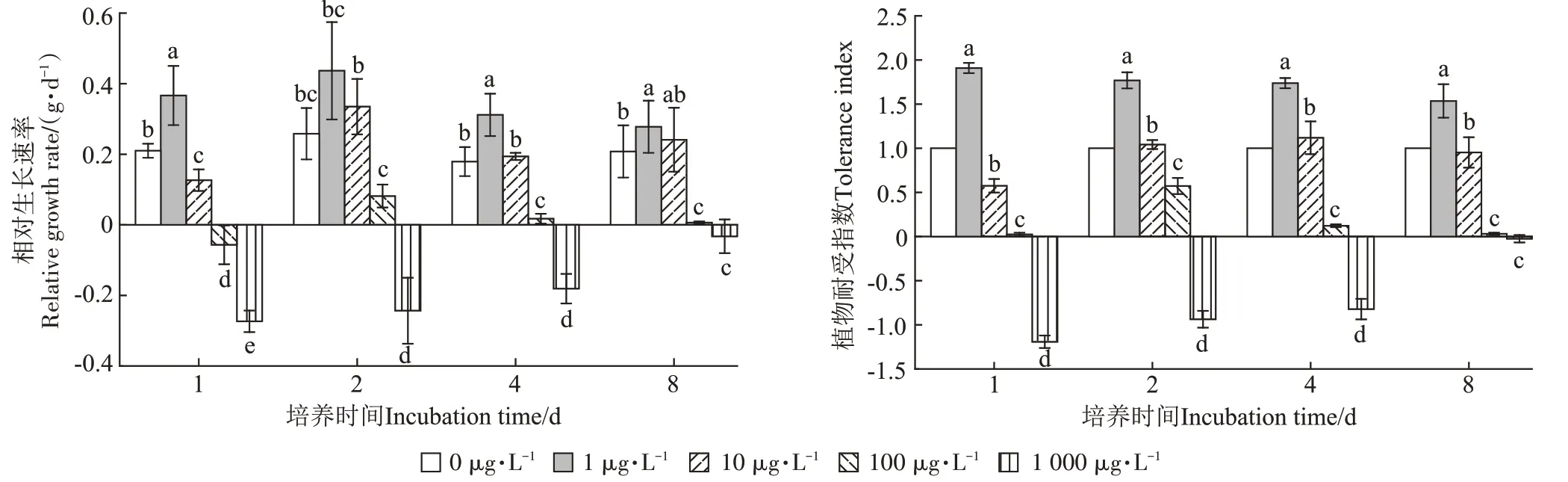
图1 不同PPCPs浓度下满江红相对生长速率及耐受指数Figure 1 Relative growth rate and tolerance index under different PPCPs contents
2.2 满江红对不同处理下卡马西平和吉非罗齐的去除效果
不同PPCPs浓度水平下,卡马西平和吉非罗齐的去除变化规律如图2 所示。试验周期结束后,满江红对生活污水中1、10、100、1 000 μg·L-1的卡马西平去除效果的差异达到显著水平(P<0.05),满江红可分别去除38.03%、22.50%、18.72%、12.3%的卡马西平,表明满江红对修复卡马西平污染的水体有一定潜力,且卡马西平去除率随其初始浓度的升高呈现下降趋势。此外,在1、10、100 μg·L-1初始浓度下,卡马西平去除率随着培养时间的延长显著升高,而1 000 μg·L-1初始浓度下,卡马西平去除率在培养4 d 时达到12.05%,并在之后无显著变化,说明培养时间的延长显著利于低浓度(1、10、100 μg·L-1)卡马西平的去除,但是对高浓度(1 000 μg·L-1)卡马西平的去除无显著影响。
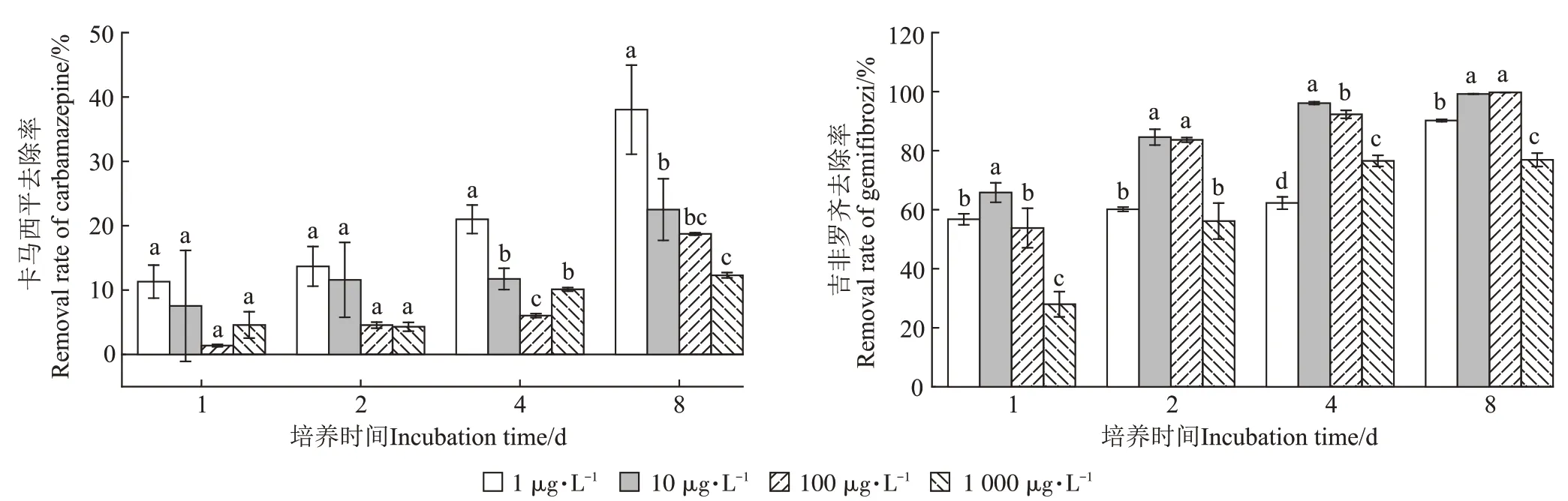
图2 卡马西平、吉非罗齐去除率Figure 2 Removal rate of carbamazepine and gemfibrozil
各处理下,满江红对吉非罗齐(1、10、100、1 000 μg·L-1)去除效果的差异达到显著水平(P<0.05)。当污染水体中含1、10、100、1 000 μg·L-1的吉非罗齐时,满江红最终可分别去除90.20%、99.20%、99.74%、76.89%的吉非罗齐,表明满江红是修复吉非罗齐污染水体的高效植物。此外,1 μg·L-1初始浓度下,在培养1 d后吉非罗齐去除率已达到56.74%,并在培养2、4 d后无显著变化,直到培养8 d后去除率才有一个大幅度的提高;而10、100、1 000 μg·L-1初始浓度下,吉非罗齐可在短时间内达到较高去除率,培养时间的延长有助于去除率的升高,但不明显。
2.3 满江红对不同处理下常规污染物的去除效果
2.3.1 满江红对氨氮、硝态氮去除效果
不同PPCPs浓度水平下满江红对氨氮、硝态氮去除率如图3 所示。试验周期结束后,不同初始PPCPs浓度水平对满江红去除氨氮的影响差异均达显著水平(P<0.05)。随着培养时间的延长,氨氮去除率随培养时间的延长呈现先上升后下降的趋势,在第4天时去除率最高,对照及1、10、100、1 000 μg·L-1PPCPs 浓度下去除率分别为26.14%、24.20%、23.35%、14.67%、16.21%,而第8天后去除率均出现不同程度下降甚至出现负去除的情况,其中100、1 000 μg·L-1PPCPs 浓度下氨氮浓度分别增加8.35%、13.23%。
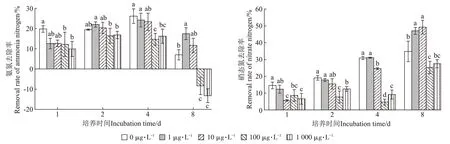
图3 氨氮、硝态氮去除效果Figure 3 Removal effect of ammonia nitrogen and nitrate nitrogen
试验周期结束后,各处理下,满江红对硝态氮表现出良好的去除能力,且不同初始PPCPs浓度水平对满江红去除硝态氮的影响差异达到显著水平(P<0.05)。其中,1、10 μg·L-1PPCPs 处理可显著增加其去除率,但两者之间无显著性差异(P>0.05);100、1 000 μg·L-1PPCPs 处理可显著削弱其去除率,但两者之间无显著性差异(P>0.05)。随着培养时间延长,对照组及1、10 μg·L-1PPCPs 初始浓度下硝态氮去除率呈不断升高的趋势,培养周期结束后去除率分别为34.79%、47.04%、49.25%;而100、1 000 μg·L-1PPCPs浓度下硝态氮去除率呈先下降后上升的趋势,在第4天时去除率最低为4.64%、9.12%,在培养周期结束后去除率分别为25.26%、27.47%。
2.3.2 满江红对总磷去除效果
不同PPCPs 浓度水平下满江红对总磷去除率变化如图4 所示。试验周期结束后,各处理下,不同初始PPCPs 浓度水平对满江红去除总磷的影响差异达到显著水平(P<0.05)。其中,1、10 μg·L-1PPCPs初始浓度水平下,总磷去除率显著高于其他处理(P<0.05),分别可达到50.88%、54.12%;1 000 μg·L-1PPCPs 初始浓度水平下,总磷去除效果显著低于其他处理(P<0.05),仅为15.59%。空白对照组中总磷去除率为38.82%,在含有不同初始浓度PPCPs 的其他处理中,总磷去除率随PPCPs初始浓度升高呈现先升高后降低的趋势。
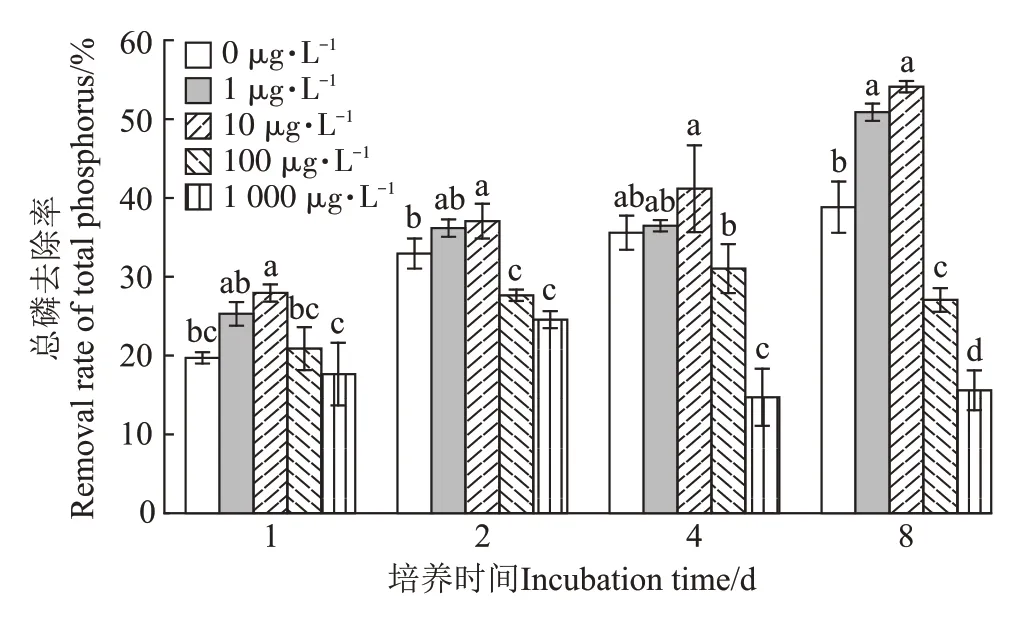
图4 总磷去除效果Figure 4 Removal effect of total phosphorus
随着培养时间的延长,0、1、10 μg·L-1PPCPs处理下总磷去除率呈不断升高的趋势,培养周期结束后去除率分别达到38.82%、50.88%、54.12%。100、1 000 μg·L-1PPCPs 处理下总磷去除率呈先上升后下降的趋势,100 μg·L-1PPCPs 处理下第4 天时总磷去除率最大为31.03%,第8 天去除率下降到27.06%;1 000 μg·L-1PPCPs 处理下第2 天时总磷去除率最大为24.56%,第8天去除率下降到15.59%。
2.3.3 生活污水中COD去除效果
培养周期结束后对生活污水中COD 含量进行测量,各处理下初始COD 含量均为346.67 mg·L-1,0、1、10、100、1 000 μg·L-1浓度下培养周期结束后分别降至126.67、100.00、63.33、26.67、30.00 mg·L-1,去除率分别为63.46%、71.15%、81.73%、92.31%、91.35%。整体上看,COD 的去除率随初始PPCPs 浓度升高而升高,其中100、1 000 μg·L-1处理下,COD去除率显著高于其他处理(P<0.05)。
2.4 生活污水中pH值的变化趋势
培养周期前后对生活污水pH 值进行测量,各处理下初始pH 值均为6.26,培养周期结束后,0、1、10、100、1 000 μg·L-1浓度下pH值分别为6.32、6.04、5.96、6.16、6.48。其中1、10 μg·L-1处理中pH 值显著低于其他处理(P<0.05),1 000 μg·L-1处理中pH 值显著高于其他处理(P<0.05)。
2.5 吉非罗齐和卡马西平去除效果的通径分析
为探明满江红生长情况、培养时间及常规污染物对吉非罗齐、卡马西平去除的影响,将吉非罗齐、卡马西平去除情况与总磷、氨氮、硝态氮、相对生长率和培养时间进行相关性分析,结果如表4 所示。由表4 可知,吉非罗齐去除情况与卡马西平、总磷、硝态氮及培养时间呈正相关(P<0.01);卡马西平去除情况与总磷、硝态氮、培养时间及植物相对生长率呈正相关(P<0.01)。
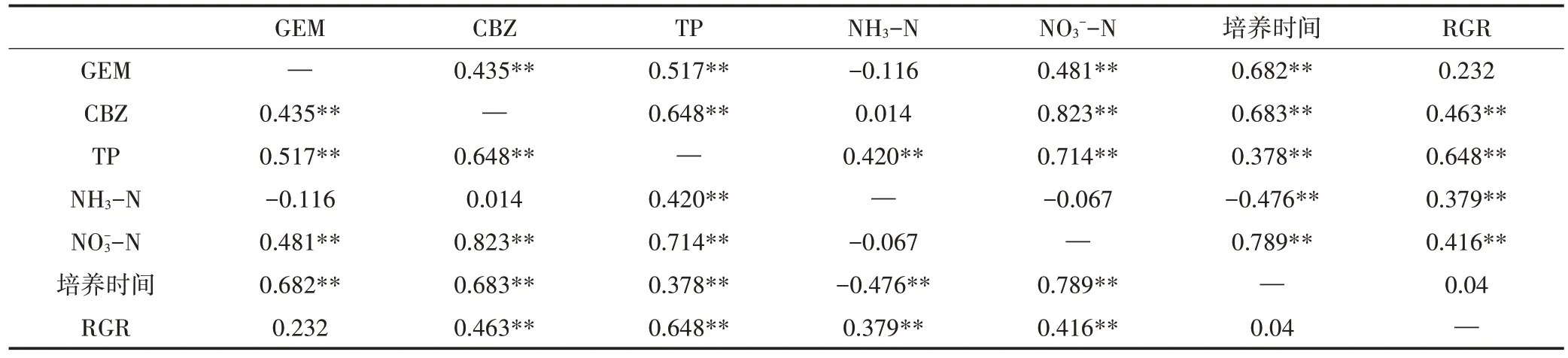
表4 植物相对生长率与培养时间及污水因子相关性Table 4 Correlation of plant relative growth rate,incubation time and sewage factors
为明确各因子对吉非罗齐、卡马西平去除的直接影响与间接影响,将吉非罗齐、卡马西平去除率进行正态性检验并做标准化处理,进一步获得的吉非罗齐(YGEM)、卡马西平(YCBZ)与总磷(x1)、氨氮(x2)、硝态氮(x3)、培养时间(x4)和相对生长率(x5)等因子进行逐步回归分析及通径分析,筛除无显著影响的因子得到的最优模型见表5,相关回归系数见表6。同时可以得到线性方程:YGEM=-0.235+6.954x1-7.499x3+0.443x4,YCBZ=-1.427+0.758x5+0.083x4。模型中标准化的吉非罗齐、卡马西平的多元线性回归方程均达到极显著水平(P<0.01),其中总磷(x1)、硝态氮(x3)与培养时间(x4)可以解释73.4%的吉非罗齐去除率变化,而培养时间(x4)和相对生长率(x5)可解释65.4%的卡马西平去除率变化。通径分析结果见表7 和表8。由表7 可知,3 个自变量对吉非罗齐去除率的直接影响中,培养时间(x4)的直接作用最大,总磷(x1)次之,硝态氮(x3)直接作用最小;虽然硝态氮(x3)对吉非罗齐去除率产生一定负值的直接作用,但其通过培养时间(x4)、总磷(x1)对吉非罗齐去除率的间接作用大,导致其对吉非罗齐去除率影响较大。表8 可以看出培养时间(x4)对卡马西平去除率直接作用最大,而相对生长率(x5)的直接作用略低,两者对卡马西平去除的间接通径系数均较小。
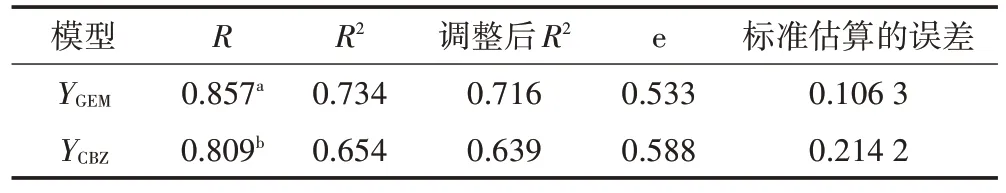
表5 模型概述Table 5 Model summary
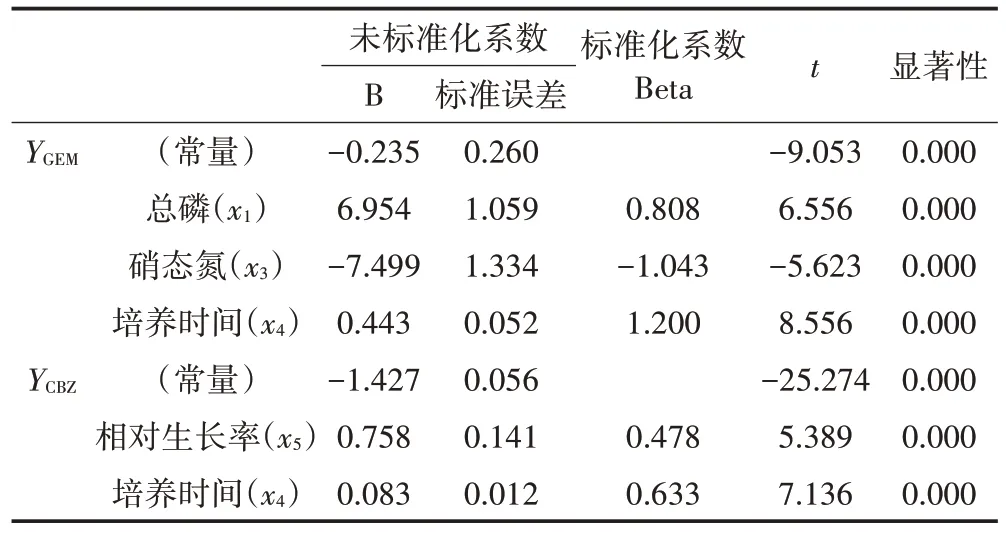
表6 回归系数Table 6 Regression coefficient
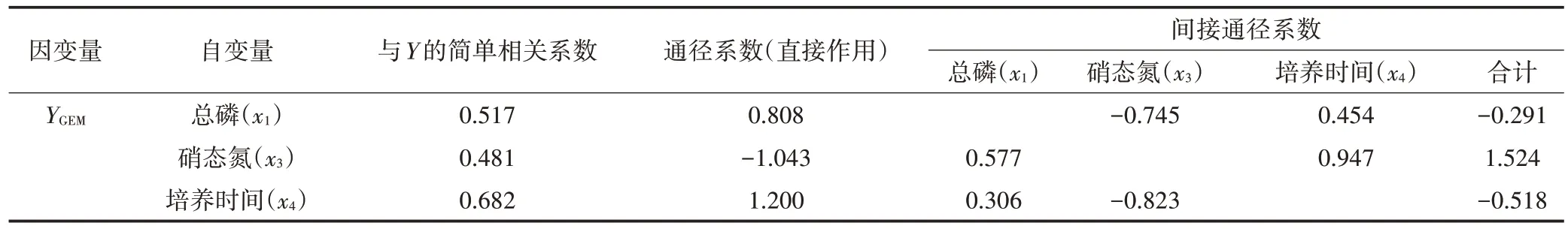
表7 吉非罗齐去除率相关系数Table 7 Correlation index of gemfibrozil removal rate
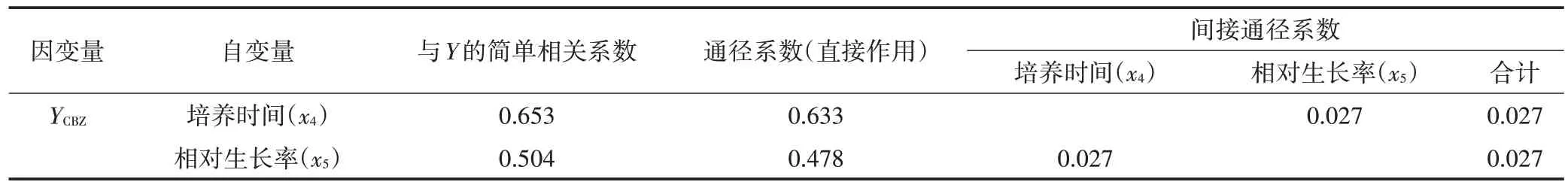
表8 卡马西平去除率相关系数Table 8 Correlation index of carbamazepine removal rate
3 讨论
3.1 不同PPCPs初始浓度生活污水中满江红生长状况
低浓度的PPCPs对满江红的生长有着促进作用,但高浓度的PPCPs则会抑制满江红的生长,出现了不同程度的根须脱落、植株萎缩等现象,但随着时间延长,植物耐性指数增加,满江红衰减情况得到改善。Bianchi 等[30]的研究表明再生水中低浓度的药品类污染可以提高满江红的相对生长速率;Vannini等[22]通过研究满江红对双氯芬酸的毒性反应指出,100、1 000 μg·L-1双氯芬酸处理在短期内使满江红生物量减少,且其衰减速率随着培养时间的延长逐渐降低。本研究中满江红在不同PPCPs初始浓度的生活污水中生长情况与上述研究结果基本一致。有研究指出满江红在水体污染胁迫下,一方面增加有机酸、氨基酸、可溶性糖等物质分泌进而抵御环境胁迫,另一方面分泌植物螯合素对污染物起束缚作用,降低可被吸收的环境中污染物浓度,同时根作为满江红吸收污染物的重要器官,面临污染胁迫时会主动脱落,降低植株体内污染物浓度水平[33-36]。参考满江红抵御污染物胁迫的自我调节机制,推断其在高浓度PPCPs条件下保持生长的原因可能是:①根系分泌了植物螯合素对PPCPs起到了束缚作用,降低了可被吸收的PPCPs浓度;②满江红根须脱落导致满江红植株内污染物含量减少。
3.2 不同PPCPs 初始浓度生活污水中满江红对典型PPCPs的去除效果
满江红对不同PPCPs 初始浓度的生活污水的新污染物去除效果不同。随着生活污水中PPCPs浓度升高,满江红对卡马西平的去除率明显降低,而对吉非罗齐的去除则表现出先升高后降低的趋势。有研究表明,卡马西平在自然环境下难以被降解[28],不同的植物对卡马西平降解能力不同,向日葵和玉米对卡马西平的去除率分别为30%和10%[36],美人蕉对卡马西平去除率为26%[28]。满江红在水力停留时间8 d 内对不同PPCPs 浓度水平的卡马西平去除率为14.20%~34.30%,对吉非罗齐去除率可达到76.89%~99.74%,表明满江红对卡马西平、吉非罗齐污染的生活污水有良好的修复潜力。通径分析表明,培养时间是影响吉非罗齐、卡马西平去除率的主导因子,说明采用满江红对PPCPs进行去除时,可增加处理时间以提高去除率。
满江红对不同类型的PPCPs 去除效果不同。满江红对吉非罗齐的去除能力均优于对卡马西平的去除能力。总磷对吉非罗齐去除率的直接影响系数达到0.808,但对卡马西平去除率无显著影响,说明相同因子对不同类型的PPCPs 作用效果也不相同。吉非罗齐作为一种可电离的酸性药物,在生活污水中的溶解度高于卡马西平[37],其对应的质子接受体更容易被满江红根系吸附,为后续满江红对吉非罗齐的吸收创造有利条件。而卡马西平为中性药物,其分子更容易因疏水作用聚集[38],难以被根系吸附,阻碍了满江红对卡马西平的吸收。
3.3 不同PPCPs 初始浓度生活污水中满江红对常规污染物的去除效果
满江红对生活污水中高含量的氨氮去除效果不佳。满江红具有固氮作用,但对水环境中的氨氮吸收能力有限[39]。在PPCPs胁迫下,满江红根系坏死脱落,其根系中吸收的氨氮及固氮作用固定的氮随之释放到环境中,导致水体中氨氮含量回升甚至超过初始值。
满江红对生活污水中硝态氮去除效果随生活污水中PPCPs 含量增加呈现出先增加后减弱的趋势。水体中氮主要依靠微生物硝化、反硝化作用去除[40]。而水生植物能够将氧气运送到根部,其根系能够为微生物提供生长繁殖的场所及条件[41]。满江红根系发达,为微生物提供良好的场所,但在高含量PPCPs 的生活污水中,满江红生长受到一定胁迫,根须脱落,从而影响水中微生物进行水体的硝化、反硝化作用。满江红对生活污水中总磷去除效果整体表现良好,对总磷的去除规律与对硝态氮去除规律相似。磷是水生植物生长发育过程中关键的营养元素[42],满江红的生长繁殖会从水体中吸收磷元素,从而削减水体中的磷含量。水体中总磷、硝态氮去除率与满江红相对生长率表现出极显著正相关关系,说明满江红生长状况良好时,大量吸收污水中的磷元素,保持其快速生长,同时根系发育良好,为水体微生物提供了优质的生长繁殖条件,促进水体硝化、反硝化的进行,降低水体氮含量;而当满江红生长状况不佳时,繁殖速度受到限制,对水体磷的吸收速度减缓,根须发育受阻甚至脱落,限制水中微生物硝化、反硝化的进行,从而导致对氮的去除效果减弱。满江红对生活污水中COD 削减效果良好,水环境中的COD 可作为植物及微生物生长过程所需的碳源,随着PPCPs 含量增加,满江红对COD 削减效果进一步提升的原因可能是面对环境胁迫,满江红及微生物对碳源需求增加,对水环境中碳吸收利用增加,从而降低水体中的COD含量。
4 结论
(1)低浓度药品和个人护理品(PPCPs)促进满江红在生活污水中的生长,提高其对污水中卡马西平、吉非罗齐及常规污染物的净化效果;高浓度的PPCPs胁迫满江红在生活污水中的生长,降低其对污水中卡马西平、吉非罗齐及常规污染物的净化效果。
(2)满江红对PPCPs的去除效果与其初始浓度和PPCPs 种类相关,满江红对1、10、100、1 000 μg·L-1浓度的吉非罗齐去除率分别为90.20%、99.20%、99.74%、76.89%;对1、10、100、1 000 μg·L-1浓度的卡马西平去除率为34.30%、22.50%、20.87%、14.20%。
(3)针对特定PPCPs 浓度水平的生活污水,种植满江红在去除PPCPs 的同时,可有效去除水中氨氮、硝态氮、总磷、COD 等常规污染物,可作为含有卡马西平、吉非罗齐的生活污水的治理修复植物。

