原位发酵床处理干旱寒冷区农村厕所粪污研究
陈卓帛,李佳彬,李路瑶,刘雪,朱昌雄,罗良国,漆远义,田兰,耿兵*
(1.中国农业科学院农业环境与可持续发展研究所,北京 100081;2.张掖兰标生物科技有限公司,甘肃 张掖 734000)
“小厕所,大民生”。厕所革命事关我国农村居民生活品质的提升。统计数据显示,2019年末中国乡村常住人口约5.5 亿人[1],每年厕所粪便总产量约4 000万t。根据《2019 中国卫生健康统计年鉴》,我国农村厕所普及率已在80%以上,但是无害化卫生厕所的普及率较低[2]。目前,在我国相对成熟并已大力推广使用的无害化卫生厕所主要有6 种技术类型:三格化粪池式、双瓮漏斗式、三联沼气池式、粪尿分集式、完整下水道式和双坑交替式[3]。三格化粪池厕所适用范围最广,在我国大部分农村地区推广应用[4]。双瓮漏斗和完整下水道厕所在平原水网地区有较大规模的推广应用[5]。双坑交替和粪尿分集厕所多适用于山地丘陵地区,可以满足水资源缺乏和经济欠发达地区农村改厕工作的需要[6]。三联沼气厕所可以实现废弃物能源化,但是运行过程容易受到低温条件的限制。
我国甘肃、新疆和内蒙古等省份属于典型的干旱寒冷地区,具有水资源缺乏、昼夜温差大和冬季干燥寒冷的特点,致使水冲式厕所在农村的使用受到限制,改厕可选择的技术类型较少。2021年12月,中共中央办公厅、国务院办公厅印发的《农村人居环境整治提升五年行动方案(2021—2025 年)》强调,加快研发干旱和寒冷地区卫生厕所适用技术和产品。因此,亟需探索和研究适用于干旱寒冷地区的农村改厕与粪污处理方式[7]。微生物原位发酵床养殖技术是将畜禽直接饲养在以谷壳、锯末和米糠等组成的垫料上,利用微生物发酵原理,原地将畜禽粪尿降解转化,从而实现环保无污染排放的畜禽养殖模式[8-9]。目前,关于微生物原位发酵床技术的研究主要集中于畜禽养殖污染控制与粪污资源化利用方面,包括生猪、家禽及奶牛养殖等[10]。发酵床废弃垫料含有丰富的氮、磷、钾等养分和有机质,可作为有机肥加工的原料[11-12]。近年来,微生物原位发酵床技术在国内外农村厕所改造工作中得到了应用,不仅节约了水资源,降低了环境污染,还实现了粪污的资源化利用[13-15]。但是,目前关于微生物原位发酵床处理干旱寒冷地区农村厕所粪污效果及运行参数的研究尚未见报道。
本研究将微生物原位发酵床技术用于干旱寒冷地区农村改厕与粪污处理,首次系统分析了不同服务人数微生物发酵床垫料中的营养成分含量、种子发芽指数,蛔虫卵死亡率及粪大肠菌群数,并对腐熟后的垫料进行肥效和安全性评价,从而为原位发酵床技术用于农村改厕与粪污处理提供科学依据。
1 材料与方法
1.1 试验方法
试验在甘肃省张掖市甘州区上秦镇农户使用的微生物原位发酵床厕所中进行。所有处理使用的厕所坐便器尺寸为1.10 m×0.61 m×0.71 m,其中用于粪污发酵处理的发酵床体积约为66 L,垫料深度为0.50 m。发酵床由加厚泡沫塑料制成,具有保温效果,并带有自动搅拌装置,每次使用后自动翻堆,保障物料混合均匀。将粉碎后的玉米秸秆和木屑按照1∶1(质量比)混合,初始添加垫料为4 kg,约占生物处理槽体积的2/3,并添加300 g微生物发酵菌剂。微生物菌剂由中科院天津工业生物技术研究所提供,5 株菌株编号分别为:BD-T-1,BD-T-3,BD-T-6,BD-TI-1 和BD-TI-2。混合垫料初始基本理化性质如下:pH 值为6.9,电导率(EC)为2.13mS·cm-1,含水率为15.27%,碳氮比(C/N)为70.01,有机质含量为85.25%,总氮(TN)为0.82%,总磷(TP)为1.16%,总钾(TK)为0.74%,总养分含量(总氮、氧化钾和五氧化二磷的总百分含量)为4.90%,细菌总数为1.68×108CFU·g-1。
试验选取正常使用的微生物原位发酵床户厕共8 处,表示为F1~F8。试验过程中每户使用厕所的人数基本保持恒定,并统计每天厕所使用次数。按照一个成年人每次排便为0.14 kg[16]计算试验全过程粪便投入量,具体见表1。
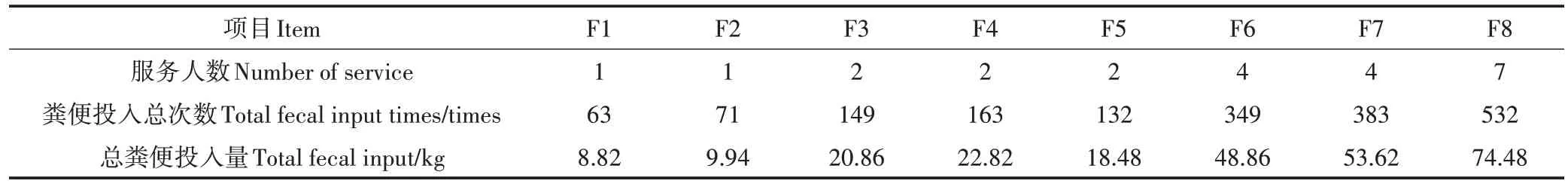
表1 原位发酵床80 d日均粪便投入量Table 1 Daily manure input in in-situ microbial fermentation systems bed for 80 days
试验按照五点取样法取样,即先确定对角线的中点作为中心抽样点,再在对角线上选择4 个与中心样点距离相等的点作为样点,每次取样共100 g,样品混匀后装入自封袋备用。于第0、10、20、30、40、50、60、70、80 天测定垫料的温度、含水量、pH 值和EC;试验结束后(即第80 天)测定垫料中TN、TP 和TK。在试验进行的第40 天和第80 天测定垫料中细菌、真菌和放线菌的数量。按照文献[8-10]的方法测定垫料含水量和微生物数量。垫料有机质、TN、TP 和TK 采用《有机肥料》(NY/T 525—2021)中的相关方法测定。
1.2 指标测定方法
TN 采用凯氏定氮法测定,TP 采用钒钼黄显色光度法测定,TK 采用原子吸收分光光度法测定,有机质含量采用重铬酸钾-硫酸法测定[10]。采用四分法取样品5 g于100 mL锥形瓶内,加入50 mL去离子水,将锥形瓶放入振荡器中以180 r·min-1的转速振荡30 min,静置30 min 后,分别用pH 计和电导率仪测定上清液的pH 值和EC 值。采用平板计数法对垫料中的微生物数量进行测定,其中细菌在37 ℃恒温条件下,采用牛肉膏蛋白胨培养基培养1~2 d后计数;真菌在28 ℃恒温条件下,采用马丁培养基培养3~4 d 后计数;放线菌在28 ℃恒温条件下,采用改良高氏一号培养基培养5~7 d后计数。根据3种微生物培养后菌落的生长情况,选取30~300 之间菌落的平板进行计数。按照《粪便无害化卫生要求》(GB 7959—2012)的方法测定试验结束后垫料中的粪大肠菌群、蛔虫卵死亡率和沙门氏菌,其中粪大肠菌群数采用多管发酵法测定,蛔虫卵死亡率采用沉淀集卵法测定,沙门氏菌采用显色培养基法测定。将新鲜垫料按1∶10(m∶V)与去离子水混合振荡,取5 mL 浸提液置于垫有滤纸的培养皿中,将经过预处理的甘蓝种子放入恒温培养箱(25 ℃,湿度70%)中培养48 h,测定其种子发芽率和根长。每个样品3 个重复,每个重复10 粒种子,同时用去离子水做空白试验(对照)。按照以下公式计算种子发芽指数(GI),最后取平均值。
发芽指数=(滤液组种子发芽率×滤液组种子发芽根长)/(对照组种子发芽率×对照组种子发芽根长)×100%。
1.3 数据分析
利用Origin 2019和SPSS 22.0软件对试验数据进行统计分析并绘图,采用单因素方差和Duncan检验法分析显著性差异;利用Pearson相关系数分析显著相关性。
2 结果与分析
2.1 发酵床垫料的温度变化
由图1 可见,微生物原位发酵床户厕环境温度(SW)在3~13 ℃之间波动,而F8~F2 发酵床垫料的温度明显高于SW,在试验开始后的第40~50 天分别达到高峰,之后温度下降,到第80天温度降至15 ℃以下接近室温,发酵结束。其中,F8 号发酵床垫料温度最高达到了44.33 ℃;F6和F7号发酵床垫料温度最高分别达到了51.66 ℃和50.24 ℃,且在35 ℃以上维持了10 d 左右;F3、F4 和F5 号发酵床垫料温度最高为37.46~44.33 ℃;F1 和F2 号发酵床垫料温度最高分别达到了30.67 ℃和34.33 ℃。
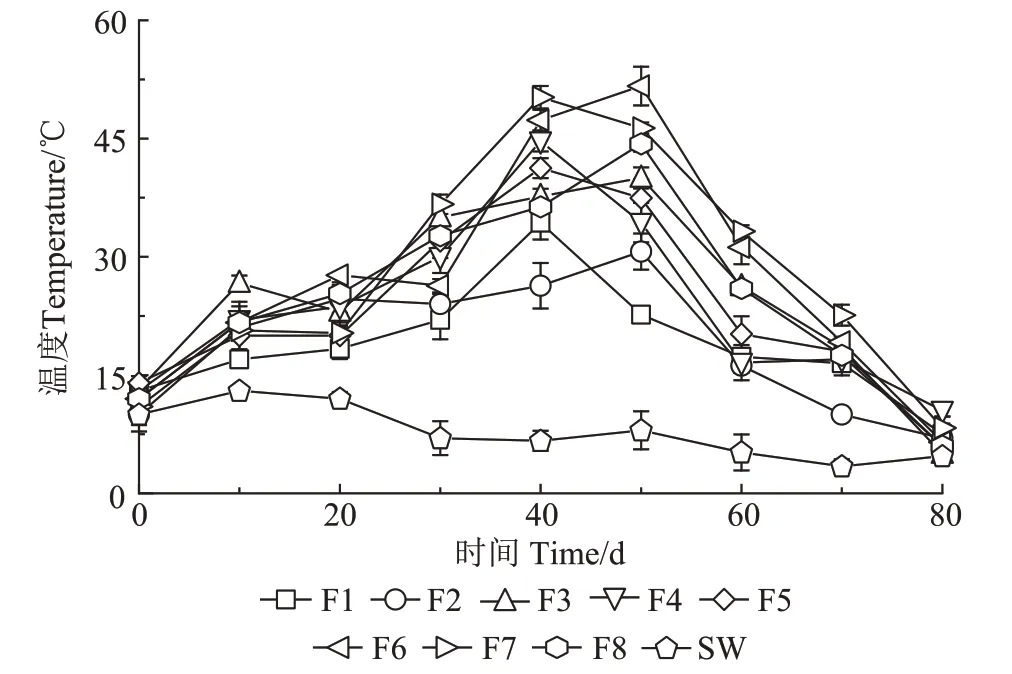
图1 试验过程中发酵床垫料的温度变化Figure 1 Changes of temperature in the padding during fermentation
2.2 发酵床垫料的pH值和EC值变化
如图2所示,所有发酵床垫料的pH值总体随试验进行呈先上升后下降的趋势,最后稳定在8 左右。在试验开始后,所有发酵床垫料的pH 值在0~20 d 均快速升高,在20~30 d除F6号发酵床以外,其他发酵床垫料pH值均缓慢升高,在30~60 d,除F1和F7号发酵床以外,其他发酵床垫料pH值上升到8.5以上,在70~80 d,所有发酵床垫料pH值逐渐稳定在7.36~8.49之间。
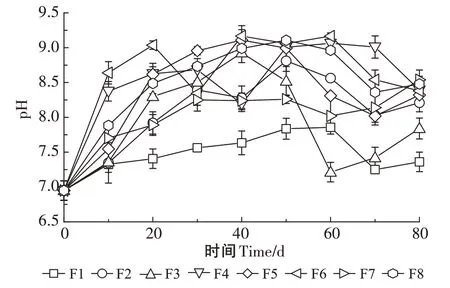
图2 试验过程中发酵床垫料的pH值变化Figure 2 Changes of pH value in the padding during fermentation
图3 是试验过程中发酵床垫料EC 值随时间的变化情况。所有发酵床垫料的EC值在前10 d内均呈上升趋势,从初始垫料的2.13 mS·cm-1上升到2.22~3.52 mS·cm-1之间,在10~20 d EC 值总体下降到1.98~3.08 mS·cm-1之间,在20~60 d,EC 值在1.48~3.27 mS·cm-1之间波动,最后在第80 天时稳定在1.96~2.48 mS·cm-1之间。EC 值在试验过程中变化幅度较小,总体呈先上升后下降,最后趋于稳定的趋势。试验结束时,所有发酵床垫料的EC值均在2.48以下。
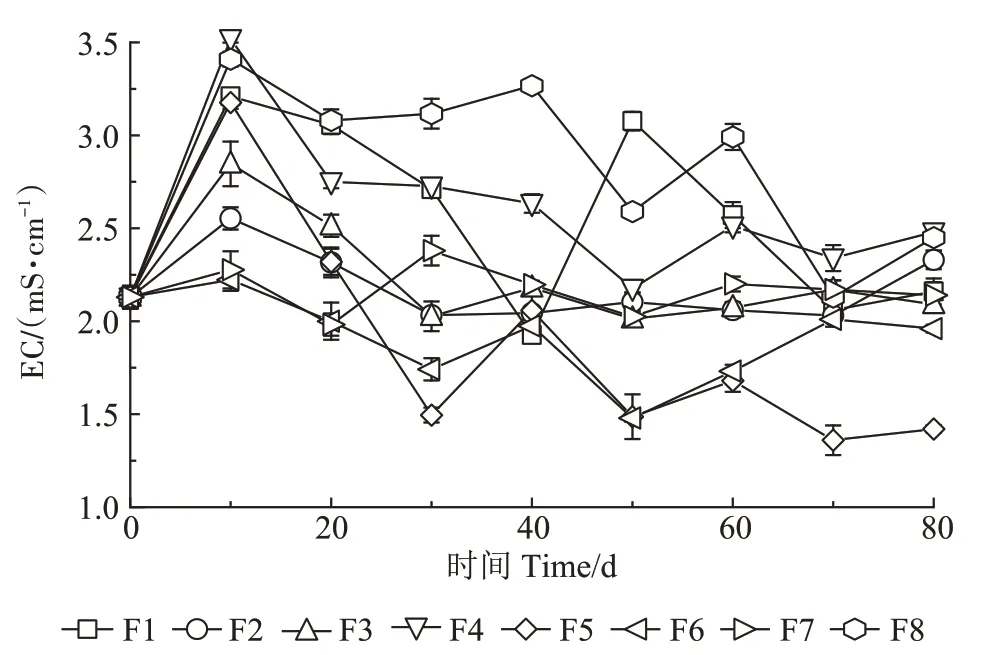
图3 试验过程中发酵床垫料的EC值变化Figure 3 Changes of EC value in the padding during fermentation
2.3 发酵床垫料的含水率变化
发酵床垫料的含水率变化情况如图4 所示。随着试验的进行,所有发酵床垫料的含水率呈现波动上升再下降的趋势,其中在50~60 d 达到最高值。F6 和F7号发酵床及F3、F4和F5号发酵床垫料的含水率在40~60 d 时始终保持在32.24%~58.81%之间,在70~80 d 时逐渐稳定在35.23%~52.34%之间;F1 和F2 号发酵床垫料的含水率在40~60 d 时处于14.20%~32.29%之间,在第70~80 d 时保持在30.25%~32.10%之间;F8 号发酵床垫料的含水率在第30 天达到55.55%后逐渐上升至第50 天的71.67%,然后逐渐下降,在70~80 d时维持在60.24%左右。
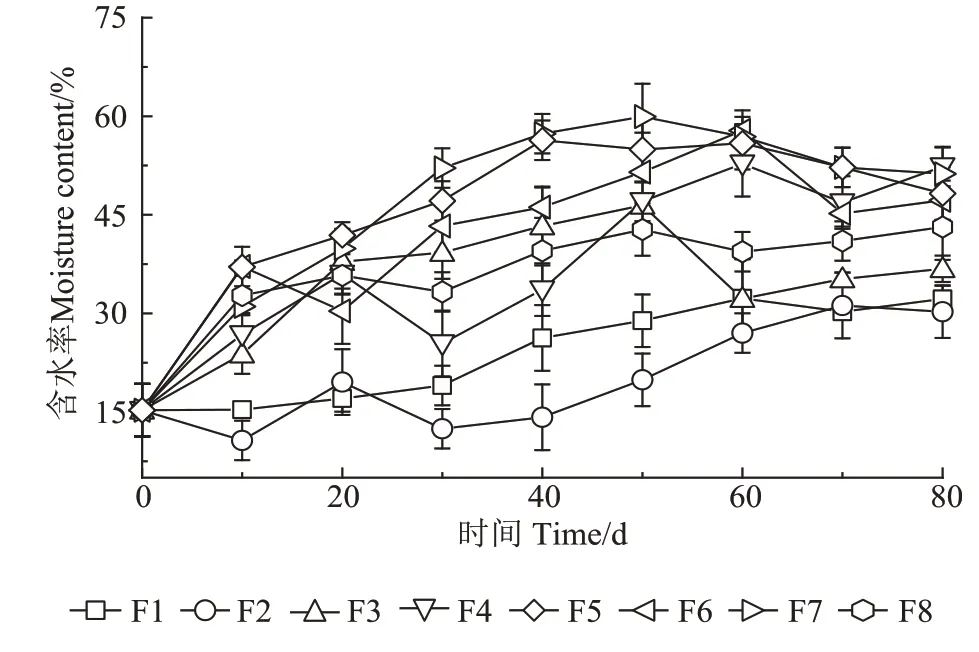
图4 试验过程中发酵床垫料的含水率变化Figure 4 Changes of moisture content in the padding during fermentation
2.4 发酵床垫料的营养成分变化
如表2 所示,与初始垫料相比,试验结束后所有发酵床垫料的TN 含量均有所提高,其中F8、F6、F7和F5 号发酵床垫料的TN 含量提高幅度较大,由初始的0.82%分别提高到3.13%、2.99%、3.06%和3.38%;除F8、F1 和F2 号发酵床垫料TP 含量提高不显著外,其余发酵床垫料TP 含量与初始垫料相比均显著提高;所有发酵床垫料的TK 含量在试验结束时均有所提高,其中F3、F6、F7 和F5 号发酵床垫料的TK 含量提高幅度较大,由初始的0.74%分别提高到1.67%、1.51%、1.40%和1.55%。所有发酵床垫料的C/N 均有显著降低,降低幅度排序为F5>F7>F6>F3>F1>F8>F4>F2。与初始垫料相比,试验结束时F1~F8 号发酵床垫料的总养分含量分别增加了3.07、2.21、5.41、4.88、6.16、5.19、5.70、3.28个百分点,其中F3、F4、F5、F6、F7号发酵床垫料的总养分含量较高,而F8、F1 和F2 号发酵床垫料的总养分含量较低。
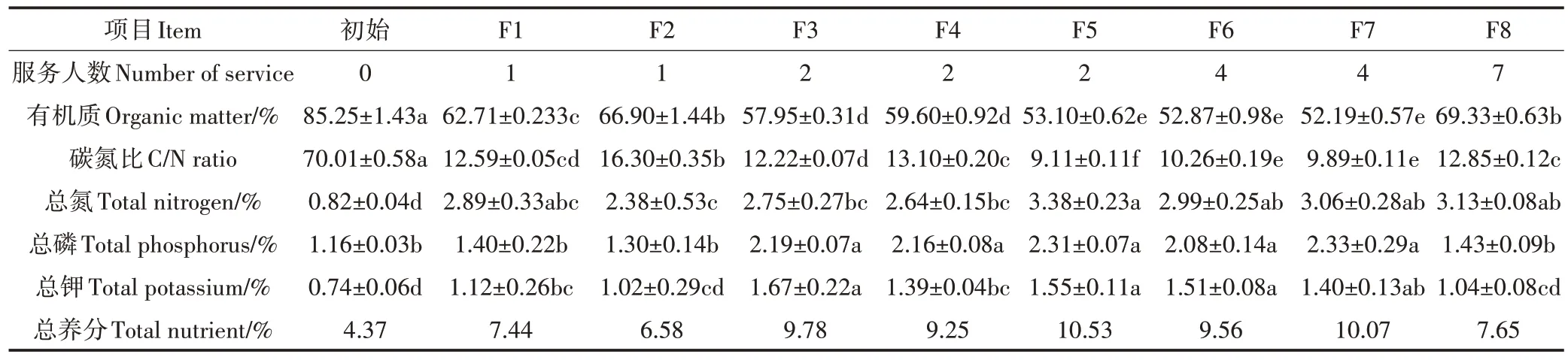
表2 试验前后发酵床垫料的营养成分含量Table 2 Content of nutrient components in the padding before and after the experiment
2.5 发酵床垫料的微生物数量变化
试验初始、第40 天及第80 天垫料中微生物(细菌、真菌和放线菌)的数量情况见图5。从图5可以看出,初始垫料的微生物数量较低,随着发酵床内不断添加粪污,垫料内微生物大量繁殖,数量均有所提升。其中真菌的数量始终在较低水平,维持在105~106数量级,细菌的数量在109~1010数量级,放线菌的数量则维持在108~109数量级。除F8和F3号发酵床外,其余发酵床垫料真菌数量呈现先增高后降低的趋势;在第40天,F7和F4号发酵床垫料的细菌数量分别为5.80×109、1.63×1010CFU·g-1,显著高于其他发酵床;除F8和F1 号发酵床外,其余发酵床垫料放线菌的数量呈现先增高后降低的趋势,其中,F1和F2号发酵床垫料放线菌总数较高。
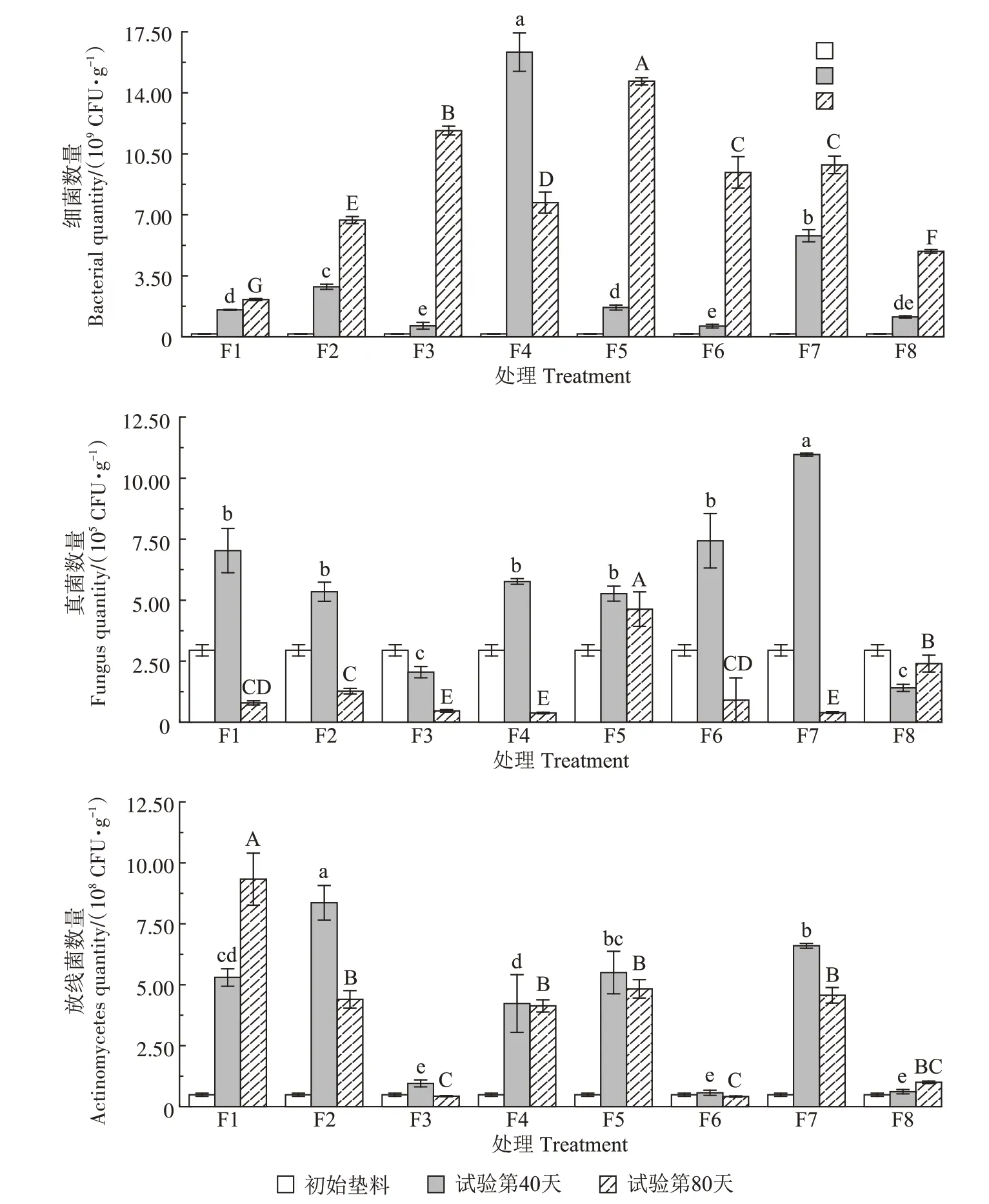
图5 试验过程中发酵床垫料微生物(细菌,真菌和放线菌)的数量变化Figure 5 Changes of the number of microorganisms(bacteria,fungi and actinomycetes)in the padding during fermentation
2.6 发酵床垫料的安全性评价
2.6.1 种子发芽指数
从图6可以看出,初始垫料(W0)的GI值为68.43%,第80天,除F1号发酵床垫料的GI值为42.77%外,其余各发酵床垫料的GI值均高于60%,其中F8、F3、F6、F7 号发酵床垫料的GI 值均高于80%,分别为87.51%、80.93%、85.54%、88.17%。
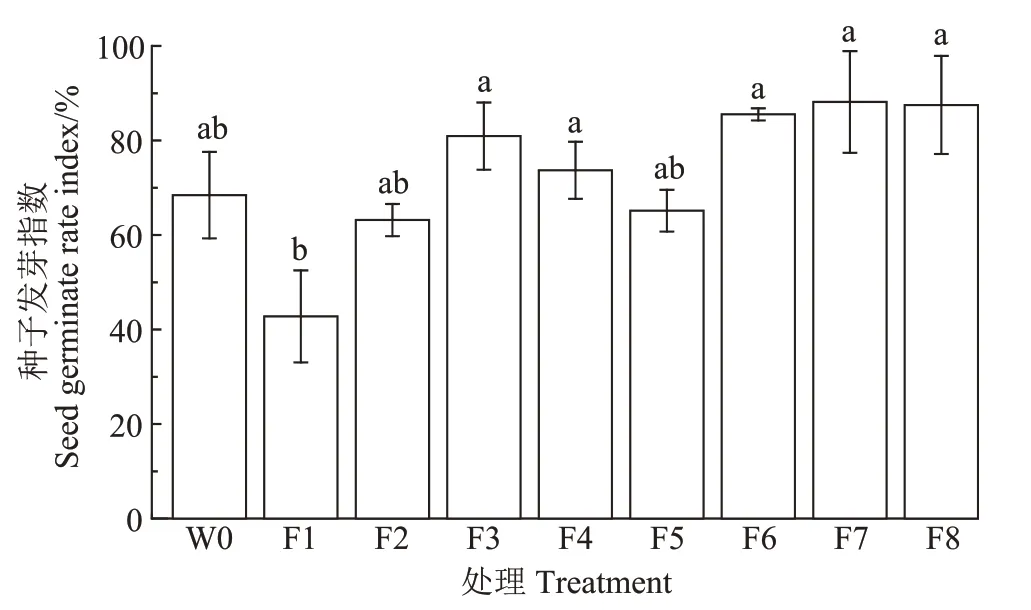
图6 发酵床垫料的种子发芽指数Figure 6 The germination index of the padding
2.6.2 发酵床垫料的粪大肠菌数,蛔虫卵死亡率和沙门氏菌
从表3可以看出,除F1号发酵床垫料的粪大肠菌数大于100 个·g-1外,其余各发酵床垫料的粪大肠菌数均小于100 个·g-1;除F1 号发酵床垫料的蛔虫卵死亡率小于95%外,其余各发酵床垫料的蛔虫卵死亡率均大于95%;所有发酵床垫料均未检出沙门氏菌。
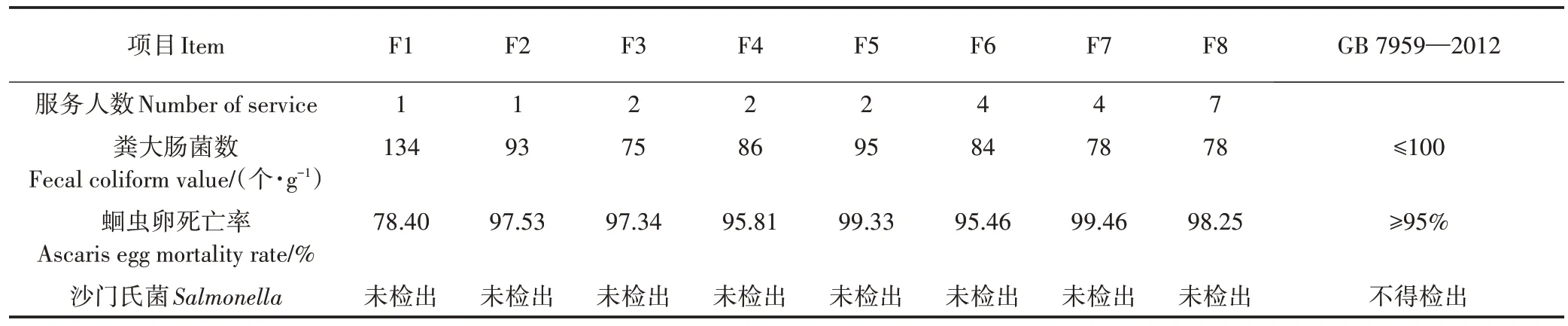
表3 发酵床垫料的病原微生物及其标准Table 3 Contents and standards of pathogen parameters in the padding
3 讨论
3.1 发酵床填料温度变化分析
在好氧发酵过程中,温度是判断发酵床发酵效果和腐熟度的重要指标,也是影响微生物活性的重要因素[17-18]。有研究表明在好氧堆肥过程中,温度对粪便中有机物的生化降解速率有显著影响,高温下有机物的残留量小于中温下有机物的残留量[19-20]。堆肥过程一般包括3个阶段:升温阶段(<45 ℃)、高温阶段(>45 ℃)和腐熟阶段[21]。李佳彬等[20]的研究表明在利用微生物异位发酵床处理农村厕所粪污过程中垫料温度从第2天开始迅速上升,在第5天时达到最高值。与微生物异位发酵床不同,不同服务人数的原位发酵床垫料温度升高趋势较为缓慢,在第40~50 天时达到最高值。本研究发现不同服务人数发酵床垫料的温度升高趋势和最高温度有所不同,其中,服务人数在7 人·d-1的F8 号发酵床垫料最高温度可达44.33 ℃,服务人数在4 人·d-1的F6 和F7 号发酵床垫料最高温度分别可达51.66 ℃和50.24 ℃,低于微生物异位发酵床垫料的最高温度[22];服务人数在2 人·d-1的F3、F4和F5 号发酵床垫料最高温度为37.46~44.33 ℃;服务人数在1 人·d-1的F1 和F2 号发酵床垫料最高温度仅为30.67 ℃和34.33 ℃。适当的服务人数及粪便投加量对维持发酵床垫料合适的含水率和C/N,以及促进微生物活动具有重要作用。有研究表明,物料含水率在45%~65%时最有利于微生物发酵[23]。通过分析发酵床垫料的含水率和C/N 发现,第50 天,F8 号发酵床垫料的C/N 为17.11,含水率高达71.67%,不利于微生物发酵;F3、F4 和F5 号发酵床垫料含水率分别为46.44%、47.06%和42.77%,基本适宜微生物发酵,但垫料的C/N 分别为35.86、37.39 和30.44,不利于微生物发酵;F6和F7号发酵床垫料的C/N 分别为24.46和26.96,含水率分别为51.50%和59.94%,较有利于微生物发酵;而F1和F2号发酵床垫料C/N 分别为36.86和40.16,含水率分别为28.89%和19.89%,也不利于微生物发酵。
3.2 发酵床垫料的pH值和EC值变化分析
通常认为pH 值6.5~8.5 为微生物好氧发酵适宜的pH 值范围[23]。本研究中,在30~60 d时部分发酵床垫料的pH值上升到8.5以上,这说明在发酵过程中微生物代谢可能产生了碱性物质,但是随着试验的进行所有发酵床垫料的pH 值最终稳定在7.36~8.49 之间。根据《有机肥料》(NY/T 525—2021)规定,pH 值为5.5~8.5 的有机肥料可施用于农田,本试验结束时所有发酵床填料的pH 值均符合该标准。EC 值表示发酵床垫料的可溶性盐含量,EC 值越高,表明垫料中可溶性盐含量越高[21]。在本研究过程中垫料的EC 值变化幅度较小,总体呈先上升后下降,最后趋于稳定的趋势。这是由于试验初期微生物代谢活跃,有机物矿化溶解作用剧烈,产生无机盐及各种离子(如磷酸盐和铵离子),引起EC 值升高,而氨挥发和无机盐的析出可能是试验后期EC值下降的原因。一般认为垫料EC 值小于9.0 mS·cm-1时不会对种子发芽产生抑制[24]。本试验结束时,所有发酵床垫料的EC 值均在2.48 mS·cm-1以下,说明盐渍化风险较小。
3.3 发酵床垫料的含水率变化分析
在好氧发酵过程中,物料的含水率是影响发酵进程及有机质降解率的主要因素[25],它不仅会影响物料堆体的氧气运输量,还可以调节发酵温度、物料孔隙率以及微生物活性等[26]。研究表明,物料的含水率维持在55%~60%的范围内,才能够保证好氧堆肥的正常进行[23]。在本研究中,不同服务人数的发酵床垫料的含水率变化情况各不相同,但总体上呈现波动上升后下降的趋势,其中服务人数为4 人的F6 和F7 号发酵床和服务人数为2人的F4和F5号发酵床在试验开始后的30~40 d 时垫料的含水率始终保持在40%以上,基本满足微生物的生长条件;服务人数为1人的2个发酵床在试验开始的40 d 后含水率仅在14.20%~32.29%,表明使用频率低、粪便投入量不足会导致垫料含水率不足,从而影响微生物活性和垫料的腐熟度[27]。值得注意的是,F8 号发酵床垫料含水率在第50天时高达71.67%,超出微生物发酵的适宜范围,这种情况容易造成垫料局部厌(缺)氧环境,同时不利于发酵床内空气扩散,从而产生大量CH4、N2O 和H2S 等污染气体[28]。
3.4 发酵床垫料的营养成分变化分析
通常来说,TN、TP、TK、有机质含量及C/N 是评价堆肥腐熟程度的指标[29]。一般认为,微生物生长发育和繁殖的最适C/N 为20~30[30]。本研究中,F8 号发酵床垫料的C/N 在第50 天时为17.11,在第80 天时为12.85,并且试验结束时TN 显著提高,而TP 和TK 提高不显著,这可能是由于F8 号发酵床户厕使用人数较多,为垫料提供了较多的氮源,导致C/N 较低。另外,在第50天时F8号发酵床垫料的含水率达到72%,含水率过高会导致好氧菌数量和氨挥发量的大幅度减少[31]。F6和F7号发酵床垫料的C/N 在第50天时分别为24.46和26.96,在第80天时降至10.26和9.89,并且试验结束时TN、TP 和TK 均显著提高。另外,在第50 天时F6 和F7 号发酵床垫料的含水率分别为51.50%和59.94%,较适宜发酵。F3、F4和F5号发酵床垫料的C/N在第50天时分别为35.86、37.39 和30.44,在第80 天时分别降至12.22、13.10 和9.11,并且试验结束时TN 显著提高,这可能是由于使用人数较少,为垫料提供的氮源不足,导致C/N 较高。F1 和F2 号发酵床垫料的C/N 在第50 天时分别为36.86 和40.16,在第80天时分别降至12.59和16.30,试验结束时TN 显著提高,TP 提高不显著,这可能是由于使用人数太少,为垫料提供的氮源严重不足,导致C/N 较高。试验结束时所有发酵床垫料的总养分含量和有机质含量均符合《有机肥料》(NY/T 525—2021)的相关规定。
3.5 发酵床垫料的微生物数量变化分析
微生物发酵床功能的发挥紧紧依赖于本土微生物及菌剂微生物的协同作用,而微生物的数量变化可以反映出发酵床的运行情况[32]。本研究中发酵床垫料的微生物以细菌为主,其数量在109~1010数量级,高于微生物异位发酵床垫料的细菌数量(107~108)[21],并且随着原位发酵床户厕的使用,细菌数量呈不断上升趋势。在第40 天时,F7 和F4 号发酵床垫料的细菌数量远高于F1 和F2 号,这是由于F7 和F4 号发酵床的粪污投加量保障了垫料更适宜的C/N,有利于细菌生长;同时,F7 和F4 号发酵床垫料的pH 值分别为8.24和8.19,较适合细菌的生长。其中,F4号发酵床垫料在第40天时达到44.67 ℃,高温可能与耐热氨化细菌的大量繁殖与抑制有关[33],而在发酵床运行后期(60~70 d),较高的垫料pH值(>8.5)抑制了氨化细菌繁殖,导致细菌数量下降。另外,在第40 天时,F8、F3、F6 和F5 号发酵床垫料的pH 值分别为8.99、8.93、9.17 和9.11,pH 值过高可能抑制细菌的生长[34]。除F8 和F3号发酵床外,其余发酵床垫料的真菌数量呈现先增高后降低的趋势,这说明试验进行到40 d左右时的垫料环境更适宜真菌繁殖,而试验后期真菌被其他微生物替代,总体始终维持在105~106数量级的较低水平[20]。放线菌的数量在试验过程中呈现先增高后降低的趋势,这是因为在高温阶段(>45 ℃)放线菌和其他嗜热菌大量繁殖,进入腐熟阶段后中温微生物繁殖并分解剩余糖类,导致放线菌和其他嗜热菌数量下降[35]。由于垫料pH 值过高(>8.5)抑制了放线菌的繁殖,导致F8、F3 和F6 号发酵床垫料放线菌数量整体较低。放线菌数量总体维持在108~109的数量级。
3.6 不同服务人数发酵床垫料的安全性评价
种子发芽试验是检测腐熟垫料对植物是否具有毒性的直接方法[23]。研究表明,当GI>50%时,认为填料对植物已基本没有毒性,当GI>80%时,认为物料已完全腐熟[36]。本研究中,初始垫料的GI 值为68.43%,说明初始垫料并未腐熟。第80 天,仅F8、F3、F6 和F7 号发酵床垫料的GI 值在80%以上,其余发酵床垫料的GI 值在42.77%~73.69%之间,这说明仅有4 个户厕的垫料在试验结束时达到了腐熟的要求。其中F1 号发酵床垫料的GI 值为42.77%,这可能是由于垫料发酵腐熟不完全,产生一定量的有机酸[37]和NH+4-N[38],对种子萌发起到抑制作用。除F1 号发酵床垫料外,试验结束时其他发酵床垫料的粪大肠杆菌数和蛔虫卵死亡率均符合《粪便无害化卫生要求》(GB 7959—2012)中的限定值,这说明经微生物发酵床充分发酵腐熟处理后农村厕所粪污具有较高的生物安全性,可实现无害化目标。对于F1 号发酵床垫料需要进一步发酵腐熟处理,否则无法对垫料进行资源化利用。
4 结论
(1)在体积大小约66 L 的发酵床中,适当的服务人数及粪便投加量对维持发酵床垫料合适的C/N、促进微生物活动具有重要作用。服务人数为4 人的发酵床垫料最高温度在50 ℃以上,确保了垫料的腐熟。
(2)发酵床垫料中的微生物以细菌为主,其数量在109~1010数量级,并始终保持较高水平。不同服务人数的发酵床垫料的含水率总体上呈先波动上升后下降的趋势。服务人数为1 人时垫料含水率过低及服务人数为7 人时垫料含水率过高均不利于发酵床运行。试验结束时所有发酵床垫料的总养分含量和有机质含量均符合《有机肥料》(NY/T 525—2021)的相关规定,并且电导率均在2.48 mS·cm-1以下,盐渍化风险较小。
(3)试验结束时F8、F3、F6 和F7 号发酵床垫料的GI 值在80%以上,达到了腐熟的要求。除F1 号发酵床垫料外,其他发酵床垫料的粪大肠杆菌数和蛔虫卵死亡率均符合《粪便无害化卫生要求》(GB 7959—2012)中的限定值。

