洞庭湖区典型沟塘反硝化脱氮能力及其影响因素
龙广丽,严星,夏永秋,刘鑫,文炯,彭芝,荣湘民*
(1.湖南农业大学资源环境学院,长沙 410128;2.中国科学院南京土壤研究所,南京 210008;3.岳阳市农业科学研究院,湖南岳阳 414000)
面源污染已经成为当今我国水环境污染的主要问题,其造成的湖泊氮、磷富营养化及地下水体污染问题日益严重[1]。研究表明,我国有60%以上的河流和湖泊因面源污染的影响,水质呈富营养状态,其中氮、磷是最常见的污染物[2]。据2020 年公布的《第二次全国污染源普查公报》显示,农业源总氮排放和总磷排放分别占水体污染物总量的46.25%和67.22%,已成为多数河流和湖泊水体的主要污染源。洞庭湖是我国第二大淡水湖,其河网区域河流众多,水流平缓,水环境承载力低。随着农业迅速发展,地区种植密度提高,施肥量增大,洞庭湖流域水系水污染问题日益突出[3]。
沟渠-池塘系统是农业生态系统中的一种湿地,是农业面源污染物的第一个汇聚点[4]。在农业面源氮进入水系之前,农田周围广泛分布的自然或人工改造的池塘和沟渠,能通过吸收、净化作用减少向下游水域输入的氮污染负荷[5-6]。研究表明,沟塘在水体氮素去除中具有巨大潜力,但同时也存在较大变异,去除率从负值到近100%不等[7-9]。水体氮素去除途径主要包括植物吸收、土壤吸附、反硝化作用(Denitrification)等,前两者都只是将氮素短暂固定,并没有从根本上将氮素从水体中去除,而反硝化作用通过将水体中氮氧化物还原成氮气从而将其永久性去除[10]。研究表明在淡水生态系统中,反硝化作用对全球脱氮的贡献约为20%[11]。因此反硝化作用被认为是水体氮素去除的主要自然途径以及氮循环的重要过程[12]。
反硝化作用是多种微生物共同作用的结果,受诸多环境因素影响。水体硝态氮(NO-3-N)浓度通常被认为是反硝化过程的主要决定因素[13-14],在NO-3-N 浓度充足的条件下,反硝化速率也会在一定程度上受到溶解性有机碳(DOC)和温度(T)的限制[15]。其他因素如水体pH、溶解氧(DO)、水力停留时间和水生植物也是影响反硝化作用的重要因素[16-17]。不同类型湿地由于水体环境不同,影响反硝化速率的因素也不同,因此深入研究影响沟塘反硝化速率的主要因素,对进一步了解沟塘脱氮能力具有重要意义。
目前,对于水体沉积物反硝化脱氮能力的研究,大部分集中于河口湿地、河流和湖泊等大型水体[18-20]。在平原河网区,农田沟塘错综密集分布,水力条件复杂,对其反硝化脱氮的研究还比较缺乏。同时,反硝化的主要产物N2在空气中的背景浓度很高,从而使得反硝化速率难以精确定量,过去测定反硝化速率的方法多为间接测定(如乙炔抑制法),这类测定方法存在较大的不确定性[21]。
基于以上问题,本研究以洞庭湖流域不同类型农田沟塘为研究对象,通过近似原位的培养方法并结合膜进样质谱法(MIMS)直接测定N2∶Ar 浓度比以量化不同沟塘的反硝化速率,并探究沟塘反硝化脱氮能力以及影响反硝化速率的主要环境因子,从而有助于更为深入地了解农田沟塘系统的氮素转化机制。本研究对评估洞庭湖区沟塘湿地氮素的去除能力具有重要意义,同时也可为洞庭湖流域水体氮污染治理提供理论支撑。
1 材料与方法
1.1 研究区概况
试验区位于洞庭湖流域的岳阳市现代农业科技园(29°26′N,113°09′E,图1)。区域气候属亚热带季风气候,春、夏季节湿润多雨,秋、冬季节干燥少雨。温度范围从1月的1 ℃至8月的36 ℃,年均气温16.4~17.0 ℃,年降水量1 100~1 400 mm。4—8月是该地区的雨季,降雨量占全年降雨量的60%以上,其中6—8月以暴雨为主。农作物种植方式主要以双季稻和稻油轮作为主,年施氮量约为400 kg·hm-2。
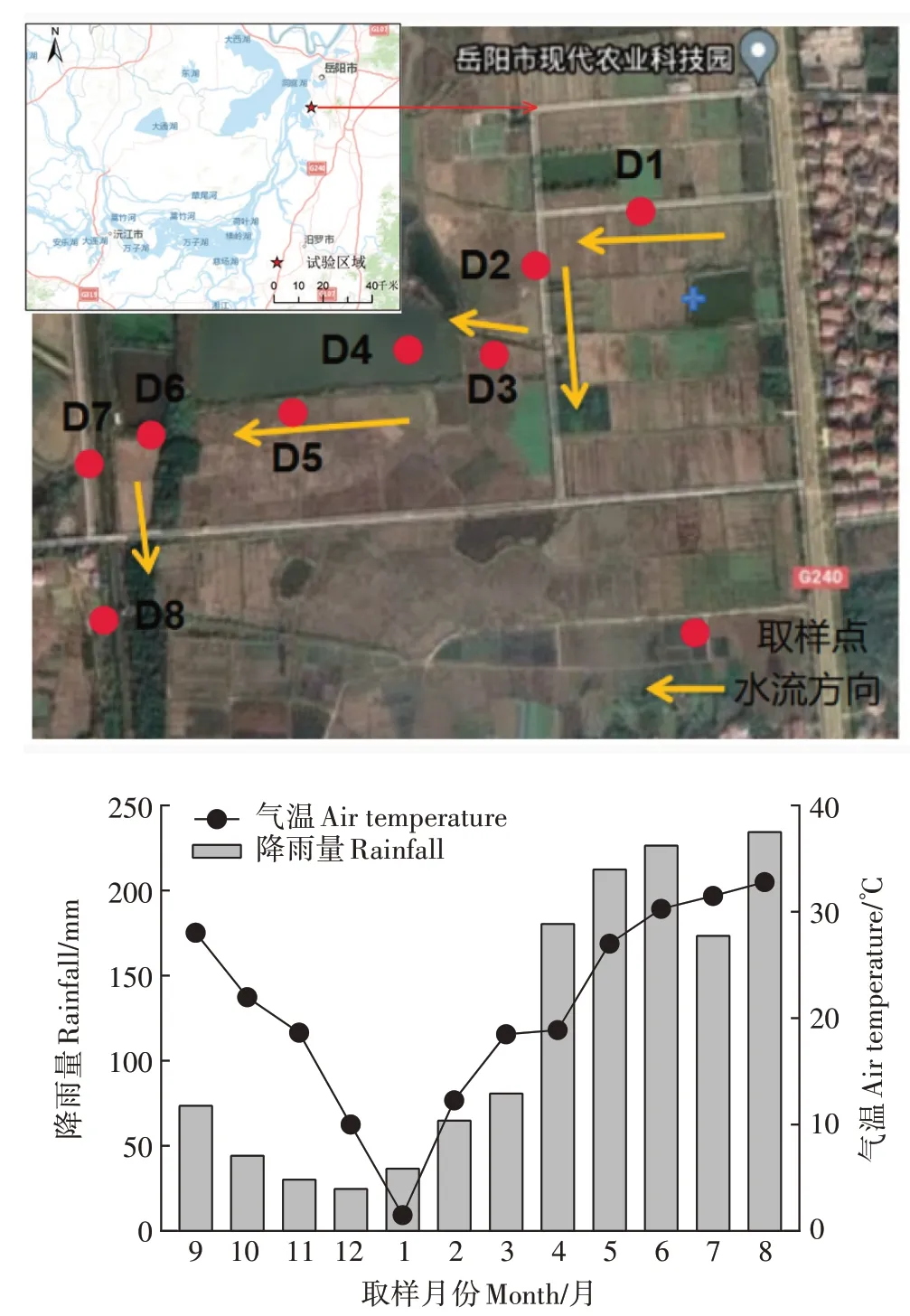
图1 采样点位置示意图及月均温度与降雨量变化Figure 1 Sampling point location diagram and monthly average rainfall and temperature variation
1.2 样品采集与理化性质分析
在2020年9月至2021年8月期间,在岳阳市现代农业科技园选取3 个农沟(水体来源主要是农田排水)D1、D2、D5,2 个支沟(多处水流汇集处,连接农沟与干沟)D3、D6,两个干沟(沟渠水体总出口,河流入水口)D7、D8,以及1 个大型池塘D4(图1),进行为期一年的监测取样(每月1 次)。其中9—11 月为秋季,12—次年2月为冬季,3—5月为春季,6—8月为夏季。试验期间,用内径8 cm、外径9 cm、高30 cm 的无扰动的沉积物采样器采集沟渠表面0~10 cm 的原位沉积物土样,用塑料桶采集50 L 原位上覆水,样品带回实验室进行室内培养。用无菌采水袋采集200 mL 上覆水进行水体理化性质测定。每个样点采集3 个重复,现场采用便携式多参数水质监测仪(YSI Exomultiparameter probe,美国)测定水样pH、DO 和温度。上覆水过0.45 μm 微孔滤膜后,用流动分析仪(Skalar Analytical,Breda,荷兰)测定滤液的铵态氮(-N)、-N 和DOC 浓度。水样总氮(TN)采用碱性过硫酸钾消解-紫外分光光度法测定,总磷(TP)采用过硫酸钾消解-分光光度法测定[22]。沉积物风干并经KCl 浸提后用连续流动分析仪测定可溶性总氮(TDN)、-N、-N 含量,沉积物风干并经去离子水浸提过滤后用TOC 分析仪(Shimadzu 1020,日本)测定DOC含量[23]。反硝化速率采用膜进样质谱法测定。
1.3 反硝化速率测定及计算方法
1.3.1 室内原位培养
为了尽量模拟沟渠原位环境,试验采用原状沉积物柱流动培养法(图2),将沟渠原位沉积物柱样垂直置于装满原位上覆水的模拟培养装置中,不盖盖子避光静置培养8~12 h 让环境稳定。培养时将实验室温度调节至与野外取样时一致。准备取样时,盖上柱样盖子,连接盖子上的进水管与出水管,进水管与位于较高处的装有原位上覆水的塑料瓶相连,以补充因取样而损失的水量,出水管则用于取样,整个培养装置保持气密性,不能有气泡产生。通电启动模拟装置中部的电动磁棒,中间磁棒的转动可以带动柱样盖子下小型磁棒的转动,以此模拟沟渠中水的流动并且混匀水样。取样时打开进水管和出水管的止水夹,等流动培养的进出水循环稳定后,以第一次取样时间为0 h,然后在第2、4、6、8 小时分别采样,每个水样取3 个平行。取样瓶为体积12 mL 的细长螺口瓶(Labco Limited,英国)。取样过程中要保证螺口瓶内没有气泡产生,如有气泡,需要重新取样。取样后用移液枪向样品中加入100 μL 饱和ZnCl2抑制微生物反应,随后采用MIMS 测定水中溶解的N2量,如不能立即测定,需将样品放入冰箱4 ℃冷藏保存[24]。
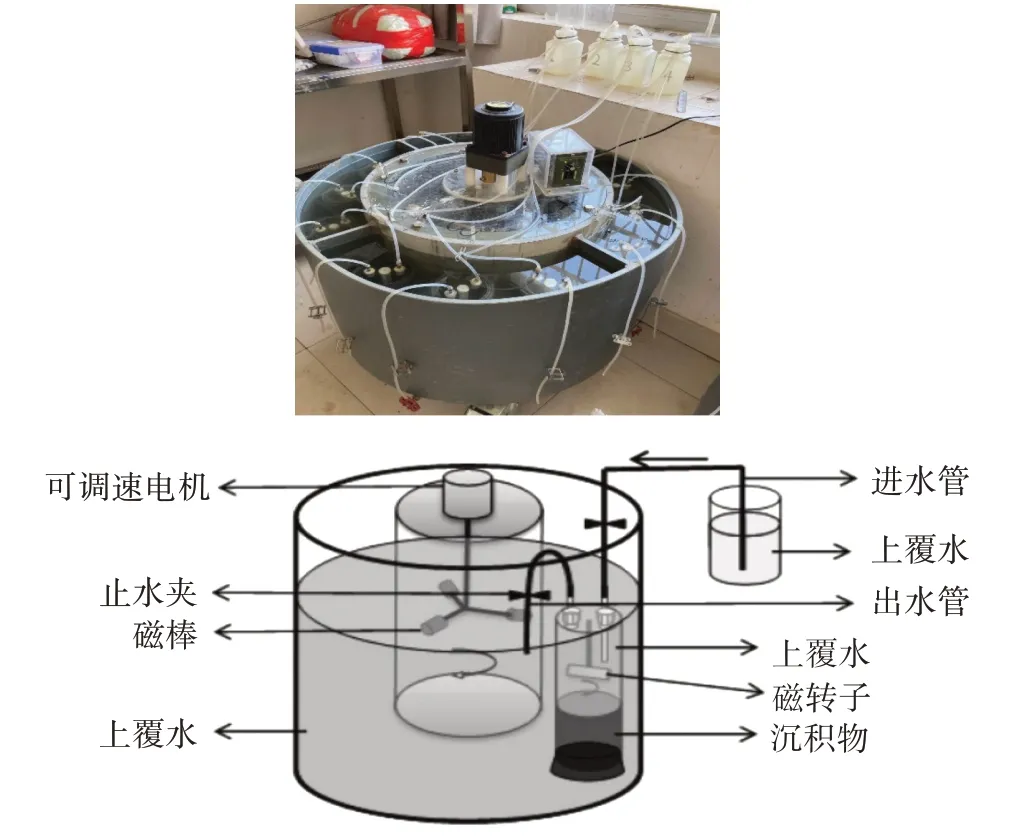
图2 室内培养系统及装置示意图[21]Figure 2 Schematic diagram of indoor culture system and device[21]
1.3.2 计算方法
(1)反硝化速率
膜进样质谱仪具有测定精度高、速度快、所需样品量少、灵敏性高的特点[25],通过MIMS测定水体中溶解N2的精度可达0.03%[26]。Ar 是惰性气体,其在大气中十分稳定,在水中的溶解度主要受盐度和温度控制,因此可以通过水样中N2∶Ar计算水样中N2的浓度。通过N2∶Ar的比值计算N2浓度([N2])的公式如下:
式中:fC为校正因子;[N2∶Ar]T和[Ar]T分别代表将标准水样的盐度及温度数值代入到Weiss方程[27]中得到的标准水样的理论值;[N2∶Ar]ST为标准水样通过MIMS测定得到的3 次结果的平均值;[N2∶Ar]SA为样品水样N2∶Ar的实测值。
利用不同取样时间的[N2]和取样时间作图,得到回归线性方程:y=ax+b,其斜率a为净氮气产生速率(μmol·L-1·h-1),再结合上覆水体积和沉积物柱样横截面积,即可计算出反硝化速率(μmol·m-2·h-1)[28]。
(2)田间年径流氮素损失率
田间年径流氮素损失率计算公式为[29]:
式中:L是氮素径流损失率,kg·hm-2·a-1;R为年径流深度,mm;Nrate为年施氮量,kg·hm-2。
(3)年脱氮量
沟塘底泥的年脱氮量可以通过下列公式计算[30]:
式中:W是脱氮量,t·a-1;A是沟塘面积,hm2,沟渠一般为农田的2%;dN是平均反硝化速率,μmol·m-2·h-1;D是径流在沟塘系统中的滞留时间,190 d(与该地区每年的降雨日数相同),池塘则为365 d。
1.4 数据处理与分析
采用Excel 2010 进行数据的统计和计算,采用SPSS 26 进行沟渠反硝化速率的数据分析,运用T 检验以及单因素方差分析(ANOVA)(LSD:样本数相同的差异性比较;Tukey:样本数不一致的差异性比较)进行数据间差异性比较。反硝化速率与环境因子的相关性通过Pearson 相关系数法进行分析,偏最小二乘回归分析(PLSR)通过SPSS 26 中的PLS 扩展模块完成。利用Excel 2010和Origin 2018软件制图。
2 结果与分析
2.1 沟塘沉积物和上覆水理化性质的变化
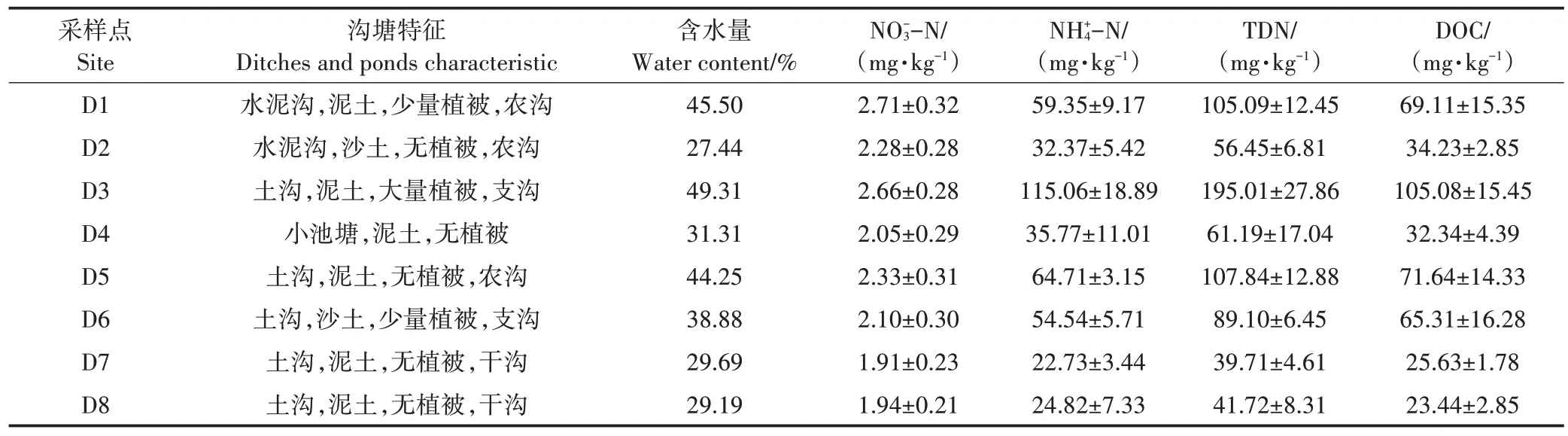
表1 沟塘特征及沉积物理化性质(均值±标准误差)Table 1 Characteristics of ditches and ponds and sedimentary physical and chemical properties(Mean±SE)
表2列出了8条沟塘上覆水各形态氮含量及其他理化指标。沟渠水体pH 总体为中性,各沟渠间差别较小。水体DO 浓度范围为4.24~7.70 mg·L-1,水体DOC 浓度和DO 浓度在D5 处最高,可能由于D5 存在一个干湿交替的过程,有研究认为干湿交替可能通过破坏土壤团聚体而增加DOC的浓度[31],并且干湿交替过程可能通过增加土壤的通气性而增加水体DO 浓度。TN和-N浓度表现出相似的特征,均以D2浓度最高,D4 浓度最低。-N 浓度则总体表现出农沟>支沟>干沟>池塘(图3)。
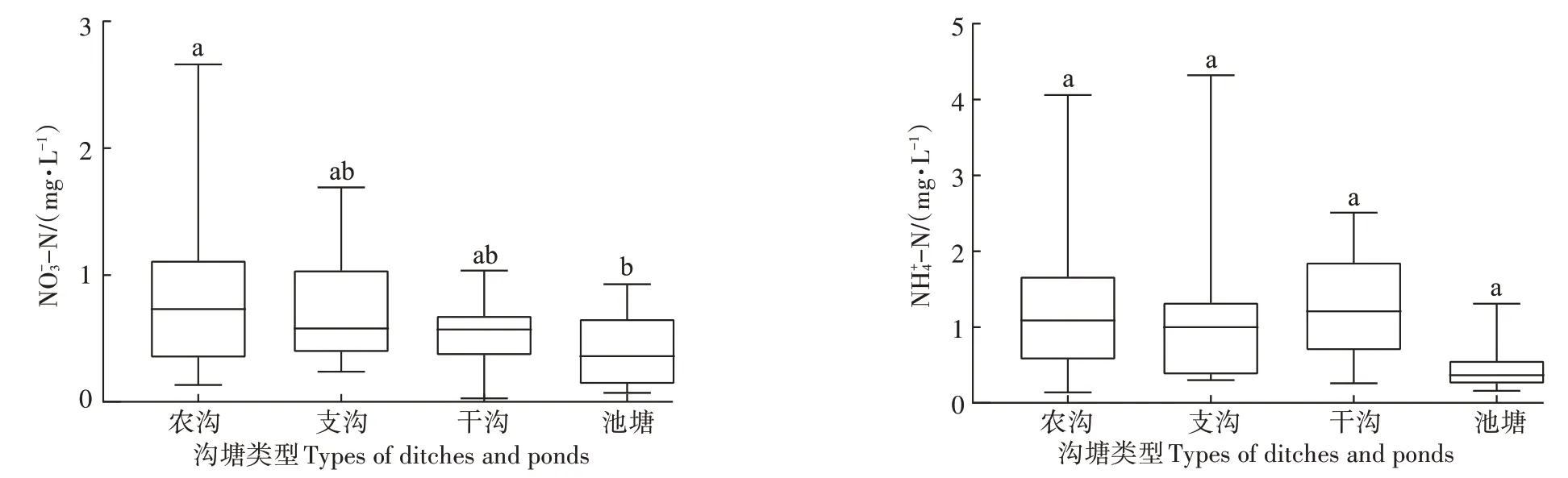
图3 不同类型沟塘上覆水-N和-N浓度的差异Figure 3 Differences between -N and -N concentrations in the overlying water of different types of ditches and ponds
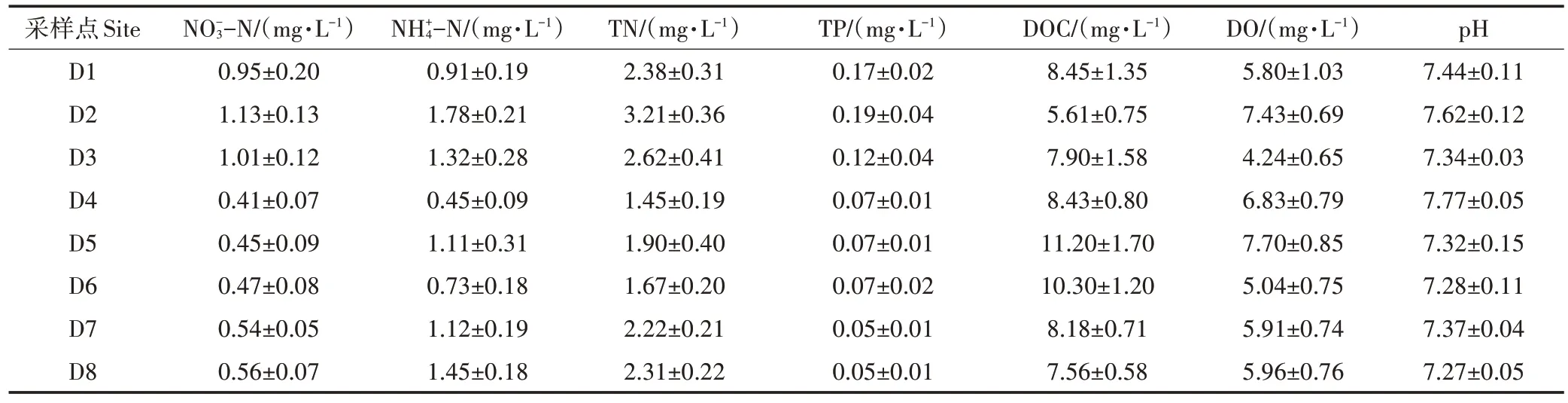
表2 上覆水各形态氮浓度及其他理化性质(均值±标准误差)Table 2 Nitrogen concentration and other physical and chemical properties of various forms of water(Mean±SE)
洞庭湖流域4—8 月是雨季,降雨量占全年的60%,4—5 月和10—11 月是农业耕作期,在人类活动和气候因素影响下,不同沟塘的水体氮素浓度会产生季节的动态变化。由图4可以看出,水体-N浓度在0.17~2.30 mg·L-1之间,D1、D2、D3的-N浓度表现为春、秋季大于夏、冬季,且春季显著大于夏季,而D4、D5却表现出冬季最大的特点,其他取样点则没有表现出显著的季节性差异。水体-N浓度在0.16~3.72 mg·L-1之间,总体表现为夏、冬季大于春、秋季。
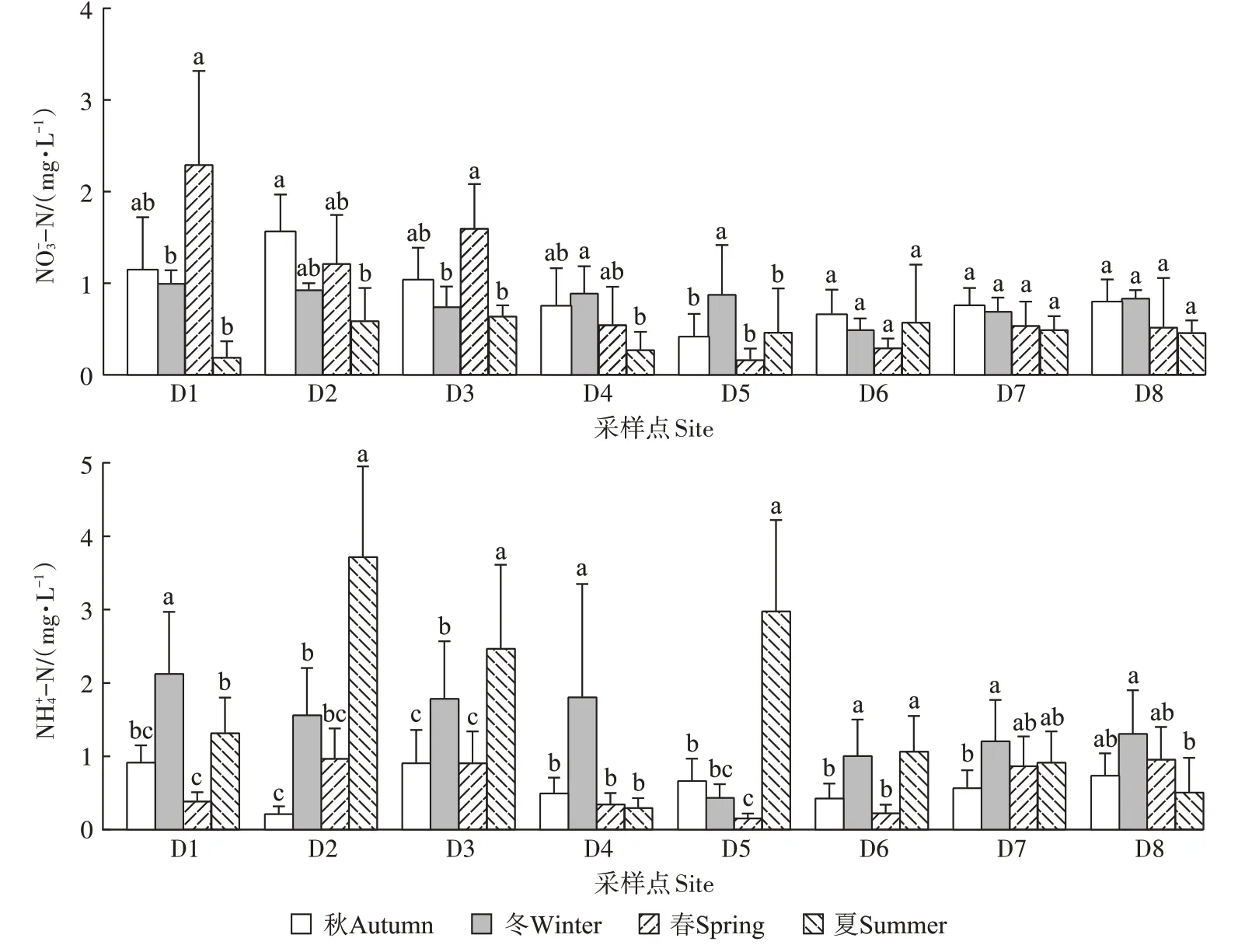
图4 沟塘上覆水-N和-N浓度的季节变化Figure 4 Seasonal variation of -N and -N concentrations in the overlying water of the ditches and ponds
2.2 反硝化速率时空变异规律
反硝化速率试验结果表明(图5),沟塘反硝化速率范围为22.10~238.02 μmol·m-2·h-1,具有明显的时空异质性,春、夏季的反硝化速率大于秋、冬季。其中反硝化速率最大值出现在2021 年春的D3,为238.02 μmol·m-2·h-1,最小值出现在2020 年冬的D5,为22.10 μmol·m-2·h-1。8 个取样点的年平均反硝化速率范围为65.7(D5)~142.4(D3)μmol·m-2·h-1(图6)。不同沟渠的平均反硝化速率存在显著性差异,D2、D3取样点反硝化速率显著大于其他取样点(D1除外)。不同类型的沟渠反硝化速率也存在差异,总体而言,有植被沟渠(D1、D3、D6)>无植被沟渠(D2、D5、D7、D8),农沟>支沟>池塘>干沟。
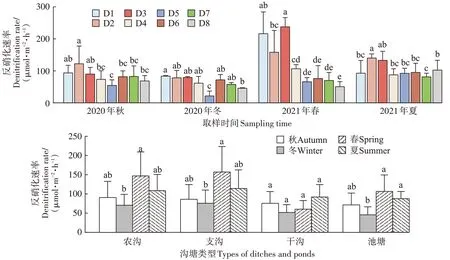
图5 沟塘反硝化速率季节变化Figure 5 Seasonal variation of denitrification rate in ditches and ponds
2.3 反硝化速率影响因素
反硝化速率与环境因子的PLSR 分析如表3 所示,其中r表示环境因子与反硝化速率的相关系数,FVIP(Variable importance plot)表示自变量(环境因子)对因变量(反硝化速率)的贡献度,FVIP越高则贡献度越大。从表3 可以看出,反硝化速率与上覆水-N浓度、TN 浓度、沉积物DOC 含量呈显著正相关,而与上覆水DOC 浓度呈显著负相关。同时可以看出上覆水-N 的FVIP值最大,即上覆水-N 对反硝化速率的影响最大,上覆水TN、DOC 和沉积物DOC、-N、-N、TDN 的FVIP值皆大于0.5,表明它们也是影响反硝化速率的重要因素。
2.4 沟塘年脱氮量及脱氮能力
根据沟塘年脱氮量公式计算得到该地区沟渠年脱氮量为0.24 t,池塘年脱氮量为0.72 t(表4)。根据《2017年湖南省水资源公报》[32]可知洞庭湖区径流系数为0.44,结合园区降雨量可得径流深度为607 mm。该地区年氮肥投入量为400 kg·hm-2,计算可得田间氮素径流损失量为28.67 kg·hm-2·a-1,结合该地区农田总面积(100 hm2)可知,该农业园区每年通过径流损失的氮素为2.87 t。计算得到沟渠反硝化脱氮系数为8.36%,池塘反硝化脱氮系数为25.08%,该农业园区每年通过沟塘湿地系统反硝化作用可去除33.44%的水体氮素输入。

表4 沟塘反硝化脱氮能力Table 4 Denitrification and denitrification capacity of ditches and ponds
3 讨论
3.1 沟塘水体氮素时空差异及其产生原因
3.2 沟塘反硝化速率变异的影响因素
总体上,不同沟塘的反硝化速率差异性较为明显,表现为有植被沟渠>无植被沟渠,农沟>支沟>池塘>干沟。植被的存在有助于提高土壤DOC 储量[39],即有植被的沟渠土壤DOC大于无植被的沟渠。PLSR分析表明(表3),土壤DOC 与反硝化速率呈显著正相关,土壤中的DOC 可以刺激土壤微生物活性,同时提供更多的电子供体,促进反硝化作用的发生[40]。并且植物的根际会释放氧气,在根部周围形成可发生硝化作用的好氧微区[41]。硝化作用产生的-N 在扩散到缺氧沉积物中时会迅速进行反硝化作用,从而促进硝化-反硝化作用的发生[42]。同时植物的根际分泌物可以提高反硝化细菌的活性。因此有植被存在的沟渠反硝化速率较大[43]。
3.3 沟塘系统的反硝化速率及脱氮能力
相较于一些湖泊、入海河口和海湾,沟塘湿地系统具有较高的反硝化速率(表5),因此通常被认为是缓解农业氮素污染的重要场所[49]。研究结果显示,沟渠的反硝化脱氮系数为8.36%,远小于池塘的25.08%(表4)。沟渠相较于池塘脱氮效率低的原因可能有以下方面:沟渠面积普遍比较小且分散,一般只有农田面积的2%,相对于大面积的河流湖泊,沟渠的脱氮能力有限,如Zhao等[17]估计太湖地区河网去除的氮约占进入河流系统的总水生氮负荷的43%,Seitzinger等[50]对美国东部16 条河流的研究发现其脱氮效率在37%~76%;大量研究证明水力停留时间长,不仅有利于沉积物沉积,而且有利于反硝化作用的发生,因此氮素去除率较高[51]。沟渠的水力停留时间短、水流速快也限制了沟渠的脱氮能力。
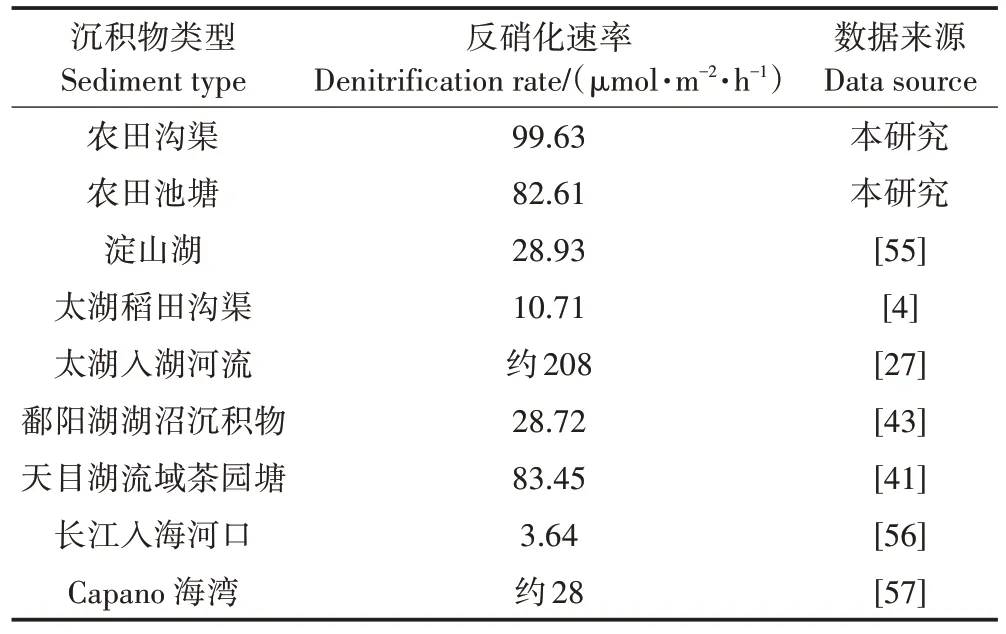
表5 不同类型沉积物的反硝化速率Table 5 Denitrification rates of different types of sediments
沟塘湿地系统去除了该地区33.44%的氮负荷,在一定程度上起到了氮素污染净化器的作用。研究表明天然湿地、水库和湖泊的平均氮素去除率分别为17.5%、31.8%和44.0%[52],Shen等[5]的研究结果指出沟塘湿地的氮素去除率平均为38.7%,Li 等[53]对长江中下游地区研究的结果得出沟塘系统可以减少稻田39%的氮素输出,表明沟塘系统在农田面源氮污染中起着重要作用。沟塘系统具有较高的反硝化速率和脱氮率,表明沟塘系统在水体氮素去除上具有巨大的应用潜力。作为农业氮素污染进入河流的渠道,沟塘湿地系统的消纳作用极为重要[54]。因此,为使沟塘湿地系统成为氮素污染的有效汇,需要进行人工管理。种植植物已被证明是减少农业排水中氮的最有效管理措施之一[8],通过种植水生植被来增强反硝化作用以及降低沟渠水体流速可增强沟渠脱氮效率。此外,合理的排灌管理对沟塘的养分去除和净化功能也十分重要,在农田周围适当增加排水沟渠和池塘,可以有效减缓农田面源污染氮负荷。
4 结论
(1)洞庭湖区流域典型沟塘反硝化速率存在显著的时空异质性,反硝化速率为22.10~238.02 μmol·m-2·h-1,春、夏季的反硝化速率大于秋、冬季。
(2)不同类型的沟塘反硝化速率有显著差异,总体表现为农沟>支沟>池塘>干沟,有植被沟渠>无植被沟渠。
(4)沟塘湿地可去除33.44%的水体氮负荷,从而大幅减少了向下游水域输入的氮污染负荷,对缓解洞庭湖流域面源污染有重要作用。

