鼠李糖脂-纳米零价铁-丙酮酸钠强化微生物厌氧-好氧降解土壤DDTs效果研究
韩悦,孙丽娜,吕良禾,王辉,苑春莉,王晓旭,吴昊
(沈阳大学区域污染环境生态修复教育部重点实验室,沈阳 110044)
滴滴涕(DDTs)作为典型的有机氯农药,因其应用范围广、能更有效地消灭害虫,从而得到了广泛应用[1]。然而,DDTs 具有高毒性、持久性和高度生物蓄积性,对环境和人类健康具有严重危害性,大部分国家已经停止DDTs 的农业使用[2]。尽管我国在1983年就已经禁止了DDTs 的生产和使用,但DDTs 的残留物及其代谢产物却一直不同程度地存在于我国土壤中[3]。相关调查显示,我国东北大部分地区农业土壤DDTs检出率大于80%,南方主要城市土壤DDTs检出率为100%,其中土壤DDTs 残留量最高达到1 824 μg·kg-1[4-5]。有效地去除土壤DDTs 及其代谢产物污染显得尤为重要。
DDTs污染土壤修复方法主要包括化学修复、物理修复、生物修复等[6]。其中,微生物修复因其成本低、操作简单、环境友好,已作为目前最具有前景的绿色修复技术之一[7],被广泛用于去除各种土壤污染物的研究[8]。虽然DDTs在好氧和厌氧条件下均可被降解,但是,DDTs毒性大、结构复杂,土壤DDTs污染的单一好氧微生物修复或厌氧微生物修复的效率均相对较低[9-10],如王晓旭等[11]用混合菌修复DDTs 污染土壤,DDTs好氧降解率最高为50.50%;Bao等[12]利用硫酸盐还原菌进行p,p′-DDT污染土壤修复,其p,p′-DDT厌氧降解率为45.80%。一些研究已经证明厌氧-好氧联合处理能进一步提高微生物对卤代烃类污染物的降解效率,但其对DDTs的污染修复还鲜见报道[13-14]。
DDTs 是典型的疏水性有机化合物(HOCs),其疏水性高、水溶性低,容易被土壤基质吸附,对土壤微生物的生物有效性相对较低[11],是土壤微生物修复效率低下的主要原因之一。鼠李糖脂(RL)可以提高HOCs 在水中的表观溶解度,进而提高土壤DDTs 的微生物有效性和微生物修复效率[15],是提高土壤DDTs 生物有效性的可行途径[16]。陈苏等[17]的研究表明,RL强化能有效促进污染土壤中DDTs的微生物降解,土壤DDTs微生物降解率提升了25.89%。
土壤中的碳源和电子供体的缺乏也是限制土壤微生物生长和活性的主要因素。向污染土壤中投加电子供体或电子受体是目前研究最为广泛的生物刺激方法,能够有效提高污染土壤的微生物修复效率。在厌氧环境下,微生物可利用外源电子使土壤DDTs还原脱氯[18]。纳米零价铁(nZVI)是一种强非特异性还原剂,目前已广泛用于持久性有机污染物的厌氧降解研究。nZVI 一方面通过降低氧化还原电位加速土壤DDTs还原脱氯过程[19],提高土壤DDTs的厌氧降解效果[20],促进土壤有机污染的厌氧修复[21];另一方面,nZVI 还可与土壤DDTs 直接作用,有效降低土壤中DDTs 的吸附浓度[22],提高土壤DDTs 的微生物有效性,促进土壤DDTs 厌氧降解。Singh 等[22]针对土壤吸附的DDT 及其残留物,通过添加nZVI 使土壤DDTr(滴滴涕及其残留物)残留浓度下降了40.00%。nZVI与有机质类电子供体丙酮酸钠(C)联合使用时,C 可连续去除nZVI 的钝化层,进一步提高nZVI 对DDTs等污染物的氧化还原能力,提高污染物的脱氯效果[23]。万金泉等[23]研究了还原脱氯的过程中C为外加电子供体对三氯苯酚脱氯效果的影响,结果表明C的添加有效提高了微生物脱氢酶活性,促进了三氯苯酚的降解。
综上所述,厌氧还原降解和好氧生物降解结合可能是提高土壤DDTs 降解率的有效途径[24-26]。目前,微生物降解土壤DDTs的研究多为厌氧降解或好氧降解,微生物厌氧、好氧联合降解的研究较少;RL、nZVI与C强化微生物降解土壤DDTs研究多为单一强化研究,RL、nZVI 与C 联合强化微生物降解土壤DDTs 鲜有研究。因此,本研究旨在通过研究RL、nZVI与C强化微生物顺序厌氧-好氧处理对土壤DDTs 降解效果的影响,筛选DDTs污染土壤的高效修复技术,并探究其修复机制,为土壤DDTs污染高效修复提供参考。
1 材料与方法
1.1 污染土壤制备
实验用土采自沈阳市沈北新区某设施农业大棚土壤,地理坐标为42°05′02.62″N,123°31′42.79″E。收集表层0~20 cm 土壤,弃去杂物后混合、风干、过2 mm 筛后混匀。称取一定量的DDTs 于丙酮溶液中并使其充分溶解,之后将其喷洒到风干的土壤中,边喷洒边搅拌至丙酮完全挥发后,于室温下放置9 个月,使污染物充分老化。将老化的DDTs污染土壤反复按照四分法充分混合后,再次按四分法取样。分析土壤理化性质如下:土壤砂粒、粉粒和黏粒占比分别为1.07%、72.82% 和26.11%;土壤有机质为54.37 g·kg-1;土壤pH 为7.27;土壤CEC 为13.09 cmol·kg-1;土壤DDTs、p,p′-DDT、p,p′-DDD 及p,p′-DDE 分别为1.02、0.92、0.04 mg·kg-1及0.06 mg·kg-1。
1.2 实验材料与实验设计
RL 购自湖州紫金生物科技有限公司;nZVI 和C购自上海阿拉丁生化科技股份有限公司;p,p′-DDT,o,p′-DDT,p,p′-DDE,p,p′-DDD 等DDTs 标准样品购自百灵威化学技术有限公司。实验用微生物为本研究团队筛选的DDTs 和PAHs 高效降解菌(Rhodococcus rhodochrous,红球菌属,放线菌门,菌种保藏号为CGMCC No.25155)。基于充分的文献调研[11,27-29]和前期实验研究,设置了RL、nZVI与C联合强化微生物顺序厌氧-好氧处理实验,RL、nZVI 与C 分别设计3个浓度,共设置37组处理,每组处理设置3个平行(见表1)。
1.3 厌氧实验与好氧实验
厌氧降解装置为50 mL 培养瓶(血清瓶)。首先将培养瓶进行高温灭菌和编号,并按实验设计分别称取10 g 制备的DDTs 污染土壤于对应编号的培养瓶中,再分别称取0.05、0.10、0.20 mg RL,0.05、0.10、0.20 g nZVI 和0.10、0.20、0.30 mmol C 于对应编号的培养瓶中。向培养瓶中填充超纯去离子水至瓶顶部以确保浸水条件,之后于密闭的厌氧手套箱(购自英国Don Whitley Scientific 公司,DG250)内抽真空至105kPa 时,向培养箱内充氮气至真空表读数略超过大气压数值为止。上述抽真空和充氮操作循环3 次后,再持续通入氮气12 h,使土壤和溶液中的氧气完全被氮气置换(氧气含量低于0.01%V/V),最后用特氟龙涂层丁基橡胶瓶塞将瓶子密封。将培养瓶密封并移出厌氧手套箱至30 ℃恒温培养箱避光培养60 d。此时,对所有处理样品进行破坏性取样并进行冻干,一半样品用于厌氧降解效果分析,另外一半样品移至10 mL 小烧杯中用于好氧降解实验:向小烧杯中添加1 mL1.0×109CFU·mL-1Rhodococcus rhodochrous降解菌并混匀,之后添加超纯去离子水使土壤含水率维持在田间持水量的60%时转入恒温恒湿培养箱中进行好氧降解,30 d 后将样品进行冻干处理待测。
1.4 DDTs的提取与净化
使用加速溶剂萃取仪(购自美国戴安公司,ASE30)对待测土壤中的DDTs 进行提取。准确称取2.5 g 样品于加入滤膜的萃取池中,继续用硅藻土装满萃取池并将上盖拧紧后置于加速溶剂萃取仪上进行萃取。萃取剂为1∶1 丙酮和正己烷混合液,萃取温度100 ℃、压力10.3×106Pa、萃取时间5 min,淋洗体积为60%萃取池体积,氮气吹脱100 s,萃取重复2 次。将萃取液移至50 mL 鸡心瓶中,在37 ℃旋转蒸发仪(购自上海亚荣生化仪器有限公司,RE-52AA)上旋转蒸发,正己烷定容,采用浓硫酸净化法,NaCl 溶液洗脱后过滤、定容待测。
1.5 土壤DDTs测定
DDTs 用气相色谱仪(购自美国瓦里安公司,VARIANCP-3800)进行测定。气相色谱分析条件:色谱柱类型,CP-sil8CB 型石英毛细管柱(30 m×0.32 mm×0.25 pm);柱温,初始温度120 ℃并保持1 min,以25 ℃·min-1升至230 ℃,再以3 ℃·min-1升至255 ℃,最后以20 ℃·min-1升至280 ℃保持5 min;载气,高纯氮气;流速,0.6 mL·min-1;进样量为1 μL。以色谱峰保留时间定性,外标法定量,方法回收率89.2%~107.1%。
1.6 数据处理
实验所获得的数据采用Origin.2018 和SPSS 统计分析软件进行数据处理和作图。
土壤某污染物降解率为处理前土壤该污染物浓度与处理后土壤该污染物浓度之差除以处理前土壤该污染物浓度。
2 结果与分析
2.1 RL、nZVI 和C 强化处理对土壤DDTs 降解效果的影响
图1 为RL、nZVI 和C 强化微生物厌氧-好氧处理90 d 时土壤DDTs 的降解率。从图1 可以看出,在强化厌氧-好氧生物处理90 d 时,RL、nZVI 和C 联合强化处理土壤的DDTs 降解率为43.05%~68.81%,分别比nZVI、C 和RL 单一强化处理高出20.09%、33.25%和27.69%;比CK 处理高出46.69%。其中RL5+nZVI0.5+C30 和RL5+nZVI0.5+C20处理对土壤DDTs 降解率最高,分别为68.81%和68.66%。不同强化处理土壤DDTs降解率为nZVI+RL+C 强化处理(53.57%)>nZVI强化处理(33.48%)>RL强化处理(25.88%)>C强化处理(20.32%),CK 处理时土壤DDTs 降解率最低,为6.88%。
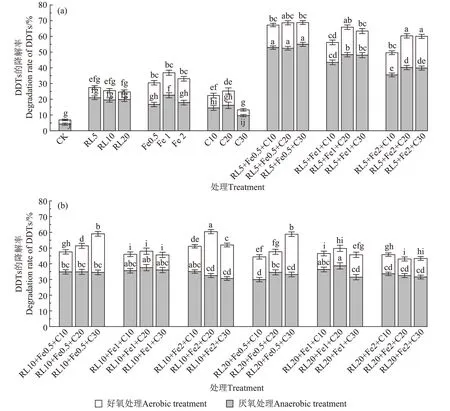
图1 RL、nZVI和C联合对DDTs厌氧-好氧降解情况Figure 1 Anaerobic-aerobic degradation rate of DDTs enhanced by RL,nZVI and C
不同浓度RL、nZVI 和C 联合强化厌氧处理60 d时,土壤DDTs 的降解率为29.94%~54.95%;不同厌氧处理土壤的DDTs 厌氧降解率为nZVI+RL+C 处理(38.11%)>nZVI 处理(20.11%)>RL 处理(19.05%)>C处理(13.40%)>CK(4.19%);后续好氧生物放大处理30 d 的土壤DDTs 降解率为9.61%~27.90%,厌氧降解率与好氧降解率比值为3.07,不同强化处理土壤的厌氧/好氧降解比为nZVI+RL+C 处理(3.07)>RL 处理(2.93)>C 处理(2.07)>CK(1.56)>nZVI 处理(1.32)。其中,RL5+nZVI0.5+C30 联合处理土壤的DDTs 厌氧降解率最高,为54.95%,比nZVI、RL 和C 强化处理分别提高了1.88、1.87 倍和3.10 倍,其厌氧降解率与好氧降解率比值为3.97。
2.2 RL、nZVI和C强化处理对土壤DDTs组成的影响
RL、nZVI 和C 强化厌氧、好氧处理90 d 时(见图2),土壤中p,p′-DDT、p,p′-DDE 的残留浓度明显降低(P<0.05),不同处理之间土壤p,p′-DDT、p,p′-DDD 和p,p′-DDE残留浓度所占比例分别为23.19%、69.44%和7.37%。不同强化处理后土壤p,p′-DDT 残留浓度由初始的923.03 μg·kg-1降低为28.59~811.68 μg·kg-1,p,p′-DDE 的残留浓度由初始的59.53 μg·kg-1降低为23.71~50.10 μg·kg-1;不同强化处理后土壤p,p′-DDT 降解率为12.06%~96.90%,p,p′-DDE 降解率为3.33%~60.87%。但土壤p,p′-DDD的残留量不减反增(P<0.05),不同强化处理后土壤p,p′-DDD 残留浓度由初始的35.84 μg·kg-1增高到100.15~491.23 μg·kg-1。其中,RL5+nZVI0.5+C30强化处理土壤的p,p′-DDT和p,p′-DDE残留浓度最低,分别为28.59 μg·kg-1和23.71 μg·kg-1,比CK 处理土壤分别降低了783.09 μg·kg-1和32.73 μg·kg-1,比RL 处理土壤分别降低了479.60 μg·kg-1和18.57 μg·kg-1,比nZVI 处理土壤分别降低了109.36 μg·kg-1和24.48 μg·kg-1,比C 处理土壤分别降低了539.34 μg·kg-1和14.65 μg·kg-1;土壤p,p′-DDT 和p,p′-DDE 降解率最高,分别为96.90%和60.87%,比CK 处理土壤分别提高84.84%和40.29%,比RL处理土壤分别提高51.95%和36.51%,比nZVI处理土壤分别提高11.85%和47.42%,比C 处理土壤分别提高65.50% 和31.89%。而p,p′-DDD 残留浓度为491.23 μg·kg-1,分别比CK、RL、C 和nZVI 处理土壤增加了391.08、286.85、266.83 μg·kg-1和256.77 μg·kg-1。
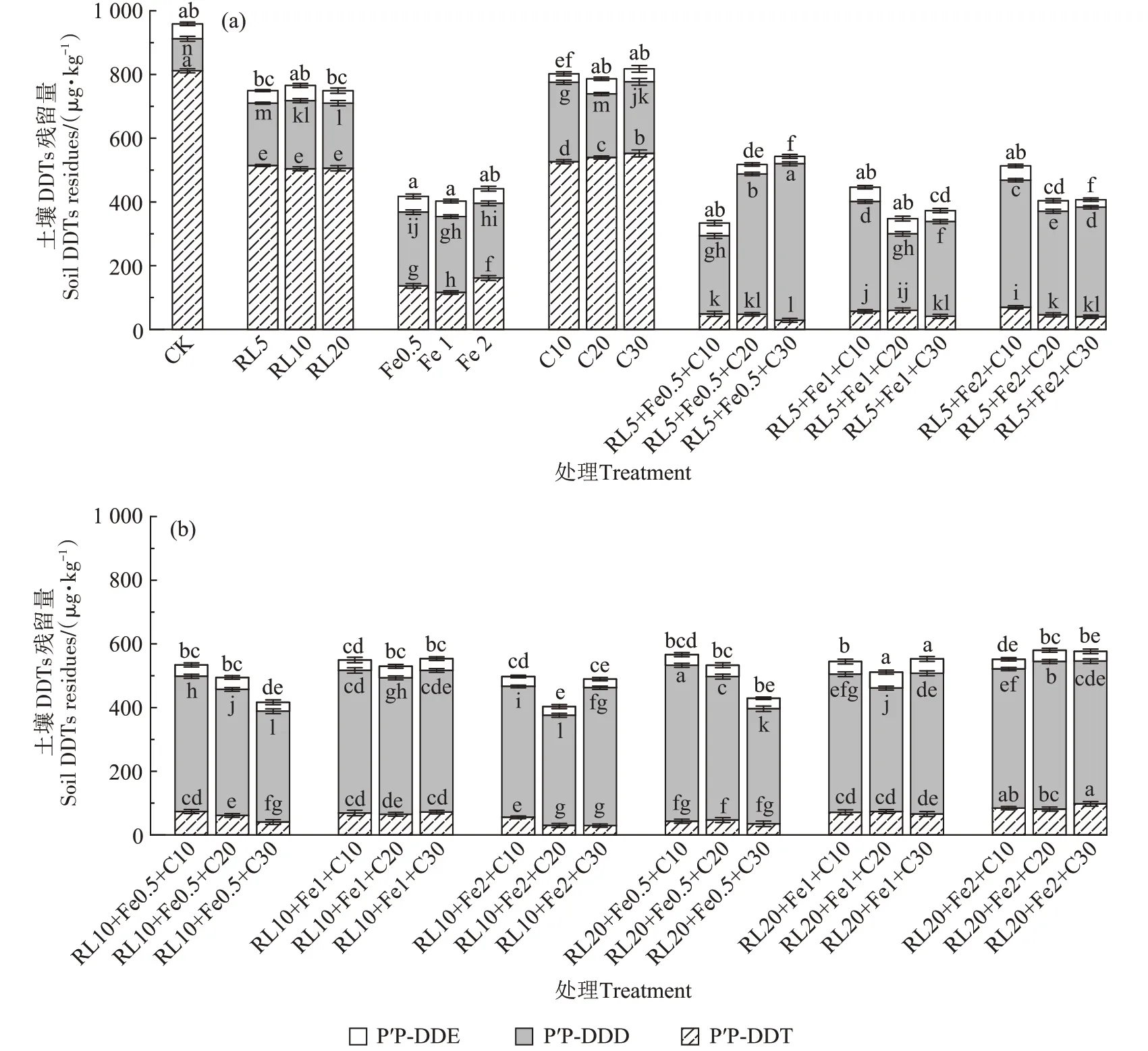
图2 RL、nZVI和C强化厌氧-好氧处理土壤DDTs残留量Figure 2 Residues of DDTs in the soil after RL,nZVI and C enhanced anaerobic-aerobic treatment
在厌氧处理阶段(图3),不同处理土壤p,p′-DDT 残留浓度显著降低(P<0.05),由初始的923.03 μg·kg-1降低为60.05~828.02 μg·kg-1,不同处理土壤p,p′-DDT 残留浓度依次为RL+nZVI+C(98.74 μg·kg-1)<nZVI(183.98 μg·kg-1)<RL(648.82 μg·kg-1)<C(654.69 μg·kg-1)<CK(828.02 μg·kg-1);土壤p,p′-DDE 残留浓度降低的幅度相对较小,由初始的59.53 μg·kg-1降低为29.68~54.53 μg·kg-1,p,p′-DDE 残留浓度依次为RL+nZVI+C(29.68 μg·kg-1)<nZVI(48.74 μg·kg-1)<RL(48.82 μg·kg-1)<C(48.90 μg·kg-1)<CK(54.53 μg·kg-1);其中,RL5+nZVI0.5+C30强化处理土壤的p,p′-DDT、p,p′-DDE 降解率最高,分别为93.49%、50.15%,厌氧-好氧降解比分别为6.70 和5.00。而土壤p,p′-DDD 残留浓度显著增高(P<0.05),由初始的35.84 μg·kg-1增高到98.47~569.22 μg·kg-1,土壤p,p′-DDD残留浓度依次为RL+nZVI+C(569.22 μg·kg-1)>nZVI(562.84 μg·kg-1)>C(207.74 μg·kg-1)>CK(111.14 μg·kg-1)>RL(108.21 μg·kg-1)。
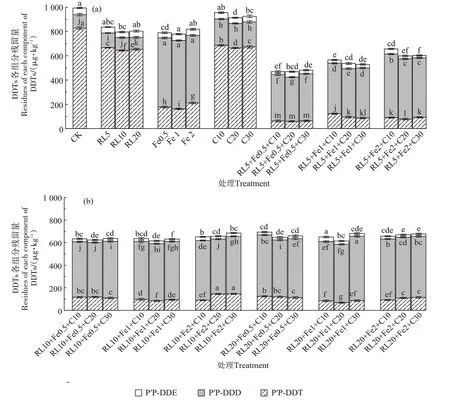
图3 厌氧处理土壤DDTs各组分的残留浓度Figure 3 Residual concentrations of DDTs components in anaerobic soil
在后续的好氧处理阶段(图4),土壤p,p′-DDD残留浓度降低得最为显著(P<0.05),好氧降解率为31.00%~480.00%。不同强化处理土壤的p,p′-DDD好氧降解率为RL+nZVI+C(301.03%)>nZVI(234.68%)>RL(219.35%)>C(53.26%)>CK(31.00%);其次为土壤p,p′-DDE,好氧降解率为0.63%~48.00%,不同强化处理土壤p,p′-DDE好氧降解率为RL+nZVI+C(27.55%)>C(27.06%)>nZVI(25.79%)>RL(13.54%)>CK(5.85%);土壤p,p′-DDT的残留浓度降低得最少,其好氧降解率为0.84%~20.65%,不同强化处理土壤的p,p′-DDT 好氧降解率为RL+nZVI+C(16.93%)>RL(16.62%)>C(15.19%)>nZVI(4.46%)>CK(1.77%)。其中,RL5+nZVI0.5+C30联合强化处理土壤的p,p′-DDD、p,p′-DDE和p,p′-DDT 好氧降解率均为最大,分别为480.00%、48.00%和20.65%。
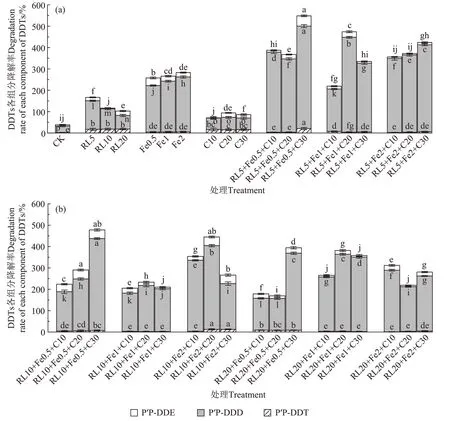
图4 好氧处理土壤DDTs各组分的降解情况Figure 4 Degradation of various components of DDTs in soil under aerobic treatment
3 讨论
3.1 土壤DDTs自然衰减修复
土壤中存在DDTs 自然衰减现象,能够通过土壤自然发生的稀释、挥发、吸附等物理作用,化学氧化与还原作用,以及生物好氧降解、生物厌氧降解作用等,使土壤中DDTs的数量、移动性降低,从而自然减少土壤中DDTs 的毒性或浓度[19]。在本实验中,空白处理(CK)90、60 d 和30 d 时土壤DDTs 的去除率很低,分别为6.88%、4.19%和2.69%。该结果一方面说明DDTs污染土壤中存在DDTs土著降解菌,具有一定的DDTs自然衰减能力,但土壤中DDTs土著厌氧降解菌和好氧降解菌丰度低、活性差,DDTs 自然降解能力弱,DDTs 的自然衰减效果很差;另一方面也说明了DDTs的高氯化结构及其生物难降解性、环境持久性。有研究人员研究了土壤自然衰减对污染土壤DDTs降解率的影响,结果表明,土壤自然的生物降解作用对土壤DDTs 的降解率极低,通过自然衰减修复土壤DDTs 需要更长的时间,与本实验的研究结论一致[30-31]。
3.2 土壤DDTs顺序厌氧-好氧微生物降解
DDTs含有苯环和氯元素,具有环境持久性、生物毒性和生物难降解性。虽然土壤DDTs具有微生物可降解性,在有氧和厌氧环境下均可被微生物降解,在厌氧情况下,DDTs 通过生物共代谢作用发生还原性脱氯,烷基上的氯以氯化氢的形式被脱去,在有氧条件下,DDTs 会被好氧微生物降解,从而使苯环裂解[32]。但DDTs 好氧微生物降解生成的毒性更大、更难降解的中间代谢产物p,p′-DDE 会在土壤中产生积累,进而抑制p,p′-DDT 的进一步降解,致使土壤DDTs 好氧降解率相对较低[33],在土壤DDTs 微生物好氧降解过程中,p,p′-DDE 的产生与积累已被认为是抑制土壤DDTs 微生物好氧降解速率的关键,相关研究表明,好氧和厌氧条件下分别降解DDTs,厌氧条件下降解效果较好[10]。此外,在有氧环境中,加氧酶或水解酶的脱氯难度随着氯化程度的增加而增大[34];在厌氧环境下,通过微生物还原脱氯可有效避免中间代谢产物p,p′-DDE 产生、积累及其对微生物的毒性,有利于DDTs 降解菌的生长,提高土壤DDTs 降解率[35]。通过微生物厌氧与好氧联合处理,DDTs 可能完全被矿化,从而有效提高土壤DDTs 污染修复效率[36]。
本研究结果表明,顺序厌氧-好氧处理(90 d)时,CK 处理土壤DDTs 降解率为6.88%,分别比单一厌氧(60 d)、单一好氧(30 d)处理高出2.69%、4.19%;RL、nZVI 和C 各个单一强化、联合强化土壤DDTs 降解率分别为25.88%、33.48%、20.32%和53.57%,分别比单一厌氧处理(60 d)高出6.76%、14.43%、6.92% 和15.46%,分别比单一好氧(30 d)处理高出19.11%、19.05%、13.40%和38.12%;表明经过不同处理后,与单一厌氧、单一好氧处理相比,顺序厌氧-好氧处理微生物降解DDTs 效果更好,本实验与史娜[24]对DDT微生物降解研究相一致,即厌氧-好氧处理在DDT 生物降解方面具有优势,可以很好地降解土壤DDTs 污染,DDT 在厌氧情况下转化生成二氯二苯基甲烷,再经过一系列的还原脱氯反应,而后在好氧情况下被其他微生物分解,从而实现DDTs有效降解。
RL、nZVI和C 联合强化微生物顺序厌氧-好氧联合处理显著提高了土壤DDTs 降解率,尤其是其中p,p′-DDT 组分降解率(P<0.05)。而且,土壤DDTs 和p,p′-DDT 组分厌氧降解率分别占顺序厌氧-好氧处理土壤DDTs 降解率的75.80%和95.20%,厌氧去除率明显高于好氧去除率,表明厌氧处理对提高土壤DDTs 去除率具有重要作用,并且厌氧脱氯是土壤DDTs降解的关键步骤,与Jin等[35]和Liang等[37]的研究结论一致。伴随RL、nZVI 和C 联合强化厌氧处理土壤的p,p′-DDT浓度大幅降低和p,p′-DDD浓度的大幅增加,土壤p,p′-DDE 浓度降低幅度很小,显示RL、nZVI和C的联合处理刺激土壤p,p′-DDT还原脱氯时,避免了顽固代谢产物p,p′-DDE 的产生与积累[38-39],增强了土壤DDTs 厌氧-好氧降解率。微生物厌氧、好氧处理DDTs 降解效果也受土壤中DDTs 降解菌组成的影响,据Bajaj 等[40]对IITR03(红球菌)修复DDTs 污染土壤研究可知,IITR03 对土壤DDTs 降解率最高可达50%~60%,属于DDTs好氧降解的优势菌种,具有儿茶酚1,2-双加氧酶活性。梭状芽胞杆菌是DDTs 厌氧降解环境中的优势菌种,对DDTs 有很好的降解能力,同时具有DDTs降解基因[41]。
3.3 土壤DDTs的RL、nZVI、C强化降解
在RL-DDTs 体系中,不同浓度RL 强化顺序厌氧-好氧处理均显著提高了土壤DDTs 降解率(P<0.05)(见图1)。RL 添加量为0.05 mg·kg-1时,土壤DDTs 的厌氧-好氧降解率最高,达到27.47%,随RL添加量增加到0.10 mg·kg-1和0.20 mg·kg-1时,土壤DDTs 的厌氧-好氧降解率依次降低至25.48%和24.68%。这主要与RL 对土壤DDTs 的显著增溶作用和对土壤DDTs生物有效性的影响有关,低浓度RL强化对土壤DDTs的降解效果更好,一方面是低浓度RL对DDTs的增溶作用更强、生物可利用度更大,进而土壤DDTs 的微生物降解率更大[42]。RL 在低浓度下易形成凝聚体,能更显著地降低水表面张力,使吸附在土壤颗粒上的DDTs能够更好地分离,进而提高DDTs的水溶性和生物有效性[43]。而高浓度RL 胶束对疏水有机物的封存会导致污染物的生物有效性降低[44];另一方面与高浓度RL 的微生物毒性对DDTs 降解的抑制作用有关[45]。高浓度的RL 对微生物具有一定的毒性,对土壤微生物及其酶活性具有抑制作用[46]。RL浓度大于5 mg·kg-1时,可对微生物产生毒害[47]。本实验与Wang 等[7]利用RL 强化土壤中DDTs 微生物修复效果的研究结果相一致,即低浓度(5 mg·kg-1)RL 提高了球形节杆菌修复土壤DDTs 降解效果,150 d 的DDTs 降解率提高了60.70%。其原因可能是RL 能显著降低水的表面张力,提高土壤DDTs 的溶解度和生物有效性,进而提高土壤DDTs 微生物降解率[48]。同时细菌细胞能够及时消耗RL胶束分馏的疏水有机物以保持微生物与液相中的疏水有机物稳定接触,提高土壤有机污染物生物有效性[48]。
在nZVI-DDTs 体系中,不同浓度nZVI 强化处理对土壤DDTs降解的促进作用更明显(P<0.05)。随着nZVI 浓度逐渐升高,土壤DDTs 的厌氧-好氧降解率呈现先增大后降低,从添加0.50%nZVI 时DDTs 降解率为30.48%,增加到1.00% nZVI 时降解率为36.88%,再降低到2.00%ZVI 时降解率为33.07%。这主要是由于nZVI 是较强的还原剂,可降低氧化还原电位为生物厌氧降解提供有利的生态电位[49],同时nZVI 还可为DDTs 降解菌提供有效的电子供体[50],促进土壤DDTs 的还原脱氯。但高浓度nZVI 被氧化会释放多余电子,并将电子转移到目标物质,进而导致nZVI 表面钝化,限制进一步的电子转移。此外,高浓度的nZVI 还可破坏细胞结构,引起细胞表面应激反应,对微生物产生一定的毒性[19],进而抑制土壤DDTs的微生物降解。Kishore 等[19]在研究nZVI 颗粒修复DDT 污染土壤中也出现了与本实验相似的现象,随nZVI 处理浓度由低到高,土壤DDTs 降解率呈现先升后降,高浓度nZVI 对DDTs 降解有一定抑制作用,与本实验的研究结果相符。
在C-DDTs 体系中,随C 处理浓度的增加,土壤DDTs 降解率也呈现先增后降形式,表明添加0.20 mmol·kg-1C对DDTs进行强化效果最好,土壤DDTs的厌氧-好氧降解率为25.28%。添加C可为还原脱氯的过程提供所需电子,促进微生物生长及活性,能够有效地促进DDTs 还原脱氯,增强DDTs 污染土壤中土著微生物降解DDTs 的效果,这与万金泉等[23]报道的C 作为电子供体不但能够促进有机氯化物的还原脱氯效果,还可以提高微生物体内基质代谢以及脱氢酶的活性,从而提升微生物修复效率是一致的。此外C还可以通过增加功能微生物群落的相对丰度来改变细菌和古菌群落,这些功能微生物群落可能参与脱氯和土壤氧化还原过程,从而加强它们之间的联系[51]。
在RL-nZVI-C-DDTs 体系,RL+nZVI+C 联合强化更大幅度地提高了土壤DDTs 降解率(P<0.05),特别是RL5+nZVI0.5+C30 组合处理(90 d),土壤DDTs的降解率最高,为68.81%,比RL、nZVI 和C 各个单一强化分别提高42.93%、35.33%和48.49%。与前人相关研究对比,土壤DDTs 的微生物去除率也明显提高(P<0.05)[1,41]。相关研究表明,添加丙酮酸酯等电子供体与功能微生物相互作用能够有效促进土壤五氯苯酚等有机氯农药的降解,并且调节厌氧降解与土壤自然氧化还原过程的相互作用[51]。此外,研究人员也发现nZVI和泡沫承载表面活性剂能够很好地修复土壤DDT 污染,且随着表面活性剂泡沫浓度的增加,对nZVI的迁移以及DDT的降解有明显促进作用[52]。
其中,RL5+nZVI0.5+C30 组合处理土壤DDTs 的降解率(68.81%)分别是0.05 mg·kg-1RL 单一强化(27.47%)、0.50% mg·g-1nZVI 单一强化(30.48%)和0.30 mmol·kg-1C(13.29%)单一强化DDTs 降解率的近似之和,这不仅是由于RL、nZVI和C能够发挥其各个强化作用,更重要的是与RL、nZVI和C三者之间的相互协同作用有关。nZVI 在为DDTs 污染土壤创造良好还原环境的同时,本身作为电子受体或供体,通过与污染物之间转移电子,将污染物降解[53],促进土壤有机污染修复[21]。而C 作为一种外源电子供体,会刺激土壤微生物生长和脱氯微生物活性,同时影响土壤污染物的还原降解过程,进而增强对DDTs 还原脱氯的能力[51]。Singh等[22]的研究表明,nZVI与C联合能够发挥其电子受体与电子供体的协同作用,在为DDTs污染土壤创造良好还原环境的同时,加速土壤颗粒吸附的DDTr 与电子受体和电子供体之间的电子转移,实现土壤DDTs的还原脱氯。此外,DDTs等污染物与nZVI反应之后会吸附在nZVI颗粒表面占据表面活性位点,所产生的钝化层会阻碍nZVI 与DDTs 的接触,导致去除率降低。添加C等与其相互作用,可以连续去除钝化层,增强了nZVI的厌氧还原能力,进一步提高DDTs的降解率[54]。
RL 在nZVI 上有良好的附着现象,nZVI 与RL 之间可通过其表面的FeO 基团氢键与羧酸基团相互作用从而更好地降解DDTs 等有机氯化合物[55-56]。将RL涂覆在nZVI表面,再与C结合使用可明显去除nZVI表面的钝化层,大幅度提高nZVI的迁移率,减弱团聚,促进污染物降解[57]。
4 结论
(1)鼠李糖脂(RL)、纳米零价铁(nZVI)和丙酮酸钠(C)联合强化微生物顺序厌氧-好氧处理可显著提高土壤DDTs 降解率(P<0.05),其中,RL5+nZVI0.5+C30 联合处理的土壤DDTs、p,p′-DDT和p,p′-DDE降解率(90d)最高,分别为68.81%、96.90%和60.87%,比RL处理分别提高42.93%、51.95%和36.51%,比nZVI处理分别提高35.33%、11.85%和47.42%,比C处理分别提高48.49%、65.50%和31.89%;土壤p,p′-DDT 和p,p′-DDE 残留量(90 d)最低,分别为28.59 μg·kg-1和23.71 μg·kg-1。
(2)RL、nZVI 和C 联合强化厌氧处理可有效刺激土壤DDTs 还原脱氯,增强土壤微生物的DDTs 降解能力。RL5+nZVI0.5+C30 联合厌氧处理60 d 时土壤DDTs、p,p′-DDT 和p,p′-DDE 降解率最高,分别为54.95%、93.49%和50.15%,分别占RL、nZVI 和C 联合强化厌氧-好氧处理(90 d)时土壤DDTs、p,p′-DDT和p,p′-DDE 降解率的79.86%、96.48%和82.39%,其厌氧-好氧降解比分别为3.97、6.70和5.00。
(3)RL、nZVI 和C 的相互作用,在为土壤DDTs 还原降解提供良好的还原生态位的同时,加速土壤颗粒吸附的DDTr 与电子受体和电子供体之间的电子转移,加快nZVI 表面钝化层的去除和nZVI 的迁移率,促进土壤DDTs的还原脱氯,同时避免了难降解、毒性更大的p,p′-DDE 的产生与积累,并为后续好氧降解奠定基础。

