布拉氏酵母菌散与硫糖铝口服混悬液联合治疗慢性胃炎的疗效及对血清SS、EGF、GAS、肠道菌群的影响
林 莉,刘佳昊,蔡添才,王 蕾,朱建文,单长鹤,范白燕
(中国人民解放军陆军厦门特勤疗养中心a.疗养二科; b.疗养八科; c.门诊部; d.疗养一科,福州 361001)
慢性胃炎属于临床常见的消化系统疾病,需及时采取有效治疗措施控制患者病情进展,否则发生胃黏膜恶性病变的风险将大幅增加,严重危害患者生命健康[1-2]。目前,尚无针对慢性胃炎的特效药物,临床多采取以抑酸、抗炎、促进胃动力为目的的治疗手段。硫糖铝口服混悬液是一种胃黏膜保护剂,其在有效减轻胃黏膜损伤的同时不影响胃酸分泌功能,能在一定程度上减轻慢性胃炎的临床症状,控制病情进展,但疗效不甚理想[3]。有研究[4]表明,肠道菌群紊乱是慢性胃炎的重要致病机制之一。布拉氏酵母菌散属于真菌制剂,其主要作用是纠正失调的肠道菌群[5]。现阶段暂无关于硫糖铝口服混悬液联合布拉氏酵母菌散治疗慢性胃炎的临床研究,本研究旨在探究该联合疗法的效果,报告如下。
1 资料与方法
1.1 一般资料
选取中国人民解放军陆军厦门特勤疗养中心2018年7月-2021年7月收治的慢性胃炎患者114例,按照随机数字表法分为联合组和常规组,各57例。2组一般资料比较差异无统计学意义(P>0.05),见表1。本研究经本院伦理委员会审核批准。
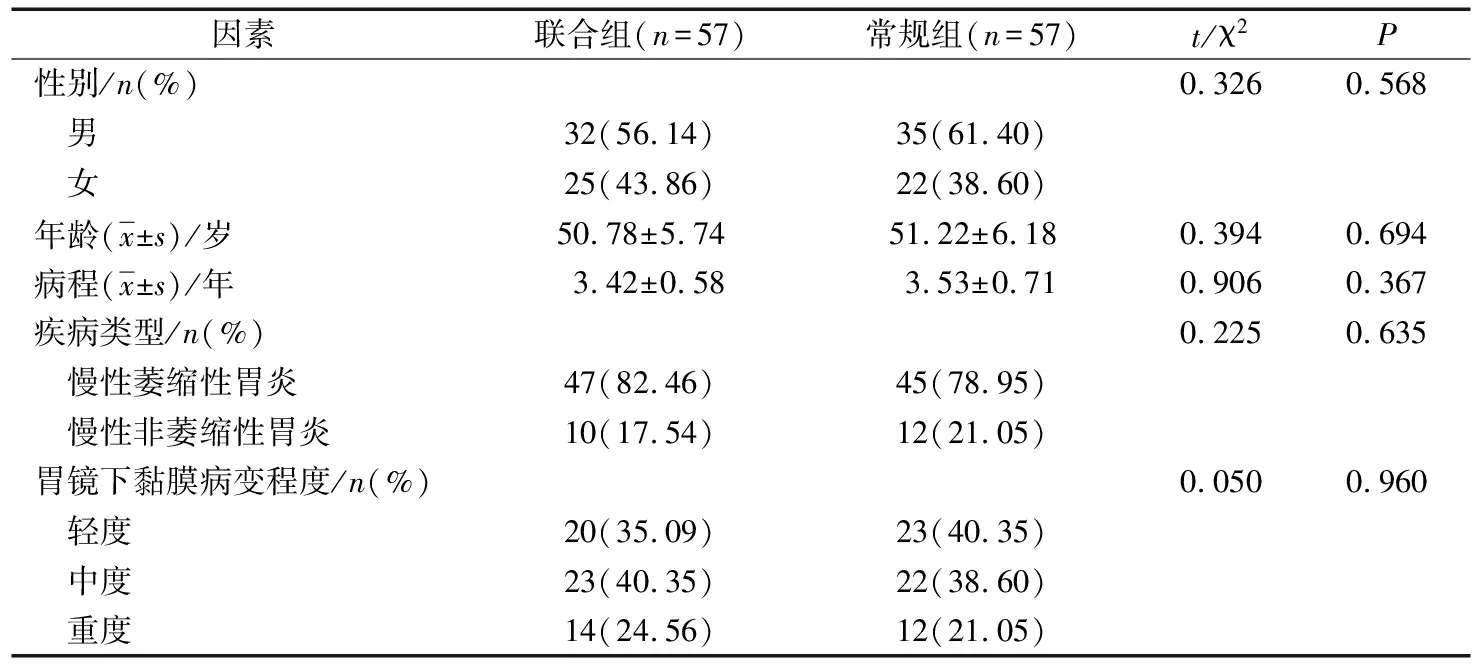
表1 2组一般资料比较
1.2 纳入及排除标准
纳入标准:均符合慢性胃炎相关诊断标准[6];患者及家属均知情,签订知情同意书。
排除标准:既往有胃部手术史者;伴有其他消化系统疾病、消化道肿瘤、癌前病变者;合并免疫功能障碍、其他急慢性感染性疾病者;存在血液系统疾病者;参与本研究前2周内使用过质子泵抑制剂、非甾体类抗炎药、铋剂、抗生素等药物者;对本研究相关药物过敏者;备孕期、妊娠期、哺乳期女性。
1.3 治疗方法
2组均给予奥美拉唑(云鹏医药集团有限公司,规格:20 mg,生产批号:170701)常规治疗,口服20 mg·次-1,1次·d-1,并叮嘱患者注意饮食,禁食刺激性食物。常规组在常规治疗基础上给予硫糖铝口服混悬液(广东华南药业集团有限公司,规格:120 mL:24 g,生产批号:102529),口服10 mL·次-1,3次·d-1。联合组在常规组治疗方案的基础上再给予布拉氏酵母菌散(法国BIOCODEX公司,规格:0.25 g,生产批号:3494),温水冲服0.25 g·次-1,2次·d-1。2组均持续治疗2周。
1.4 观察指标
1)2组治疗效果。治疗2周后判定疗效:显效为腹胀、腹痛、进食后饱胀等临床症状完全消失,胃镜检查显示黏膜病变全部消失且有瘢痕形成;有效为临床症状有所缓解,胃镜检查显示黏膜病变范围缩小50%以上;无效为未达到有效标准。总有效率=(显效+有效)例数/总例数×100%。
2)2组治疗前、治疗2周后的临床症状和胃黏膜改善情况。其中腹胀、腹痛、进食后饱胀等临床症状严重程度按0~3分计,0分为无症状,1分为轻度,2分为中度,3分为重度;胃镜检查可能发现黏膜颗粒状、黏膜血管显露、黏膜皱襞变薄、黏膜色泽异常4种征象,每出现1种征象计胃黏膜积分1分,总分0~4分,分值越高,胃黏膜病变改善情况越差。
3)2组治疗前、治疗2周后胃肠激素[生长抑素(SS)、胃泌素(GAS)、表皮生长因子(EGF)]水平。清晨采集患者空腹静脉血3 mL,离心处理后取上清液,采用放射免疫测定法(RIA)检测上述胃肠激素水平。
4)2组治疗前、治疗2周后肠道菌群。采集患者治疗前、治疗2周后粪便样本,提取菌群DNA,采用实时荧光定量聚合酶链反应(qPCR)测定样本中双歧杆菌、乳杆菌、葡萄球菌、肠球菌水平。
5)2组治疗前、治疗2周后血清炎症因子[白细胞介素-6(IL-6)、C反应蛋白(CRP)、肿瘤坏死因子-α(TNF-α)]水平。清晨采集患者空腹静脉血3 mL,离心处理后取上清液,采用酶联免疫吸附法(ELISA)检测。
6)2组不良反应。
1.5 统计学方法
2 结果
2.1 2组疗效比较
联合组治疗总有效率显著高于常规组(P<0.05)。见表2。
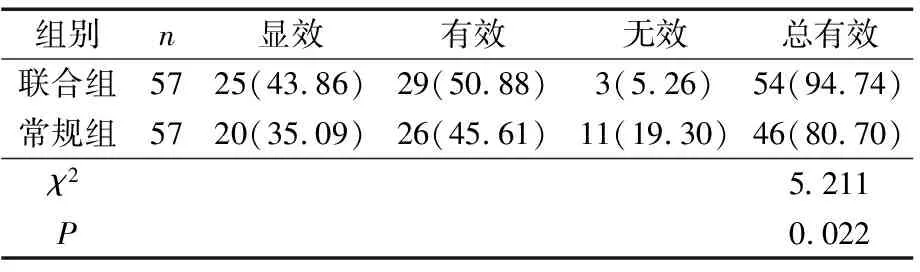
表2 2组疗效比较 n(%)
2.2 2组治疗前后临床症状、胃黏膜改善情况比较
治疗前2组腹胀、腹痛、进食后饱胀、胃黏膜积分无明显差异(均P>0.05);治疗2周后2组腹胀、腹痛、进食后饱胀、胃黏膜积分较治疗前下降,且联合组低于常规组(均P<0.05)。见表3。
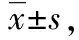
表3 2组治疗前后临床症状、胃黏膜改善情况比较 分
2.3 2组治疗前后血清胃肠激素水平比较
治疗前2组血清SS、EGF、GAS水平无明显差异(P>0.05);治疗2周后,2组血清GAS水平较治疗前下降,且联合组低于常规组,血清SS、EGF水平较治疗前升高,且联合组高于常规组(均P<0.05)。见表4。
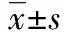
表4 2组治疗前后血清胃肠激素水平比较
2.4 2组治疗前后肠道菌群比较
治疗前2组双歧杆菌、乳杆菌、葡萄球菌、肠球菌水平无明显差异(P>0.05);治疗2周后,2组肠球菌、葡萄球菌较治疗前减少,且联合组少于常规组,乳杆菌、双歧杆菌较治疗前增加,且联合组多于常规组(均P<0.05)。见表5。
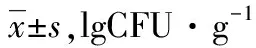
表5 2组治疗前后肠道菌群比较
2.5 2组治疗前后炎症因子水平比较
治疗前2组血清IL-6、CRP、TNF-α水平无明显差异(P>0.05);治疗2周后2组血清IL-6、CRP、TNF-α水平低于治疗前,且联合组低于常规组(P<0.05)。见表6。
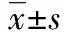
表6 2组治疗前后炎症因子水平比较
2.6 2组不良反应比较
2组治疗过程中不良反应发生率比较,差异无统计学意义(P>0.05)。见表7。

表7 2组不良反应发生率比较 n(%)
3 讨论
近年来,慢性胃炎发病率呈逐年升高趋势,且患病人群年轻化态势明显,防治形势日益严峻[7-8]。有研究[9-10]表明,慢性胃炎是胃癌的重要危险因素,早期控制慢性胃炎病情进展可显著降低胃癌发生风险。
硫糖铝口服混悬液是临床治疗慢性胃炎常用的胃黏膜保护剂,能改善胃黏膜局部环境,还可通过抑制胃酸生成减轻胃酸所致的黏膜损伤,并经由增强黏液-碳酸氢盐屏障作用促进胃黏膜细胞修复和再生功能,从而改善胃炎临床症状,减轻胃黏膜病变[11]。但慢性胃炎发病机制复杂,影响因素较多,单纯给予胃黏膜保护剂治疗常不能取得理想的治疗效果。SINGH等[12]报道指出,布拉氏酵母菌散应用于胃肠道慢性炎症病变中具有良好辅助治疗效果。在此基础上,本研究结果显示,联合组总有效率、临床症状改善幅度明显优于常规组,提示布拉氏酵母菌散与硫糖铝口服混悬液联合治疗慢性胃炎能显著提高疗效,促进症状消退。考虑原因在于:布拉氏酵母菌散经口服后可直接定植于胃黏膜,延长药效持续时间,具有调节胃肠道内环境,降低胃部pH值,促进胃肠道黏膜修复等作用[13]。同时,布拉氏酵母菌散可增强树突状细胞等抗原传递细胞活性,提高机体免疫功能,减轻胃肠道反应,有利于促进病情转归,加快临床症状消退[14]。相关研究[15]表明,慢性胃炎患者存在胃肠激素分泌紊乱、胃动力学异常现象,在病情进展中发挥重要作用。血清SS、EGF、GAS等胃肠激素水平能有效反映胃动力学异常情况[16]。本研究发现,布拉氏酵母菌散与硫糖铝口服混悬液联合治疗能通过调节胃肠激素水平改善胃肠动力学,有助于提高治疗效果。这可能与两者联合应用能够明显改善胃肠道局部环境、减轻胃黏膜病变等原因有关。
肠道菌群失衡在慢性胃炎发生发展过程中具有重要意义,临床逐渐重视调节肠道菌群在慢性胃炎治疗中的价值[17-18]。本研究数据表明,联合组双歧杆菌、乳杆菌多于常规组,葡萄球菌、肠球菌少于常规组,其原因可能是布拉氏酵母菌散进入机体后可有效补充外源性益生菌,抑制致病菌,从而达到调节胃肠道菌群的目的,为病情转归创造有利的胃肠道条件[19]。慢性胃炎患者通常伴随有不同程度的炎症反应,胃黏膜损伤后NF-κB信号通路被激活,IL-6、CRP、TNF-α等炎症因子大量进入血液,导致病情加重[20]。本研究结果证实,与常规组相比,联合组治疗2周后血清IL-6、CRP、TNF-α水平明显较低,说明布拉氏酵母菌散联合硫糖铝口服混悬液治疗慢性胃炎能显著抑制炎症因子合成,达到降低炎症反应的目的,但作用机制仍有待进一步研究。此外,本研究显示,2组不良反应率无明显差异,可见布拉氏酵母菌散与硫糖铝口服混悬液联合治疗慢性胃炎具有良好安全性。
综上所述,布拉氏酵母菌散联合硫糖铝口服混悬液治疗慢性胃炎能显著提高疗效,加快临床症状改善,调节胃肠激素与肠道菌群,还能减轻胃部炎症反应,且不增加不良反应发生风险。但本研究不足之处在于未进行远期随访,难以明确该治疗方案对慢性胃炎患者远期复发风险的影响,今后研究中将延长随访时间获取更全面的数据支持。

