滩涂围垦区农田土壤中无机磷解磷菌的分离鉴定及解磷特性
龙锡恩,张 欣,万少昱,周彤彤,张 蛟
(1.南通大学 地理科学学院,江苏 南通 226007;2.江苏沿江地区农业科学研究所,江苏 如皋 226541)
沿海滩涂作为我国重要的后备土地资源具有巨大的开发潜力,不仅能够缓解人多地少的矛盾,还可为社会经济的可持续发展拓展空间[1]。目前,农业利用是滩涂围垦的主要方式。围垦前后水文条件的改变和农业生产过程中人为因素的影响,土壤理化性质发生显著变化[2-3],但滩涂土壤仍存在含盐量高、养分贫瘠、土壤渗透性差等特征,如何提高土壤养分利用率是一个亟待解决的问题[4]。
磷在农业中具有重要作用,其中最主要的表现为土壤有效磷供给是影响作物产量的限制性因子[5-6]。适当施用磷肥能够确保作物代谢正常进行,促进植株生长发育,并提高其抗寒性和抗旱性。但磷肥施入土壤后很容易与钙、铁、铝离子等发生化学反应形成难溶态磷而被土壤固定,从而降低其利用效率,因此,农民往往会施入大量的磷肥以维持作物产量,而磷肥的利用率通常只有10%~25%[7]。磷肥长期大量投入,不仅带来磷肥资源的严重浪费,还是我国大面积农业面源污染的主要诱因。因此,如何提高磷肥的利用效率是我国农业可持续发展所亟待解决的重要问题之一。土壤微生物有助于作物更好地利用土壤中的磷。溶磷微生物(phosphatesolubilizing microorganisms,PSMs)在土壤中普遍存在,占细菌的1%~50%和真菌的0.1%~0.5%[8]。其主要机理是通过微生物群落产生有机酸(葡萄糖酸、草酸和柠檬酸)和无机质子增加无机磷的溶解度,无机质子通过降低根际pH、螯合阳离子(Al、Fe、Ca)和竞争吸附位点向土壤释放磷酸盐;而对于土壤有机磷,除了矿化作用外,不溶性有机磷还可以被细胞壁结合酶或游离酶所激活,如磷酸酶、磷蛋白磷酸酶、植酸酶和核苷酸酶[9]。
施用解磷菌有助于溶解土壤中的难溶性磷,以此提升有效磷的含量,从而促进植物的生长[10-12]。研究发现,增加土壤中的解磷微生物,可以促进土壤中的难溶磷转化成生物有效磷,提高磷肥的利用率,改善磷肥过量施用与难溶磷在土壤中长期累积的恶性循环[13]。但解磷菌的解磷能力受到营养源、温度、酸碱度等环境因素的显著影响[14-15]。因此,探明不同营养、环境条件对其解磷能力的影响,是对解磷菌进一步深入研究和应用的基础。本文通过对筛选出的5 株解磷菌在不同环境中的解磷能力的研究,探明解磷菌的最适生长条件,以期为滩涂围垦土壤专用生物菌肥开发提供理论参考。
1 材料与方法
1.1 材料
1.1.1 样品采集
土壤样品采集自宁波市北仑区春晓镇(120°10'E,29°68'N)和南通市如东县(120°42'E,32°12'N)的滩涂围垦区农田土壤。土样带回实验室后,去除根系、石块等杂物,4 ℃保存备用。
1.1.2 培养基
无机磷细菌培养基:酵母粉0.5 g,葡萄糖10 g,(NH4)2SO40.5 g,NaCl 0.3 g,KCl 0.3 g,MgSO4·7H2O 0.3 g,Ca3(PO4)210 g,FeSO4·7H2O 0.03 g,MnSO4·4H2O 0.03 g,蒸馏水1 000 mL,pH 7.0~7.5,固体培养基需加18~20 g 的琼脂。
LB 培养基:蛋白胨10 g,酵母粉5 g,NaCl 5 g,蒸馏水1 000 mL,固体培养基需加15 g 的琼脂。
保存培养基(无机盐固体培养基):琼脂15 g,M9 盐溶液100 mL,微量元素营养液10 mL,蒸馏水1 000 mL。
M9 储备液(10X):Na2HPO4·2H2O 75.2 g/L,KH2PO430 g/L,NaCl 5 g/L,NH4Cl 5 g/L,pH 7.2,蒸馏水1 000 mL,20%(质量分数)葡萄糖20 mL,1 mol/L MgSO41 mL,biotin 1 mL,1 mol/L CaCl20.3 mL。
微量元素储备液(100X):EDTA 5 g/L,FeCl3·6H2O 0.83 g/L,ZnCl284 mg/L,CuCl2·2H2O 13 mg/L,CoCl2·2H2O 10 mg/L,H3BO310 mg/L,MnCl2·4H2O 1.6 mg/L,pH 7.5,蒸馏水1 000 mL。
所有培养基均置于灭菌锅中121 ℃灭菌20 min后进行实验。
1.2 解磷菌的分离与筛选
运用涂布平板法:称取5 g 土壤样品置于装有100 mL 无菌水的锥形瓶中,在25 ℃、180 r/min 条件下充分振荡1 h后,采用梯度稀释法进行稀释,分别取0.1~0.001 的稀释液10 μL,涂布接种于无机磷细菌培养基平板上,倒置于培养箱中25 ℃培养7 d。用灭菌牙签挑取生长速度快、形态特殊和能产生透明圈的单菌落,用游标卡尺测量透明圈直径(D)和菌落生长直径(d),并计算解磷比(透明圈直径和菌落生长直径的比值,即D/d)。
1.3 解磷菌株的鉴定
1.3.1 菌落形态
将筛选出的5 株解磷菌划线接种于LB 平板上,25 ℃培养7 d,观察菌落形态特征。
1.3.2 菌株16S rRNA 基因序列分析
将保存的5 株菌株接种到LB 培养液中,在25 ℃、180 r/min 条件下恒温振荡过夜培养。采用菌液PCR法直接对筛选菌株进行16S rRNA 基因扩增。PCR扩增正向引物为27F(5'-AGAGTTTGATCCTGGCTCA G-3'),反向引物为1492R(5'-TACGGTTACCTTGT TACGACTT-3')。PCR 反应体系:DNA 模板0.1 μL(菌液),10×PCR Buffer 2 μL,Mg2+(25 mmol/L)1.2 μL,dNTPs(10 mmol/L)0.4 μL,引物27F(10 μmol/L)0.5 μL,引物1492R(10 μmol/L)0.5 μL,GoTaq DNA Polymerase(5 U/μL)0.4 μL,ddH2O 14.9 μL。PCR 反应条件:94 ℃5 min;94 ℃30 s,55 ℃90 s,72 ℃1 min,30 个循环;72 ℃5 min。PCR 产物经琼脂糖凝胶电泳检测后采用SpanPrep 柱式PCR 产物纯化试剂盒纯化,送生工生物工程(上海)股份有限公司进行双向测序。用DNAMAN 软件进行序列拼接,将获得的16S rRNA 基因序列与GenBank 数据库作BLAST 比对分析。
1.4 不同碳源对菌株解磷能力的影响
将-80 ℃保存的5 株菌株活化两次后,接种于100 mL LB 液体培养基中,在25 ℃、180 r/min 条件下培养24 h,菌液浓度控制在108~109cfu/mL 之间。保持无机磷细菌液体培养基其他成分不变,分别设葡萄糖、蔗糖、乳糖、可溶性淀粉为唯一碳源,均以4 g/L 碳量加入培养基中。每种碳源处理均设立3 组重复,以不接菌处理作为空白对照。在25 ℃、180 r/min 条件下培养37 h后,测定菌株上清液pH 和水溶性磷的含量。
1.5 不同氮源对菌株解磷能力的影响
保持无机磷细菌液体培养基其他成分不变,分别设尿素、硫酸铵、硝酸钾、硝酸铵为唯一氮源,均以0.1 g/L 氮量加入培养基中。每种氮源处理均设立3 组重复,以不接菌处理作为空白对照。在25 ℃、180 r/min 条件下培养37 h后,测定菌株上清液pH和水溶性磷的含量。
1.6 不同碳氮摩尔比对菌株解磷能力的影响
利用葡萄糖和硫酸铵分别调节培养基碳氮摩尔比(C/N)至50∶1、25∶1、12∶1,保持无机磷细菌液体培养基其他成分不变。每种C/N 处理均设立3 组重复,以不接菌处理作为空白对照。在25 ℃、180 r/min条件下培养37 h后,测定菌株上清液pH 和水溶性磷的含量。
1.7 不同pH 对菌株解磷能力的影响
利用1 mmol/L HCl 或NaOH 溶液分别调节培养基pH 至4.0、6.0、7.0 和13.0,保持无机磷细菌液体培养基其他成分不变。每种pH 处理均设立3 组重复,以不接菌处理作为空白对照。在25 ℃、180 r/min条件下培养37 h后,测定菌液pH 和水溶性磷的含量。
1.8 不同温度对菌株解磷能力的影响
以无机磷细菌液体培养基为基础培养基,将培养温度分别设为4、25、37 ℃。每种温度处理均设立3 组重复,以不接菌处理作为空白对照。在180 r/min条件下培养37 h后,测定菌液pH 和水溶性磷的含量。
1.9 不同处理下水溶性磷含量和菌液上清液pH的测定
水溶性磷含量的测定(采用钼锑抗比色法):各取1.8 mL 菌液于100 mL LB 培养基中,在25 ℃、180 r/min 条件下培养37 h。摇匀后,各取1.5 mL 于离心管中,1 500 r/min 离心5 min;酶标板中分取20 μL解磷菌上清液、40 μL 钼锑抗显色剂和240 μL 蒸馏水,显色15 min,送入酶标仪(M nano,tecan)中,于24.5~25.5 ℃、600 nm 波长处测定。
菌液pH 的测定:各取5 mL 菌液于50 mL 离心管中,加入12.5 mL 蒸馏水,震荡5 min后,8 000 r/min离心3 min,采用pH 计(F2-Standard,梅特勒-托利多)测定上清液pH。
2 结果与分析
2.1 解磷菌的分离纯化
采用涂布平板法和梯度稀释法从土样中分离筛选出的5 株解磷菌的菌落特征如表1 所示,整体呈现扁平、不透明的特征,多数呈圆形;表面主要为干黏和光滑黏状;Ps.chlororaphis和Brv.nasdae可观察到明显的溶磷圈,而Mib.flavescens和Ps.jessenii菌株生长菌圈最大,直径分别为69.7 和11.85 mm。菌株在无机磷培养基上的形态如图1 所示。

表1 解磷菌培养7 d 的菌落特征Tab.1 Colony characteristics of phosphate-soluble bacteria cultured for 7 days
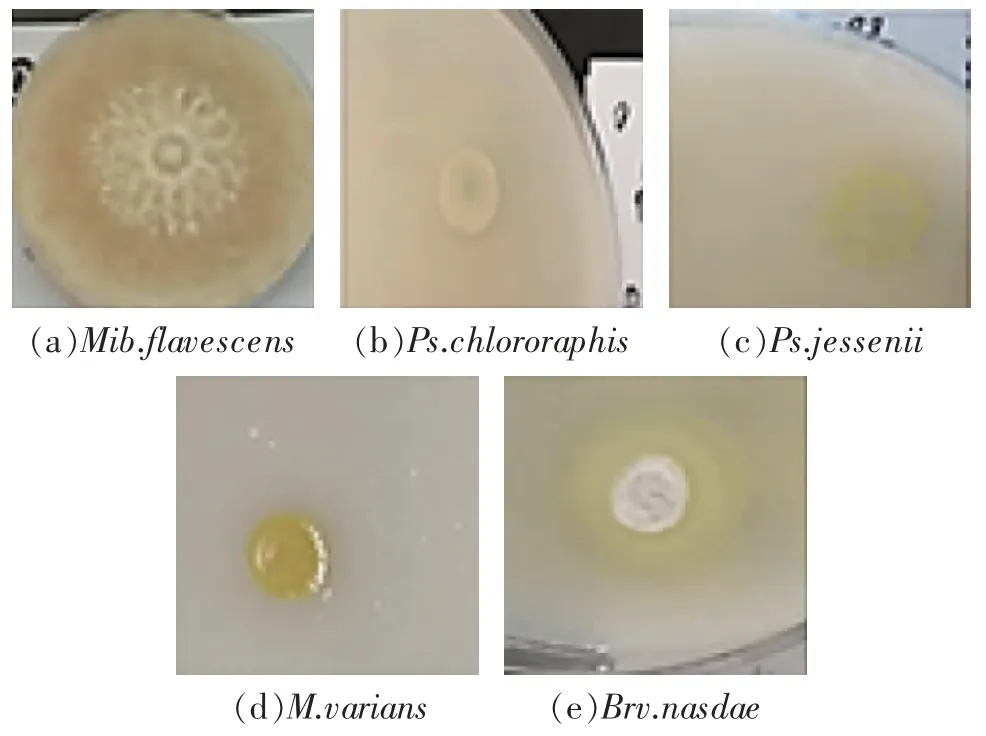
图1 5 株解磷菌株在无机磷培养基上的形态Fig. 1 Morphology of 5 phospholytic strains on inorganic phosphorus medium
2.2 解磷菌的基因鉴定
经16S rRNA 基因序列鉴定,所分离菌株及其基因序列号分别为:Mib flavescens(MZ636717)、Ps.chlororaphis(MZ636758)、Ps.jessenii(MZ636760)、M.varians(MZ636806)和Brv.nasdae(MZ636807)。
2.3 不同培养条件下分离菌株的解磷能力
2.3.1 不同碳源下分离菌株的解磷能力
由图2 可知,不同碳源对菌株的解磷能力有显著影响。当葡萄糖为唯一碳源时,Mib.flavescens的解磷能力最强,解磷量达9.20 mg/L;当蔗糖为唯一碳源时,Brv.nasdae的解磷能力最强,解磷量达0.70 mg/L;当乳糖为唯一碳源时,Ps.chlororaphis的解磷能力最强,解磷量达0.96 mg/L;当可溶性淀粉为唯一碳源时,M.varians的解磷能力最强,解磷量达0.68 mg/L。此外,Mib.flavescens、Ps.chlororaphis、Ps.jessenii和M.varians在以葡萄糖为碳源时,解磷效果显著,解磷量保持在1.11~9.20 mg/L 之间。结果表明:葡萄糖更有利于菌株发挥最佳解磷效力。
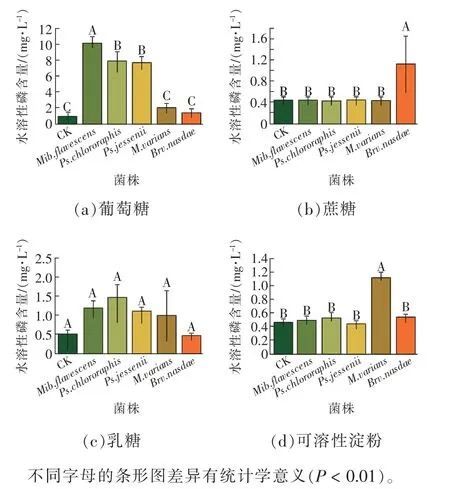
图2 碳源对5 株解磷菌解磷能力的影响Fig. 2 Effects of carbon source on phosphorus digesting ability of 5 strains of phosphorus digesting bacteria
此外,由图3 可知,培养液最终pH 与菌株解磷能力呈负相关的关系。当葡萄糖为唯一碳源时,培养液最终pH 降幅最大,为20.68%;而当碳源为其他变量时,培养液最终pH 几乎没有变化。
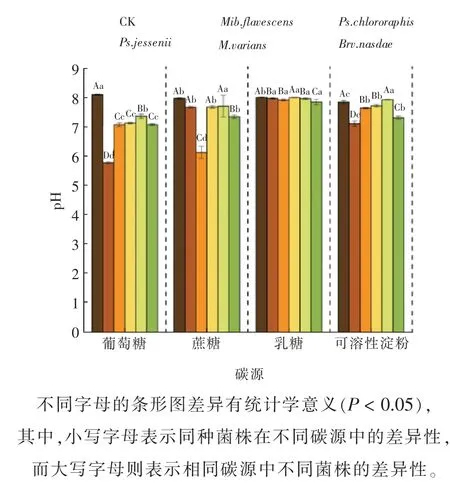
图3 不同碳源处理下5 株解磷菌上清液pH 的变化情况Fig. 3 The pH changes of supernatant of 5 strains of phosphorus hydrolyzing bacteria treated with different carbon sources
2.3.2 不同氮源下分离菌株的解磷能力
由图4 可知,培养基中供给不同形态的氮素能影响菌株的解磷能力。当铵态氮(硫酸铵)为唯一氮源时,Ps.chlororaphis的解磷能力最强,Ps.jessenii的解磷能力次之,解磷量分别为20.54、11.59 mg/L;当硝态氮(硝酸钾)为唯一氮源时,Ps.jessenii的解磷能力最强,Ps.chlororaphis的解磷能力次之,解磷量分别为17.16、16.95 mg/L;当铵态氮和硝态氮(硝酸铵)同时存在时,Ps.jessenii的解磷能力最强,Ps.chlororaphis的解磷能力次之,解磷量分别为12.27、8.14 mg/L;然而,当酰胺态氮(尿素)为唯一氮源时,Ps.chlororaphis的解磷能力最强,Ps.jessenii的解磷能力次之,解磷量分别为2.73、1.92 mg/L,与其他处理相比差异显著。结果表明:Ps.chlororaphis、Ps.jessenii在硝态氮、铵态氮或是硝态氮和铵态氮都存在时,均能发挥最佳解磷效力。
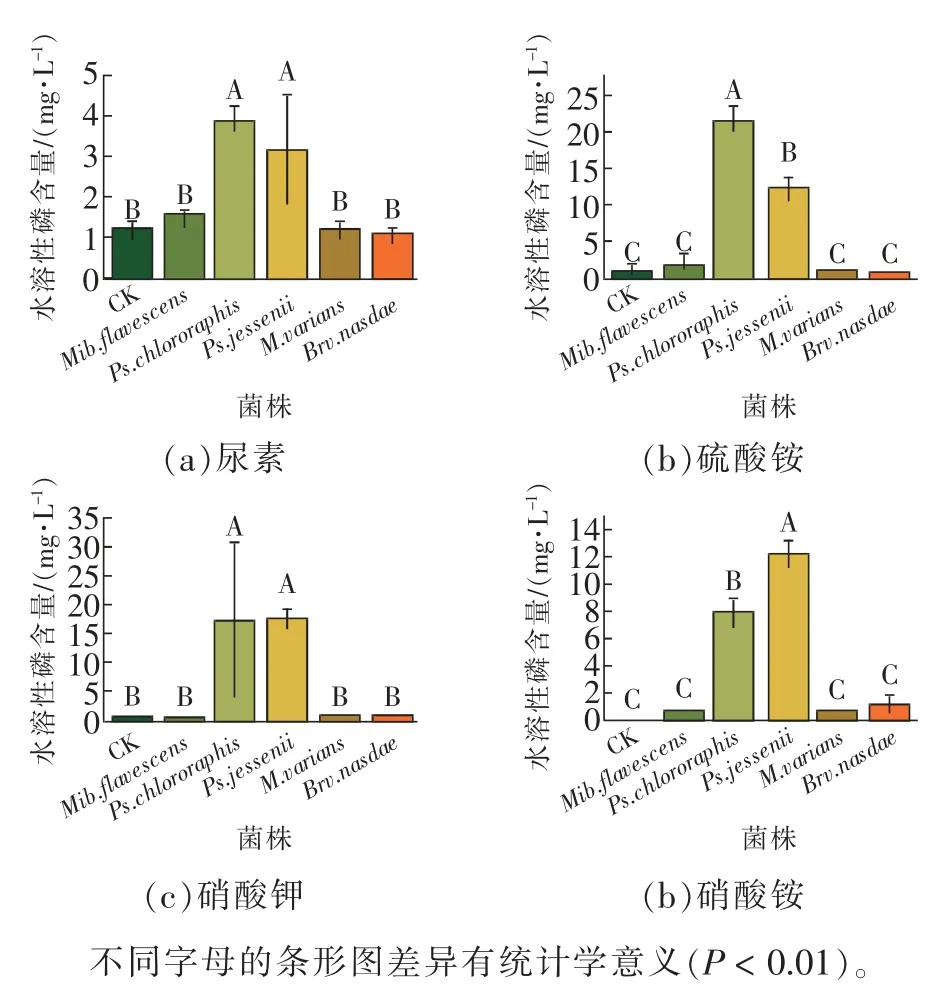
图4 氮源对5 株解磷菌解磷能力的影响Fig. 4 Effects of nitrogen source on phosphorus digesting ability of 5 strains of phosphorus digesting bacteria
此外,由图5 可知,Ps.chlororaphis、Ps.jessenii在不同氮源中均能发挥较好的解磷效力,但其培养液的最终pH 差异不甚明显。当铵态氮和硝态氮同时存在时,培养液的最终pH 降幅最大,为14.50%;而当铵态氮为唯一氮源时,培养液的最终pH 降幅最小,为5.54%。这也说明解磷能力的大小主要是由菌株的特性所决定的。
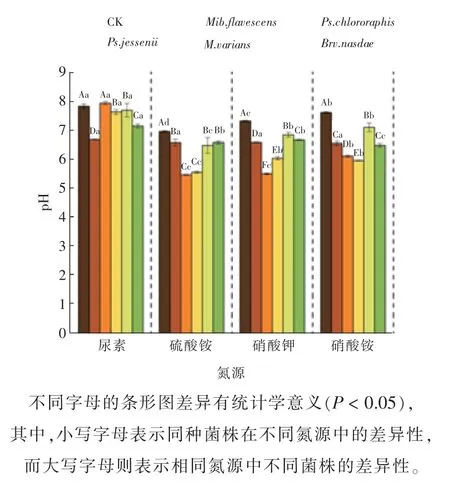
图5 不同氮源处理下5 株解磷菌上清液pH 的变化情况Fig. 5 The pH changes of supernatant of 5 strains of phosphorus hydrolyzing bacteria treated with different nitrogen sources
2.3.3 不同碳氮摩尔比下分离菌株的解磷能力
一般认为,C/N 在25∶1 左右最适合微生物的生长代谢,为此,本实验设置了3 个C/N 条件,即50∶1、25∶1 和12∶1,结果如图6 所示。当C/N=50∶1、25∶1时,Ps.chlororaphis的解磷能力最强,解磷量分别为11.95、68.57 mg/L;当C/N=12∶1时,Brv.nasdae的解磷能力最强,解磷量达68.39 mg/L。相较而言,Ps.chlororaphis在C/N=25∶1 时解磷效果显著,解磷量 达68.57 mg/L;Mib.flavescens、Ps.jessenii和Brv.nasdae在C/N=12∶1 时解磷效果显著,解磷量保持 在40.27~68.39 mg/L 之间。其中,Ps.chlororaphis在不同碳氮比环境中解磷效果显著,解磷量保持在11.95~68.57 mg/L 之间。结果表明:菌株在C/N=25∶1、C/N=12∶1 的环境更有利于发挥最佳解磷效力;而Ps.chlororaphis对不同碳氮比环境的适应性最强。
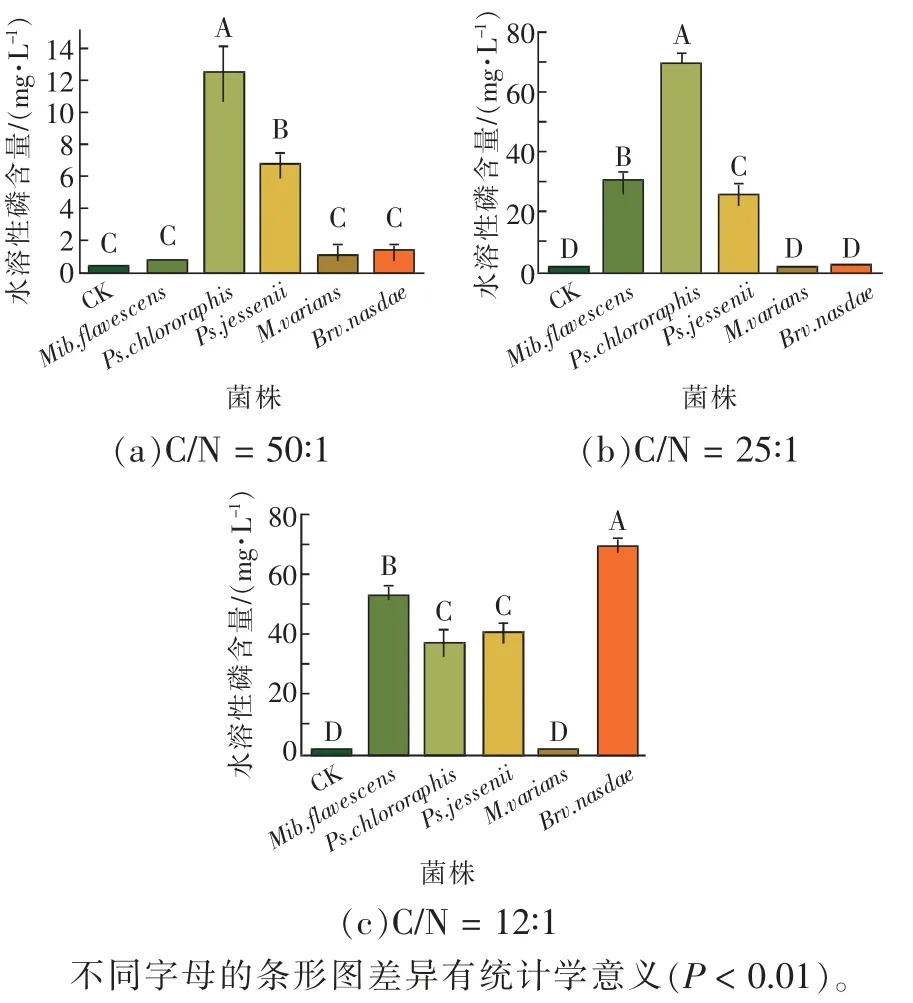
图6 C/N 对5 株解磷菌解磷能力的影响Fig. 6 Effect of C/N on phosphorus degrading ability of 5 strains of phosphorus degrading bacteria
此外,由图7 可知,培养液的最终pH 随着C/N 的增大呈先升高后降低的趋势。当C/N=12∶1 时降幅最大,为20.9%;而当C/N=25∶1 时降幅最小,为13.57%。
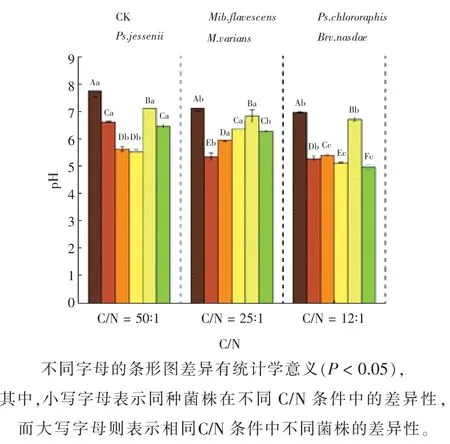
图7 不同C/N 处理下5 株解磷菌上清液pH 的变化情况Fig. 7 The pH changes of supernatant of 5 strains of phosphorus hydrolyzing bacteria under different C/N treatments
2.3.4 不同pH 下分离菌株的解磷能力
由图8 可知,不同的初始pH 对菌株的解磷能力有显著影响。总体来说,随着pH 的增加,5 株解磷菌的解磷能力呈先增加后下降的趋势。当pH=4时,Mib.flavescens的解磷能力最强,解磷量达4.46 mg/L;当pH=6、pH=7时,Brv.nasdae的解磷能力最强,解磷量分别为54.57、85.51 mg/L;当pH=13时,Ps.chlororaphis的解磷能力最强,解磷量达1.60 mg/L。相较而言,Ps.chlororaphis、Ps.jessenii在弱酸性环境中解磷效果显著,解磷量保持在34.81~36.89 mg/L之间;Mib.flavescens、Brv.nasdae在中性环境中解磷效果显著,解磷量保持在80.27~85.51 mg/L 之间。而在强酸性和强碱性环境中,菌株最优解磷量仅为4.46 mg/L。结果表明:弱酸性和中性环境更有利于菌株发挥最佳解磷效力。
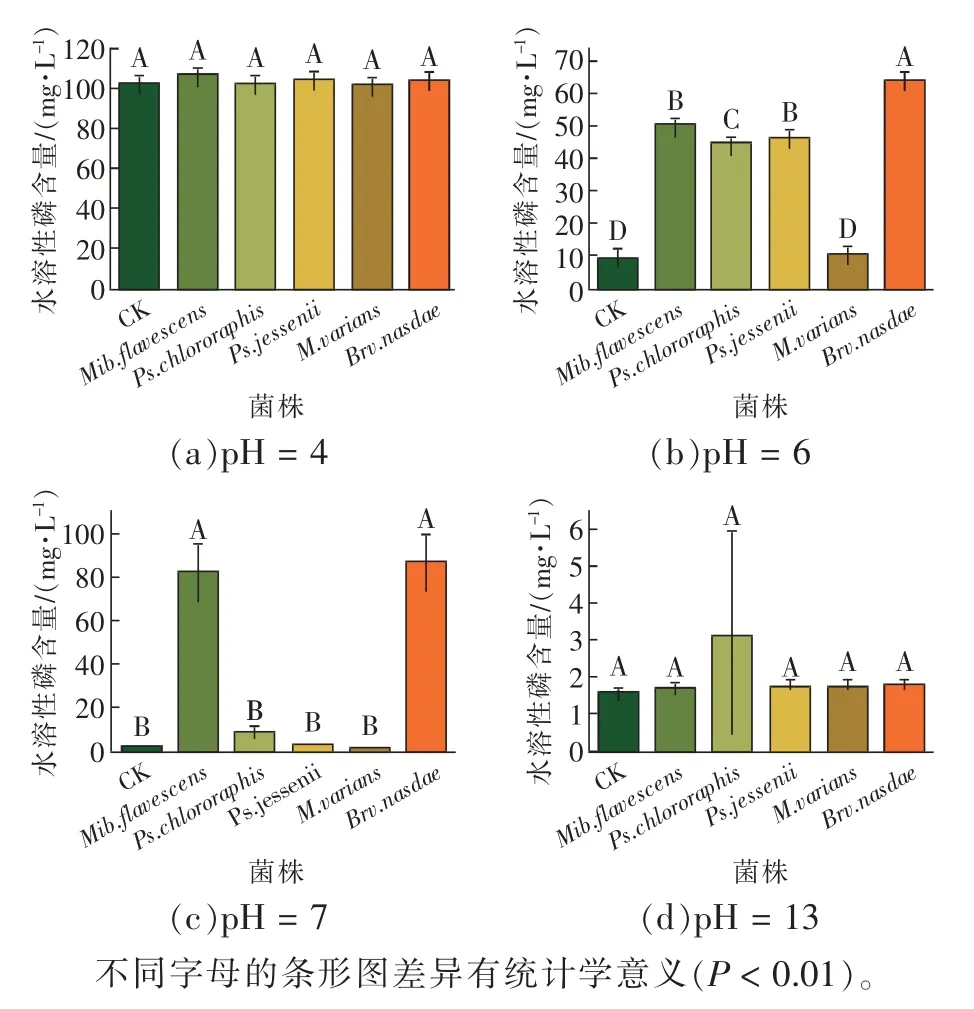
图8 不同pH 对5 株解磷菌解磷能力的影响Fig. 8 Effects of different pH values on phosphorus hydrolysis ability of 5 strains of phosphorus hydrolysis bacteria
此外,由图9 可知,培养液最终pH 与菌株解磷能力呈负相关的关系。当pH=4、pH=13时,培养液最终pH 几乎没有变化;而当pH=6、pH=7时,培养液最终pH 降幅明显,分别为18.73%、22.46%。的环境中解磷效果显著,解磷量保持在65.63~81.94 mg/L 之间。其中,Mib.flavescens仅在t=25 ℃时解磷效果显著,解磷量达74.65 mg/L;Ps.jessenii在不同温度环境中解磷效果显著,解磷量保持在13.59~81.94 mg/L 之间。结果表明:菌株在25~37 ℃的环境中更有利于发挥最佳解磷效力;而Ps.jessenii对大幅度的温度变化环境的适应性最强。
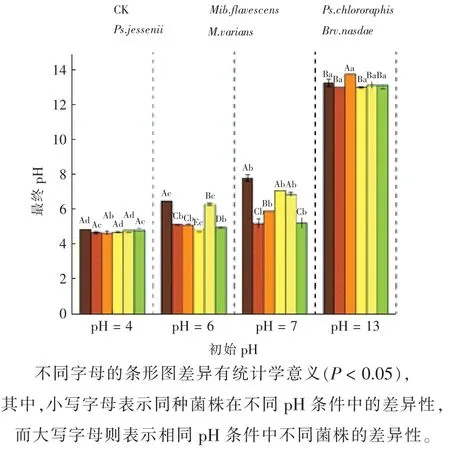
图9 不同pH 处理下5 株解磷菌上清液pH 的变化情况Fig. 9 The pH changes of supernatant of 5 strains of phosphorus hydrolyzing bacteria treated with different pH values
此外,由图11 可知,不同温度下培养液的最终pH 差异明显。当t=25 ℃时,培养液最终pH 降幅最大,为33.72%;而当t=4 ℃时,培养液最终pH降幅最小,为10.82%。
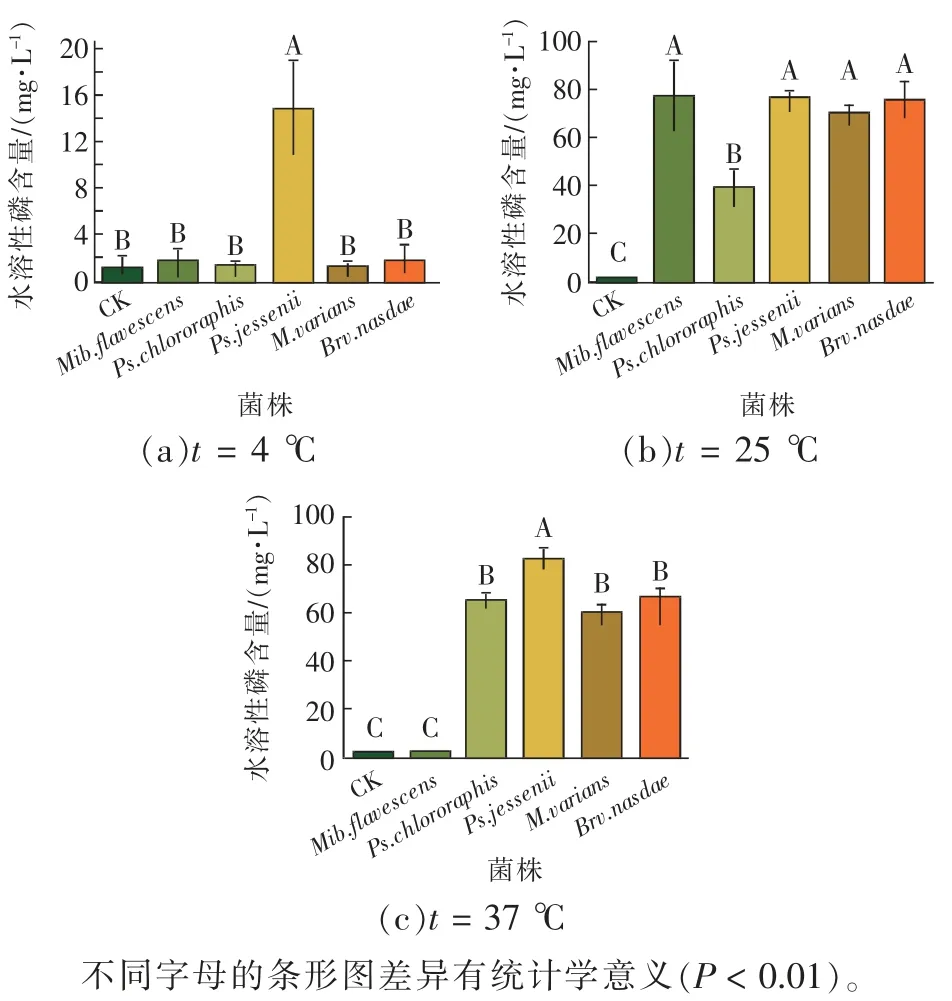
图10 温度对5 株解磷菌解磷能力的影响Fig. 10 Effect of temperature on phosphorus degrading ability of 5 strains of phosphorus degrading bacteria
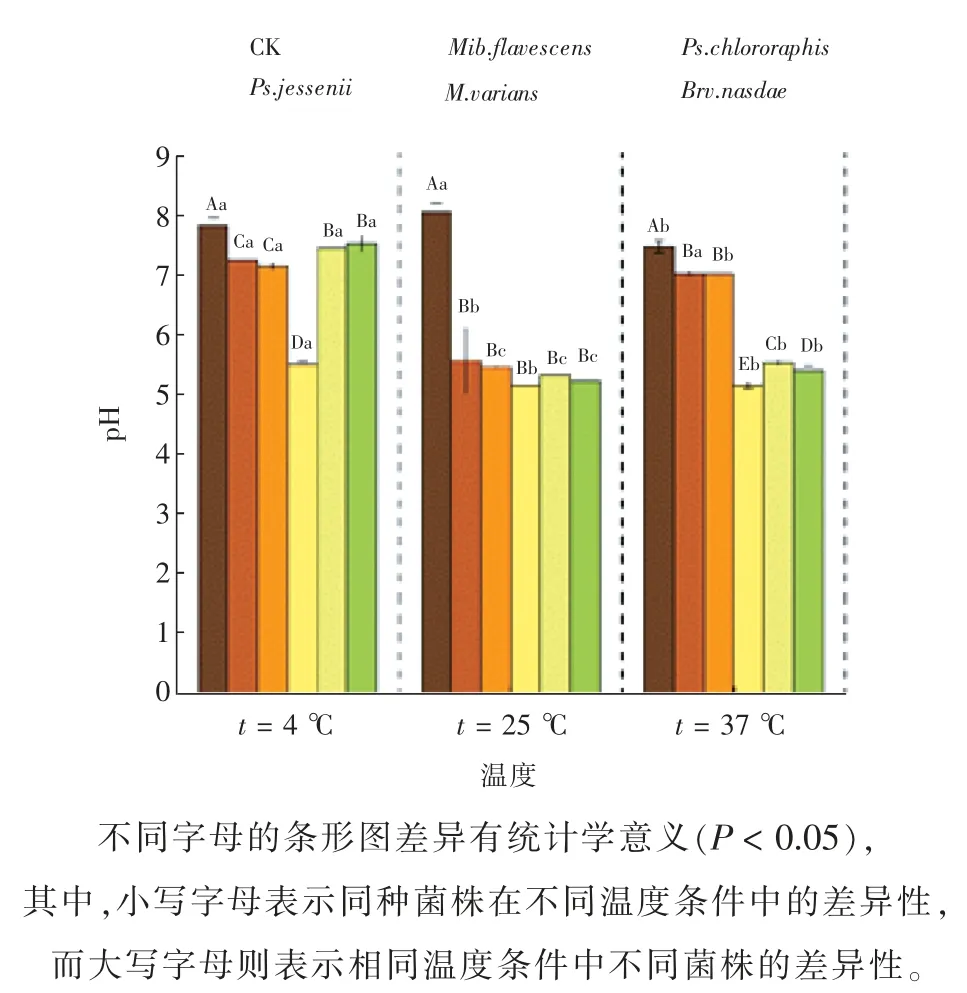
图11 不同温度处理下5 株解磷菌上清液pH 的变化情况Fig. 11 The pH changes of supernatant of 5 strains of phosphorus hydrolyzing bacteria treated at different temperatures
2.3.5 不同温度下分离菌株的解磷能力
由图10 可知,不同温度对解磷菌的解磷能力有显著影响。当t=4 ℃、t=37 ℃时,Ps.jessenii的解磷能力最强,解磷量分别为13.59、81.94 mg/L;当t=25 ℃时,Mib.flavescens的解磷能力最强,解磷量达74.65 mg/L。相较而言,5 株菌株主要在25~37 ℃
3 讨论
当前,国内外许多关于植物根际解磷菌的报道中指出,植物根际解磷菌的种类主要有芽孢杆菌属(Bacillus)、假单孢菌属(Pseudolnonas)、沙雷氏菌属(Serratia)、固氮菌属(Azoto-baeter)、伯克氏菌属(Burkholderia)、克雷伯氏杆菌属(Klebsiella)、泛菌属(Pantoea)等[16-17]。本研究从浙江春晓和南通如东围垦区土壤中分离出5 株解磷菌株,经16S rRNA基因序列鉴定分别为微杆菌属(Microbacterium)、假单胞菌属(Pseudomonas)、马赛菌属(Massilia)和短波单胞菌属(Brevundimonas)。微杆菌属、马赛菌属和短波单胞菌属的发现丰富了解磷菌种的种类,为解磷微生物的研究提供了新的空间。
研究结果表明,在营养物质和环境因素的影响下,解磷菌的代谢途径和生长繁殖方式发生变化,进而导致其解磷功效发生改变[18]。碳水化合物作为所有异养微生物的能源物质,不同碳水化合物对微生物生长繁殖和生理代谢活动的影响存在显著差异[19]。Farhat 等[20]研究发现,碳源的种类不同导致解磷菌有机酸代谢发生变化,产生不同种类的有机酸,从而直接影响到解磷菌的解磷特性,其中葡萄糖的效果最好。卫星等[21]对巨大芽孢杆菌NCT-2 的研究也发现,以葡萄糖为碳源的溶磷效果要优于麦芽糖、蔗糖和淀粉。本实验所获得的结论与上述结论相似,即葡萄糖是最有利于菌株发挥最佳解磷效力的碳源。其中,Mib.flavescens的解磷能力最强,解磷量最高可达9.20 mg/L。此外,当葡萄糖为唯一碳源时,培养液pH 降幅最大。研究认为,解磷微生物主要通过分泌有机酸来溶解不溶性矿质磷酸盐[22],而这些有机酸主要来自于葡萄糖直接氧化代谢途径[23-24]。
除了碳源,氮源也是影响微生物生理活动最重要的因素,然而,不同形态的氮素对溶磷菌的影响差异显著。有学者认为,铵态氮是解磷微生物的必需氮源,铵态氮作为氮源时,解磷菌对难溶性磷酸盐的溶解量高于硝态氮[25-26]。也有学者认为,溶磷菌以硝态氮为氮源时溶磷量最大[27]。本研究发现,Ps.chlororaphis、Ps.jessenii在硝态氮、铵态氮或是硝态氮和铵态氮都存在时,均表现出较好的解磷能力。但其培养液pH 受氮源的影响小,说明在不同形态氮源下,矿物态磷酸盐的溶出机制在不同碳源条件下存在差异,还有待进一步研究[28]。
微生物的解磷能力不仅受碳源和氮源种类的影响,而且还受C/N 的影响[29]。研究发现:有些菌株在高C/N 时表现出比较高的溶磷活性,如曲霉2TCiF2 和4TCiF6、节杆菌1TCRi14 和欧文氏菌4TCRi22;有些则在低C/N 时具有比较高的溶磷能力,如青霉1TCRiF5 和2TCRiF4[28]。本研究发现,菌株在C/N=25∶1、C/N=12∶1 的环境中更有利于发挥最佳解磷效力。此外,培养液的最终pH 随着C/N 的增大而呈先升高后降低的趋势,这可能是由于不同的C/N 导致菌株分泌的有机酸的种类和数量产生了变化[28]。
除此之外,外部因素亦是能够影响解磷菌解磷能力的重要因素。研究发现,复合菌剂解磷作用的发挥也受到pH、温度等因素的影响显著[30]。
微生物对于磷酸钙的溶解作用,主要取决于微生物分泌的有机酸的数量和种类。对于供试的5 株菌株而言,尽管氮源、碳源和C/N 的改变影响它们的代谢,但溶磷机理基本上没有改变,所以培养基的初始pH 与其溶磷量之间存在显著的相关性[28]。而且,不同解磷菌株溶解难溶性磷酸盐时所需的最适初始pH 有所不同,pH 过高或者过低都影响解磷能力[31]。肖春桥等[32]研究发现,酸性环境(初始pH=6)更有利于草酸青霉菌AP2 溶解磷酸盐。赵小蓉等[28]研究发现,当初始pH 在7~8 之间时,PSF1 生长情况最好,同时解磷能力最高。本研究发现,当初始pH在6~7 之间时,有利于Ps.chlororaphis、Ps.jessenii、Mib.flavescens和Brv.nasdae发挥良好的解磷效力。
研究发现,当培养温度较低时,解磷菌活性较低,随温度上升,解磷菌活性提高,解磷量增加,但当温度超过一定数值(50 ℃左右)时,解磷菌活性受到抑制,解磷效果降低,解磷量下降[30]。研究还发现,25~37 ℃的环境更有利于菌株发挥最佳解磷效力。
4 结论
本研究筛选出5 株解磷菌,经16S rRNA 测序并在NCBI 数据库中比对,鉴定为:Mib.flavescens、Ps.chlororaphis、Ps.jessenii、M.varians和Brv.nasdae。
这5 株菌株在不同环境下所发挥的解磷效能各不相同。M.varians在以葡萄糖为碳源、硝酸铵为氮源、C/N=50∶1、pH=6、t=25 ℃时,解磷能力最佳,解磷量最高可达68.59 mg/L;Brv.nasdae在以蔗糖为碳源、硝酸铵为氮源、C/N=12∶1、pH=7、t=25 ℃时,解磷能力最佳,解磷量最高可达85.51 mg/L;Mib.flavescens在以葡萄糖为碳源、硫酸铵为氮源、C/N=12∶1、pH=7、t=25 ℃时,解磷能力最佳,解磷量最高可达80.27 mg/L;Ps.chlororaphis在以葡萄糖为碳源、硫酸铵为氮源、C/N=25∶1、pH=6、t=37 ℃时,解磷能力最佳,解磷量最高可达68.57 mg/L;Ps.jessenii在以葡萄糖为碳源、硝酸钾为氮源、C/N=12∶1、pH=6、t=37 ℃时,解磷能力最佳,解磷量最高可达81.94 mg/L。其中,Mib.flavescens、Brv.nasdae在中性条件下解磷能力远优于其他菌株,解磷量保持在80.27~85.51 mg/L 之间;Ps.jessenii能够适应大幅度的温度变化环境,并保持良好的解磷效力,解磷量保持在13.59~81.94 mg/L 之间。本次实验发现的这3 株菌株,具有良好的微生物肥料开发应用潜力,为日后其菌肥开发奠定了基础。

