园林植物对淹水胁迫的生理及分子响应机理研究进展
杨 杰,唐志璇,杜雅雯,陈艳红,张 健*
(1.南通大学 生命科学学院,江苏 南通 226019;2.南通市观赏植物遗传育种重点实验室,江苏 南通 226019)
园林植物是指适用于园林、绿地和风景名胜区,具有观赏价值和生态价值的一类植物,主要分为木本园林植物和草本园林植物[1]。由于自然界极端天气事件频发,暴风雨引发的洪涝灾害使地势低洼的地区常处于水淹状态,大大抑制了园林植物的生长,削弱了其观赏价值和生态功能[2]。前人研究发现,园林植物在进化过程中形成了对淹水的不同适应性,水烛、灯心草、碱蓬、菖蒲、莲花等草本园林植物具有良好的耐淹性,能够适应淹水环境,除供观赏外,还能净化水体和涵养水源[3-7]。红树、夹竹桃、柳树、池杉等木本园林植物在淹水胁迫后,根、茎、叶等表型或光合速率、叶绿素含量等生理指标都会产生适应性变化来响应淹水胁迫[8-11]。植物耐淹分子调控机理研究主要在小麦、水稻、玉米等大宗农作物以及模式植物拟南芥中开展,园林植物耐淹分子调控机理的研究正处于起步阶段。本文从淹水胁迫对园林植物的影响及其响应机制、淹水响应分子调控与园林植物耐淹能力评价体系的构建3 个方面进行了总结,旨在为园林植物淹水胁迫研究和耐淹园林植物新种质的筛选和鉴定提供技术支撑。
1 淹水胁迫对园林植物的影响及其响应机制
1.1 淹水胁迫对园林植物形态生长的影响及其响应机制
淹水胁迫下,植物受害症状主要为叶片黄化、萎蔫、脱落,根际腐烂和植株倒伏等。研究发现,草本园林植物酸模在淹水胁迫后叶片因表皮细胞壁和角质层厚度减小而变得长而薄,并且叶片数量明显减少[12]。梁行行等研究发现,红花檵木、红叶石楠、卫矛、大叶黄杨等植物在淹水胁迫后,叶片均表现出不同程度的发黄、萎蔫和凋落的现象,可根据叶片变化初步判定植物的耐淹能力[13]。
园林植物通过形态变化响应淹水胁迫的方式可分为外部形态变化和内部形态变化。外部形态变化主要有顶端分生组织、茎和节间的快速伸长,不定根和皮孔的形成;内部形态变化主要包括通气组织和径向氧损失屏障的产生。为了恢复正常呼吸,草本园林植物常通过嫩茎和节间的快速伸长逃离缺氧环境。在对典型湿地物种芦苇的研究中发现,地上生物量随着淹水深度的增加呈现先增加后降低的现象,并且地上生物量占总生物量的85%以上,远高于地下生物量[14]。不定根具有较高比例的细胞间隙,有利于氧气的纵向运输,许多耐涝树种会在茎干基部形成不定根[15]。茎基部能形成肥厚的皮孔来响应淹水胁迫,皮孔的数量和孔径与胁迫时间呈正相关,皮孔促进了树干和环境之间的气体交换,O2可以从皮孔进入植物体内,CO2、乙醇和甲烷等物质会从茎干释放到大气中[16]。
通气组织是植物根系皮层细胞在缺氧条件下发生程序性死亡而产生的空腔。它不仅可以将未被淹水的组织中的O2运输到根系,还可以从淹水组织中释放出CO2和有毒挥发性物质。因此,通气组织提供了植物内部气体交换的可能,以确保根部细胞维持正常生理代谢。径向氧损失是指O2在沿通气组织向根尖的纵向运输过程中被扩散和消耗,以及侧向渗漏进入根际细胞间隙而丧失。植物能够在基部产生径向氧损失屏障,以减少O2向根际细胞间隙渗漏,促进O2沿着通气组织向根尖扩散运输[17]。研究发现,径向氧损失屏障不仅可以限制O2的损失,还可以减少植物毒素进入根部土壤[18]。
1.2 淹水胁迫对园林植物光合和呼吸作用的影响及其响应机制
淹水胁迫后园林植物的光合和呼吸作用显著减弱,光照强度降低,叶片气孔收缩,叶绿素含量变化幅度大,细胞间O2和CO2交换速率显著降低,扰乱了光合作用与呼吸作用之间的动态平衡。宫彦章等研究发现,木本园林植物龙船花、栀子花、朱槿、鸭脚木和变叶木的叶绿素含量在淹水期间呈下降趋势[19]。由于淹水后叶片气孔收缩,O2和CO2的交换速率降低,光合速率降低。当植物被完全淹没时,O2和CO2在水中的扩散速度要比气体中低4 个数量级,O2供应短缺,CO2浓度升高,低氧或缺氧环境干扰了呼吸电子传递链中腺嘌呤核苷三磷酸(ATP)产生,呼吸作用减弱,生命活动被抑制。
为了缓解淹水胁迫,植物会由有氧呼吸转变为无氧呼吸,主要从糖酵解、三羧酸循环(tricarboxylic acid cycle,TCA cycle)和线粒体电子传递链(mitochondrial electron transport chain,mtETC)3 个途径调节维持植物生长的能量平衡。低氧条件下糖酵解产生ATP,并通过乙醇发酵再生氧化性辅酶Ⅰ(NAD+),乳酸脱氢酶(lactate dehydrogenase,LDH)、丙酮酸脱羧酶(pyruvate decarboxylase,PDC)、乙醇脱氢酶(alcohol dehydrogenase,ADH)、蔗糖合成酶(sucrose synthase,SUS)等一系列酶活性增加,碳水化合物代谢加快,能量得以维持[20]。TCA 循环会和糖酵解相结合,以调节TCA 循环过程中的酶活性,提高植物低氧下的存活率。PDC 和ADH 在拟南芥中的过表达显著提高了植株对低氧的耐受性[21]。低氧条件下,小麦和水稻中的延胡索酸、乌头酸、柠檬酸和琥珀酸浓度增加[22-23]。草本园林植物矮牵牛在淹水12 h后,编码PDC、ADH、SUS 和LDH 等相关酶活性显著上调[24]。Yuan等研究发现,淹水抑制了狗牙根地上组织中编码糖酵解、TCA 循环和ATP 合成酶等相关酶的合成,上调了地下组织中参与蔗糖和淀粉水解、糖酵解、TCA 循环和氧化磷酸化的过程中相关酶活性,从而提高了能量利用效率。但这些响应仅仅能抵御短期淹水,随着胁迫时间延长,植株死亡[25]。低氧条件下,黄瓜蛋白质组学分析发现,与碳代谢、氮代谢、抵御胁迫及抗氧化系统相关的蛋白质和多肽被诱导合成,以缓解胁迫,促进植株生长[26]。这些研究直接说明在淹水条件下,园林植物通过提高与呼吸作用相关酶的活性为自身供能,维持正常生长。但与模式植物拟南芥和玉米、小麦等作物相比,对园林植物呼吸作用和光合作用响应淹水胁迫的机理研究不够深入,现研究并没有深入对调控机制进行解析。
1.3 淹水胁迫对园林植物抗氧化系统的影响及其响应机制
植物在逆境下抗氧化系统会遭到破坏,过量活性氧(reactive oxygen species,ROS)在体内积累会造成蛋白质损伤、细胞膜脂过氧化和脱脂化、细胞核损伤。植物体内的ROS 主要由超氧阴离子()、过氧化氢(H2O2)、单线态氧(1O2)和羟自由基(OH-)组成,它们是损伤植物抗氧化系统的主要物质[27]。植株长期处于淹水胁迫中,根系以厌氧呼吸为主,叶面气孔应激性关闭,从而导致体内ROS 积累过量,对细胞产生氧化损伤,地上叶片发黄凋落和地下主根腐烂[28]。
植物抗氧化系统主要包括酶促系统和非酶促系统,正常情况下能通过自身调节来消除ROS。保护酶主要包括超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)、过氧化物酶(per oxidase,POD)和谷胱甘肽过氧化酶(glutathione peroxidase,GPOX)等。庞宏东等研究发现,夹竹桃在淹水胁迫下其SOD、POD、CAT 活性明显增加,与对照组存在极显著差异,而解除淹水胁迫后,酶活性下降[29]。枫杨、落羽杉和枫香在淹水后,丙二醛(malondialdehyde,MDA)含量均呈上升趋势,短期内MDA 含量先升高后降低,说明在一段时间内,植物能够自身清除毒害物质,但随着时间的延长,还是会因为ROS 和MDA 的积累造成伤害[30]。非酶促系统主要包括抗坏血酸(ascorbic acid,AsA)、谷胱甘肽(glutathione,GSH)、类胡萝卜素等物质,这类物质既可以直接和ROS 产生还原反应,也可作为酶的底物在ROS 的清除中发挥作用[31]。在对短柄草的研究中发现,淹水胁迫后抗坏血酸过氧化物酶和过氧化物酶活性明显增加[32]。简营等研究发现,莲雾在淹水胁迫后,体内的抗坏血酸过氧化物酶、谷胱甘肽过氧化物酶和过氧化物酶活性明显上调,对ROS 清除效果明显,并且抗坏血酸过氧化物酶和过氧化氢亲和性最强[33]。
此外,ROS 作为一种信号分子在植物逆境中发挥着重要作用,调控作用的差异与浓度变化有关[34]。ROS/NO 信号能够调控植物淹水胁迫下的耐受性,ROS 浓度决定了调控分子机制的差异。低浓度的ROS 能够调节植物的逆境胁迫下的生长发育;高浓度的ROS 和NO 互作参与PCD、ADH 等通路的激活,维持能量稳态[35-36]。ROS 和乙烯信号之间相互作用能够调节溶生型通气组织和不定根的产生,增加细胞间的O2含量,增强耐淹性[37-38]。淹水和复氧条件下,菊花体内乙烯和ROS 作为信号分子,调节了菊花对低氧胁迫的耐受性[39]。
1.4 淹水胁迫对园林植物内源激素的影响及其响应机制
植物激素作为生理代谢的微量信号分子,对植物的生长发育有重要调节作用[40]。常见的植物内源激素有生长素类、赤霉素类、细胞分裂素类、乙烯、脱落酸和油菜素甾醇类。淹水胁迫改变了内源激素合成与运输的平衡,并受到多种信号通路的调节。
生理学研究结果表明,乙烯(ethylene,ET)、赤霉素(gibberellin,GA)和脱落酸(abscisic acid,ABA)参与了淹水胁迫下植物的生长伸长反应[41]。乙烯信号通路是植物响应淹水胁迫的一种重要方式,ET的积累能够促进植物不定根和通气组织的形成,过量的ET 会导致根的生长受到抑制,加快叶片的枯萎凋落。ABA 和GA 存在拮抗关系,正常情况下ABA 能够抑制GA 的合成,但在淹水胁迫下,植物体内ET 的积累能够促进ABA 的降解,增加GA 的合成[42]。ET的产生作为应对淹水胁迫的早期反应,可以促进生长素的运输,生长素的积累可以促进ET的生物合成,进而促进生长素输送到植物的淹水部分,并启动细胞的分裂来应对淹水胁迫[43]。
以上研究结果表明,园林植物在淹水后,表型和生理都受到较大的影响,并作出积极响应,这一过程的解析为探究园林植物响应淹水胁迫的分子调控机理提供了理论基础和指导。
2 园林植物淹水响应过程中的分子调控机理研究
非生物胁迫会影响植物体内基因的表达,基因表达的变化导致其编码的蛋白在细胞内出现有无和丰度上的差异,这是细胞响应非生物胁迫的分子基础。在探究园林植物淹水响应过程中的分子调控机理时,人们常采用转录组测序来分析基因的表达差异情况,构建相关的基因表达网络,进而挖掘和验证耐淹关键调控基因以解析淹水胁迫的分子调控机理。
2.1 园林植物淹水胁迫的转录组分析
目前,对玉米、小麦、水稻和模式植物拟南芥等的耐淹转录组测序及基因挖掘研究相对成熟,而对园林植物的耐淹转录组测序及解析才刚刚起步。表1 列举了对13 种园林植物的淹水转录组的相关研究,主要从淹水处理方式、测序组织、测序时间点和富集的代谢通路来分析。这13 种园林植物涵盖草本、灌木和乔木,不同类型的园林植物淹水处理方式不尽相同,基因表达谱的变化也存在差异。处理方式如图1 所示,分为渍水和淹没,其中鸭茅[44]、落羽杉[45]、短柄草[32]、荇菜[46]、水韭[47]和旱柳[48]的处理方式是淹没,麻疯树[49]、甘蓝型油菜[50]、夏栎[51]、虉草[52]、菊花[53]、樱花[54]是渍水处理,而狗牙根[25]在测转录组时既用了淹没处理又用了渍水处理。测序的组织部位也存在差异,这和它们受胁迫后的表型以及植株本身的特点有关,目前研究较多的是根、茎和叶片。其中甘蓝型油菜用茎进行测序,狗牙根用叶、茎和不定根进行测序,短柄草的整个地上部全部用来测序,而荇菜仅用了叶柄。除此之外,淹水胁迫处理时间依据物种生长环境而变化,一般沼地、湿地植物耐淹能力较好,淹水处理时间较长,陆生植物耐淹能力次之,处理时间相对较短。鸭茅、麻疯树、落羽杉和旱柳等物种作短期淹水处理,而荇菜和狗牙根淹水处理了7 d,夏栎处理了9 d,水韭处理了30 d,虉草处理时间长达6 周。
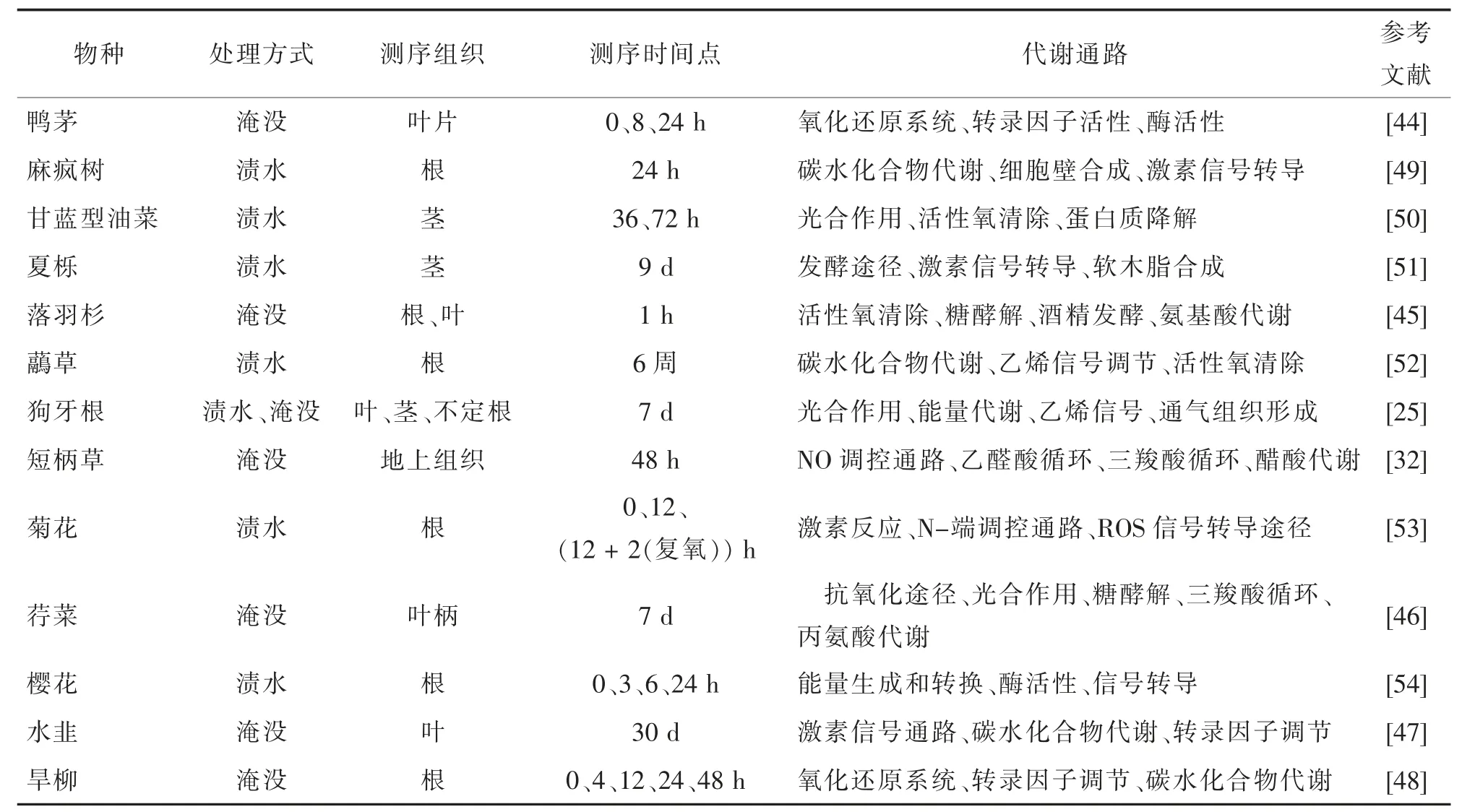
表1 园林植物淹水胁迫转录组测序分析Tab.1 Transcriptome analysis of waterlogging stress in garden plants
通过GO、KEGG 等数据库注释分析发现,淹水胁迫下检测到的差异表达基因(differential expressed genes,DEGs)涉及大量与非生物胁迫相关的代谢途径,可能同时受到多个通路调控。植物在受到淹水胁迫后,会减少碳水化合物的消耗,即“静止策略”[42],如麻疯树在淹水后碳水化合物降解的基因表达明显下调,DEGs 在光合作用代谢途径、植物激素转导途径、ROS 信号转导途径和转录因子活性调节等方面富集。对水韭耐淹转录组测序后发现,乙烯、脱落酸等激素信号的变化与下游的转录因子、信号因子的活性变化相关性大。甘蓝型油菜淹水72 h 后叶片光合作用的相关基因的表达下调,ROS 清除、降解、非生物胁迫相关的基因表达上调,植株损伤降低。耐淹和敏淹菊花不同品种淹水及复氧后的转录组表明,DEGs 在激素反应、N 端调控通路和ROS 信号转导等调控途径富集。
2.2 园林植物淹水胁迫响应基因的功能验证
研究发现,乙烯响应元件(ethylene response factors,ERF)转录因子直接参与了淹水胁迫的调控,PhERF被鉴定为矮牵牛花的耐淹调控因子,在淹水胁迫下PhERF转录本丰度上调,同时PhERF2过表达的品系比对照更耐淹,RNAi 系表现出对淹水的敏感性,ADH1-1、ADH1-2、ADH1-3、PDC1和PDC2在过表达和沉默的植物中分别被诱导和抑制[24]。同样,过表达猕猴桃AdRAP2.3基因的烟草更耐淹,并且NtPDC、NtADH、NtHB1、NtHB2、NtPCO1和NtPCO2基因表达水平较对照显著上调[55]。淹水条件下,耐淹品种菊花CmMBF1c基因显著上调,N端规则途径中RAP2.12、RAP2.3、HRE2、ATE、PCO1和PCO2等在淹水胁迫下显著上调,复氧后又下调。CmMBF1c超表达拟南芥较野生型耐淹性增强,ROS产生关键基因AtRBohF表达量较野生型下调,而ROS 清除关键基因AtAOX1a上调,推测CmMBF1c通过提高ROS 清除基因的表达和降低ROS 的积累来提高菊花的耐淹性[53]。在对柿子的低氧胁迫研究中,利用酵母杂交、双荧光分子互补和双荧光素酶等技术证明了ERF和WRKY两个家族基因之间存在相互作用,并且转录因子复合物的形成有助于应对缺氧反应[56]。
3 园林植物耐淹评价体系
植物耐淹能力是耐淹植物引种、筛选和育种的基础,同时也是植物形态适应和生理适应的综合体现。园林植物的耐淹能力评价往往不是由单一指标决定,而是结合多个指标综合评定得出。不同园林植物在淹水方式和耐淹机理上存在差异,因而其表型变化和生理变化也不相同。不同的材料、处理方式、处理时间、测定的指标及数据分析方法都会对耐淹性评价结果产生影响。
3.1 淹水胁迫的处理方式
淹水处理方式主要有两种:一种是植物的根系完全淹没在水中,即水面淹没土壤,为渍水;另一种则是整个植株完全淹没在水中,为淹没[57]。完全淹水胁迫形成的低氧环境,也可通过低氧工作站来模拟[58]。同时许多实验还通过对植物进行黑暗淹水处理,模拟自然条件下浑浊的洪水对光照强度的削弱[59]。
3.2 耐淹性的评价指标
园林植物耐淹性评价指标主要分为两大类:生长形态指标和生理指标。生长形态指标主要是依据淹水胁迫后根、茎、叶的变化进行测定,主要包括:根长、直径、分叉数、株高、地径、叶片数、叶色等[60-61]。
生理代谢过程的变化则通过生理指标的测定来判断。通过测定植物净光合速率、胞间CO2浓度、叶绿素含量可以直观了解植物淹水后光合作用强弱,进而判断植物的耐淹能力[62]。SOD、POD、CAT 与ROS 产生与清除的动态平衡有关,其含量与淹水胁迫程度成正比[63]。MDA 含量及膜透性大小在一定范围内与淹水胁迫程度成反比。生理指标也是评价园林植物耐淹性的一种重要方面,由于不同的植物在淹水后的生理变化上存在差异,因此并没有统一的生理指标评价方法。
3.3 耐淹性数据的分析方法
单独的一个或者一类指标无法准确反映不同园林植物的耐淹能力,评价的准确度随着指标的相关性和数量的增加而提升。现阶段最常见的方法是通过对不同生长形态指标和生理指标的测量,结合隶属函数计算,得出不同植物的隶属函数值,对其耐淹性进行评价[13]。顾沈华等采用Delphi法,通过测定林木耐淹水的时间及相关表型指标进行赋权并计分,根据不同树种的得分将30 个树种分成4 种耐淹类型[64]。为了明确不同指标与耐淹性之间的关系又引入了相关性分析,可将主成分分析、聚类分析与隶属函数相结合进行多元分析,对耐淹性进行综合评价[65]。目前,这一方法使用较为广泛。
4 总结与展望
因园林植物种类繁多,品种差异大,淹水胁迫后同时受到多个信号通路的调控,分子调控机制较为复杂,所以,现研究主要从形态、结构、生理、生化和代谢基因信号调控等角度进行。目前,对于园林植物耐淹性的研究仍存在较多不足,以下方向值得深入研究:
1)现研究的园林植物中,草本植物数量偏多,而木本植物种类相对较少,木本植物在生态系统中起着不可替代的作用,因此,需要加大对木本园林植物耐淹相关研究。
2)目前园林植物响应淹水胁迫的机制可分为能量合成与碳、氮和氨基酸代谢调控、表型调控、活性氧调控、激素调控等(图2)。淹水胁迫后光合作用和呼吸作用减弱,有氧呼吸转变为无氧呼吸为自身供能;茎、节间的伸长、生长,通气组织和不定根的形成能够帮助植物获得更多的O2,以适应低氧环境;活性氧和NO 形成的信号通路对植物的生长发育和代谢过程起调控作用;乙烯、赤霉素、脱落酸等激素之间的相互作用也会调节园林植物特定组织的生长发育,以更好地应对淹水胁迫。此外,一些转录调控因子也起着至关重要的作用,例如ERF家族基因和其他基因共同响应淹水胁迫。然而,和模式植物、大宗作物相比,园林植物耐淹调控机理解析不够,多数停留在一些表型指标及生理指标的测定研究,结合转录组分析其基因表达模式,初步挖掘耐淹调控相关基因,但缺乏对后续基因功能的验证、分子调控机理的深入探究,同时缺乏相应的转基因再生体系为后续同源转化验证研究提供基础。

图2 园林植物响应淹水胁迫机制Fig. 2 Response mechanism of garden plants to flooding stress
3)园林植物的耐淹性评价体系的建立不够完善。因园林植物种类多样,不同植物耐淹能力存在差异,评价体系也大有不同,因此,缺乏较为统一的指标以及精准的算法来进行综合评价。
通过对以上3 个方面的深入探究可有力推动园林植物耐淹调控机理的解析,并形成更全面的评价体系,为今后园林植物淹水胁迫研究和耐淹园林植物新种质的筛选、鉴定和选育提供技术支撑。

