新型冠状病毒疫苗诱发甲状腺疾病:挑战与应对
袁 力, 相萍萍, 陈国芳, 徐书杭, 刘 超
(南京中医药大学附属中西医结合医院内分泌科 江苏省中医药研究院国家中医药管理局瘿病证治国家重点研究室,江苏 南京 210028)
2019 冠状病毒病(coronavirus disease 2019,COVID-19)是由非分段单链核糖核酸β 冠状病毒,即新型冠状病毒(新冠)感染所致的传染病[1]。随着病毒的扩散和蔓延, 成为第二次世界大战后各国面临的最严重危机,亦是1918年西班牙大流感以来最致命、传播速度最快的传染性疾病[2]。
COVID-19 不仅导致呼吸系统结构和功能失常, 也对包括甲状腺在内的全身诸多器官构成明显威胁[3]。 最新研究表明,甲状腺存在丰富的新冠细胞受体,这可能使原有甲状腺疾病患者更易感染新冠[4]。 事实上,目前已有多例感染新冠后并发甲状腺疾病的相关报道,约15%轻至中度COVID-19患者出现甲状腺功能异常,例如促甲状腺激素 (thyroidstimulating hormone,TSH)、游离三碘甲状腺原氨酸(free triiodothyronine,FT3)水平 降低等[5]。据Mateu-Salat 等[6]报道,2 例老年女性患者感染COVID-19 后1~2 个月出现新发Graves 病(Graves’ disease, GD)。 不仅如此,既往患有GD 后停药的患者也可能受新冠的影响。 多例报道显示,感染新冠后,GD 复发率可能有增高的风险[7-8]。 1 例45 岁中年女性感染新冠后1 个月发生甲状腺功能亢进(甲亢)危象[9]。 提示甲状腺疾病与COVID-19 之间存在相互影响的关系。
面对如此巨大的全球危机,最有效的举措当属研发和接种新冠疫苗。 然而有报道显示,接种新冠疫苗后可诱发甲状腺疾病或导致甲状腺疾病的复发。 那么甲状腺疾病患者能接种新冠疫苗吗? 健康人群在接种疫苗后是否有患甲状腺疾病的风险? 本文将围绕上述问题进行讨论,分析新冠疫苗与甲状腺疾病的复杂关系。
新冠疫苗导致甲状腺疾病的临床证据
根据现有的病例报道,接种新冠疫苗后可能发生亚急性甲状腺炎(subacute thyroiditis, SAT)和GD,其中伴发SAT 的报道最为常见。 Iremli 等[10]报道,3 例中青年女性在接种新冠灭活疫苗后4~7 d,因颈前疼痛和疲乏无力就诊,既往均无甲状腺疾病、上呼吸道感染或COVID-19 病史,其中2 例处于哺乳期。实验室检查和影像学结果符合SAT 的诊断。1 例67 岁男性注射新冠灭活疫苗后1 个月出现颈前和左耳轻微疼痛;实验室检查提示TSH 水平被抑制,FT3、游离甲状腺素(free thyroxine, FT4)、红细胞沉降率及C 反应蛋白水平升高;结合甲状腺彩色超声(彩超)确诊为SAT[11]。
据土耳其的一项研究显示, 在某接种新冠疫苗率高于80%的地区,仅19 例患者出现异常,其中15 例被诊断为新冠疫苗诱导的SAT,其余4 例确诊为GD。 研究者对既往文献进行综合考量后, 认为所有类型新冠疫苗都可以引起SAT,无论是新发抑或是复发[12]。
相比于灭活疫苗, mRNA 疫苗和腺病毒载体新冠疫苗也出现了少量的类似病例。 最早被报道的是1 例无既往甲状腺疾病病史的57 岁女性, 在就诊前34 d 接受了第一剂mRNA 疫苗,随后出现疲劳、恶心、寒战和肌痛,持续1.5 d;就诊前13 d 接受第二剂疫苗, 在24 h 内上述症状复发,并出现进行性前颈疼痛和肿胀。甲状腺功能检查提示FT4水平升高,TSH 水平降低;体格检查显示体温达38.3℃,脉搏137 次/min,且右侧甲状腺弥漫性肿大伴压痛;甲状腺彩色超声显示甲状腺右叶不对称性肿大,血管增生;由此诊断为SAT,并予以相应治疗[13]。
除上述破坏性甲状腺炎外,新冠疫苗尚可诱发自身免疫性甲状腺疾病。Vera-Lastra 等[14]报道,2 名女性医护人员接种疫苗3 d 后出现甲亢的临床表现,甲状腺功能检测显示TSH降低, 甲状腺激素升高,TSH 受体抗体 (TSH receptor antibody,TRAb)阳性,超声显示甲状腺弥漫性肿大,表明接种新冠疫苗可能导致GD 发生。 现有的病例报道显示,接种mRNA 疫苗[13]、灭活疫苗[15]和腺病毒载体疫苗[16]后,新冠疫苗接种后的GD 报道仅见于mRNA 疫苗[17]。 目前更多学者认为[18],接种后轻微和短期出现GD 症状和体征可能是短暂的破坏性甲状腺炎, 或原有自身免疫性甲状腺炎的患者, 短暂恶化合并了甲状腺毒症。 但目前仍缺少大规模的临床样本数据,关于新冠疫苗诱导的GD 还需更多证据。
虽然新冠感染可诱导自身免疫性甲状腺疾病复发,但迄今尚无关于注射新冠疫苗导致GD 复发的报道。
新冠疫苗诱发甲状腺疾病的机制
目前, 投入临床使用的抗病毒疫苗分为减毒活疫苗、灭活疫苗、亚单位疫苗及核酸疫苗等。 减毒活疫苗由于其有恢复突变的可能而存在安全隐患[19]。而灭活疫苗和病毒衍生的亚单位疫苗诱导免疫反应较弱, 通常需要添加佐剂来提高其免疫效率[20]。 在此次COVID-19 大流行中,首次采用核酸疫苗,可向体内直接引入RNA 或DNA 等特殊的遗传物质,诱导细胞生产病毒表面的S 蛋白。 机体免疫系统识别到这种特殊的蛋白质,就会展开攻击从而发生免疫反应[21]。
佐剂是指预先或与病毒抗原同时注入机体,可增强机体对病毒抗原的免疫应答或改变免疫应答类型的非特异性免疫增强物质。 氢氧化铝常与病毒抗原一起作为佐剂用于疫苗中,能够在使用少量抗原时增强免疫反应[21]。毋容置疑,佐剂可引发遗传易感个体的不良免疫反应, 导致佐剂诱导的自身免疫/炎症综合征 (autoimmune/inflammatory syndrome induced by adjuvants, ASIA)。10年前首次发现ASIA,大多数病例发生在人乳头瘤、 乙型肝炎和流感病毒疫苗接种后[23]。ASIA 相关的内分泌疾病包括1 型糖尿病、卵巢早衰、自身免疫性甲状腺炎、肾上腺功能不全和SAT,通常在接种疫苗后2 d~2 个月内发生[24],其中大多在接种疫苗后的4~7 d 出现SAT,这与既往发生ASIA 的病例相似。
另一方面,新冠刺突蛋白、核蛋白和膜蛋白都与甲状腺过氧化物酶发生交叉反应, 许多甲状腺过氧化物酶多肽序列与新冠各种蛋白的序列有同源性或相似性(见表1)[25]。 前文所述2 例接种疫苗后发生GD 者, 接种了由核苷RNA 编码的改良新冠刺突蛋白组成的新冠疫苗, 这一发现支持交叉抗原反应可促进自身免疫性甲状腺炎的可能。 新冠疫苗的刺突蛋白与人类的七肽蛋白具有相似的遗传特性, 易发生交叉抗原反应,从而引发自身免疫性疾病[25]。 即新冠蛋白与甲状腺靶蛋白发生交叉免疫反应, 可能是佐剂之外另一个触发自身免疫性甲状腺疾病的因素。
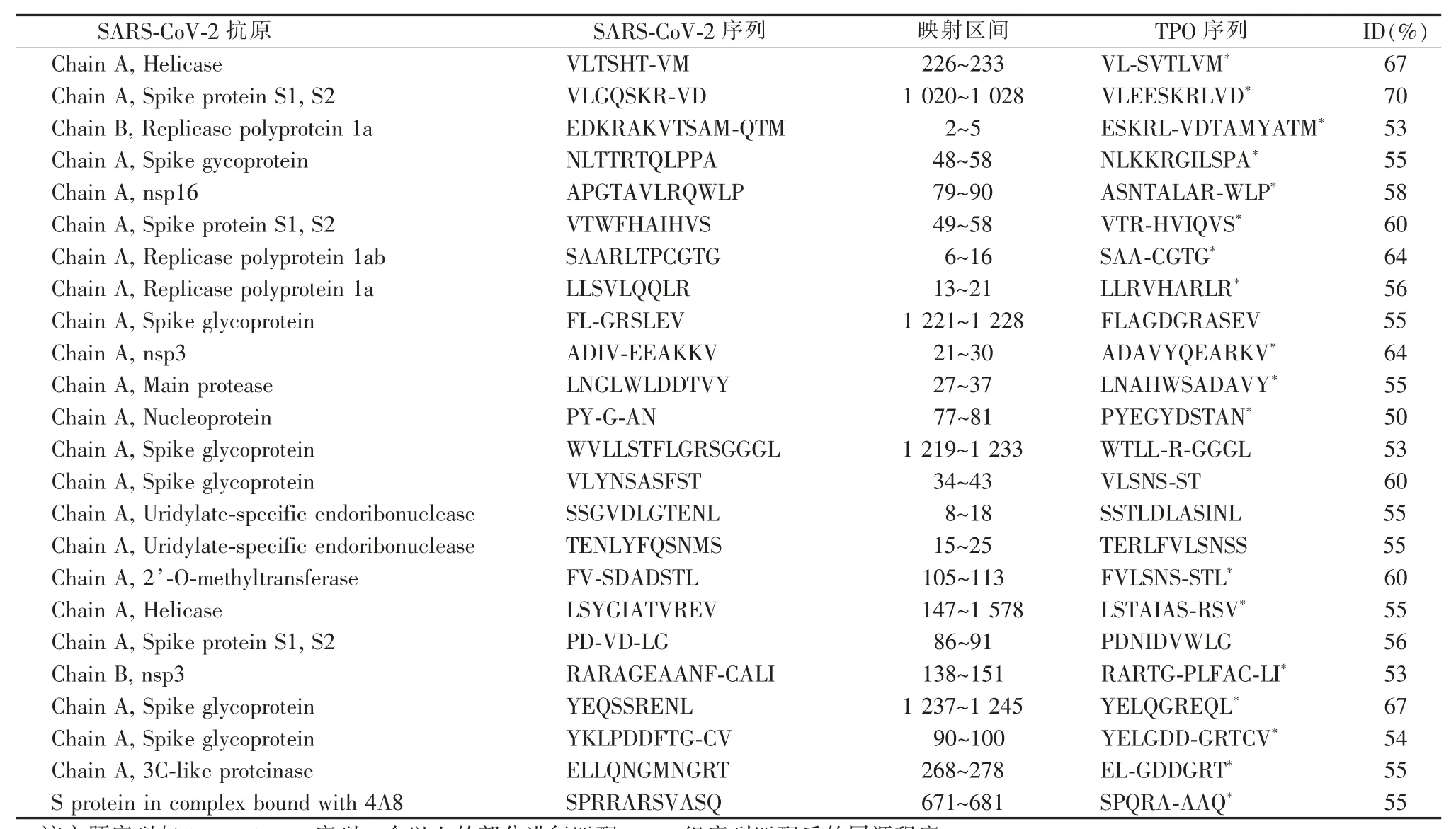
表1 新冠蛋白和TPO 抗原之间潜在的交叉反应表位
问题和展望
尽管国内外均进行了大规模新冠疫苗接种, 但罕有ASIA 的报道,这可能与临床医师缺乏相应的认识有关。
综合考虑,遗传易感性、既往自身免疫性疾病病史、佐剂以及刺突蛋白和健康甲状腺细胞抗原之间的交叉反应等均可能是诱发SAT 和GD 等甲状腺疾病的影响因素。
虽无正式的文献报道,但在临床工作中少部分业已停药的甲亢患者在接种新冠疫苗后出现甲状腺功能、自身抗体的异常波动或GD 复发,值得临床医师关注,其机制有待探究。
新冠疫苗接种与SAT、GD 之间的关联性及明确机制仍需进一步论证。 COVID-19 已导致全球数百万人残疾和死亡,所带来的风险远超过新冠疫苗不良反应引起的担忧,故临床上需要权衡利弊,理性决策,因噎废食,则为不智。