肠道菌群介导生脉方对脓毒症小鼠的治疗作用
侯竞一,吴佳伟,曹丽娟
(中国药科大学天然药物国家重点实验室,南京 210009)
脓毒症是指宿主对感染的反应失调,继而导致危及生命的器官功能障碍[1]。脓毒症是ICU 中死亡的主要原因,并与不良预后相关[2]。据估计,全球每年有4 890万人被诊断为败血症,造成1 100万人死亡,占全球总死亡人数的19.7%[3]。随着COVID-19 大流行,发生多器官功能障碍的重症COVID-19 患者进一步提高了全球脓毒症发生率[4]。脓毒症已成为亟待解决的全球公共卫生问题,给全球医疗系统带来了严重负担。脓毒症表现为感染初期的全身促炎反应以及随后的淋巴细胞耗竭和继发感染[5],以及由组织缺氧、线粒体功能障碍或细胞凋亡等导致的多器官衰竭[6]。目前临床治疗脓毒症使用液体复苏、抗生素和移除感染灶的方法,但无法逆转多器官衰竭,患者预后较差,继发感染率高[7]。因此开发免疫调节和抗多器官衰竭药物是脓毒症研究的重要课题。
生脉方(Shengmaiformula,SMF)是临床治疗气阴两虚型冠心病和劳累型心绞痛的经典中药复方,包括生脉饮、生脉注射液、注射用益气复脉(冻干)和益气复脉片等品种[8]。近年来发现SMF还具有一定的脓毒症治疗作用。临床研究表明,脓毒症患者在常规西医治疗的基础上合并注射用益气复脉(冻干),治愈率显著提高,外周血中CD4+T 细胞比例显著回升[9];合并生脉注射液可以提高休克复苏疗效,降低血清乳酸浓度[10]。动物研究表明,注射用益气复脉(冻干)通过抑制TLR4-mTOR 自噬通路,减轻脓毒症急性肺损伤[11];生脉注射液上调肠道紧密连接蛋白表达抵抗脓毒症[12]。但SMF能否改善脓毒症多器官衰竭,发挥免疫调节功能及其作用机制仍不明确。
肠道菌群与脓毒症之间存在紧密联系。肠道菌群失调可能导致致病菌丰度增加和肠道屏障通透性增加,进而导致来源于肠道细菌的能够刺激TLR4 的蛋白或脂质分子移位至体循环,增加脓毒症易感性[13]。研究表明,生脉散通过提高大鼠肠道菌群α 多样性和双歧杆菌、乳杆菌、芽孢杆菌科相对丰度,改善大鼠脾虚症状[14];灯盏生脉通过调节肠道菌群组成,上调短链脂肪酸水平,通过调控PI3K/AKT/caspase-3 通路抑制神经细胞凋亡,同时具有保护肠道屏障的功能[15]。但SMF 能否通过调节肠道菌群稳态治疗脓毒症尚不清楚。
本研究考察了SMF 对脓毒症组织损伤、炎症响应和免疫调节的作用,探究SMF 能否通过调节小鼠肠道菌群改善脓毒症,为中药复方防治脓毒症提供一定的研究基础和参考。
1 材 料
1.1 试 剂
红参提取物(吉林长青参业有限公司);麦冬提取物、五味子提取物(正大青春宝药业有限公司);脂多糖(LPS O111:B4)、2,2,2-三溴乙醇(美国Sigma 公司);肝素钠、氨苄青霉素钠、甲硝唑、硫酸新霉素、盐酸万古霉素[阿拉丁试剂(上海)有限公司];小鼠IL-6 ELISA 试剂盒、小鼠TNF-α ELISA试剂盒(杭州联科生物技术股份有限公司);谷丙转氨酶、谷草转氨酶、尿素氮、肌酐测定试剂盒(南京建成生物工程研究所);红细胞裂解液、CD16/32、Ly6C-APC、Ly6G-Percp-Cy5.5、CD11b-BV605、CD45-Pacific Blue、CD11c-AF700、F4/80-PE 抗 体(美国Biolegend公司);其他试剂均为市售分析纯。
1.2 仪 器
SQP 精密电子天平(德国Sartorius 公司);DM6B正置显微镜(德国Leica公司);Synergy H1全功能酶标仪(美国BioTek 公司);BD FACSelesta(美国BD Bioscience公司)。
1.3 动 物
SPF级C57BL/6,5周龄(18 ~ 20 g),雄性,购自上海斯莱克实验动物有限责任公司,生产许可证号SCXK(沪)2022-0004。小鼠饲养于独立通风笼盒,实验室温度24 ~ 26 ℃,相对湿度60% ~ 80%,每小时空气交换次数10 ~ 12 次,保持12 h 昼夜交替。所有动物实验均符合动物伦理委员会标准。
2 方 法
2.1 分组与给药
红参、麦冬和五味子提取物按药材重量比1∶1.5∶3 混合为SMF,用生理盐水配制为澄清溶液。5周龄C57小鼠适应性饲养1周。对于小鼠随机分为6 组:对照组、模型组、低剂量SMF 灌胃组(0.3 g/kg)、中剂量SMF 灌胃组(0.6 g/kg)、高剂量SMF 灌胃组(1.2 g/kg)和SMF 腹腔注射组0.6 g/kg);每组取14只进行生存率考察。中剂量换算自临床SMF 用量(人体重按70 kg 计算,体表面积换算系数为9.1)。流式细胞术检测、抗生素处理和粪菌移植实验SMF 给药剂量均为0.6 g/kg。SMY每日给药1 次,连续4 d。对照组和模型组给予等量生理盐水。
2.2 小鼠脓毒症模型构建
2.2.1 LPS 模型 LPS 用生理盐水配制为2 mg/mL。小鼠最后一次给药30 min 后腹腔注射20 mg/kg LPS,对照组给予等量生理盐水。24 h后眼眶取血,室温静置1 h 后6 000 r/min 离心10 min 收集血清;收集左侧肝、肺、肾组织固定于4%多聚甲醛。对于流式检测,全血使用1%肝素钠溶液抗凝。
2.2.2 盲肠结扎穿刺(CLP)模型 小鼠最后一次给药30 min 后,腹腔注射2.5%三溴乙醇溶液(0.01 mL/g 体重)麻醉,固定于37 ℃加热垫上,腹部备皮,沿腹中线剪开1 cm 切口,分离盲肠,于盲肠50%处使用4-0 缝合线结扎。21 G 针头由血管侧向非血管侧刺穿盲肠1 次,避开血管,轻轻挤压盲肠流出少量内容物,将盲肠送回腹中缝合,碘酒消毒。假手术组开腹取出盲肠后即送回并关腹缝合。小鼠术后于加热垫上苏醒,移回鼠笼自由饮水和进食。术后24 h,全血使用1%肝素钠溶液抗凝,进行流式检测。
2.3 生存曲线的绘制
小鼠腹腔注射20 mg/kg LPS 溶液后,于6,12,24,48,72,96 h记录各组生存情况,绘制生存曲线。
2.4 H&E染色
4%多聚甲醛中固定的肝、肺、肾组织,经梯度脱水、石蜡包埋、切片、复水和染色后,使用正置显微镜(200 ×)观察组织病理改变并拍摄照片。
2.5 血清炎症因子检测
按制造商说明,使用酶联免疫吸附测定(ELISA)试剂盒检测小鼠血清IL-6、TNF-α水平。
2.6 血生化指标检测
按制造商说明,使用生化指标测定试剂盒检测小鼠血清谷丙转氨酶(ALT)、谷草转氨酶(AST)、尿素氮(BUN)和肌酐(Cr)水平。
2.7 流式细胞术检测外周血固有免疫细胞
1%肝素钠抗凝血加入20 倍体积1X 红细胞裂解液,室温避光孵育10 min。2 300 r/min 离心5 min,弃上清液,PBS 1 mL重悬,加入CD16/32抗体0.5 μL,吹打混匀,室温孵育10 min,每管加入荧光抗 体(Ly6C-APC、Ly6G-Percp-Cy5.5、CD11b-BV605、CD45-Pacific Blue、CD11c-AF700、F4/80-PE)各0.5 μL,避光孵育30 min,BD FACSelesta上机检测。画门策略:中性粒细胞CD45+Ly6G+CD11b+;巨噬细胞 CD45+Ly6G-CD11b+F4/80+;单核细胞CD45+Ly6G-F4/80-Ly6C+CD11b+CD11c-。
2.8 抗生素(ABX)处理
根据Wang 等[16]描述的方法改进,对于图4,ABX 组小鼠给予氨苄青霉素钠(100 mg/kg)、甲硝唑(100 mg/kg)、硫酸新霉素(100 mg/kg)和盐酸万古霉素(50 mg/kg),使用超纯水配制,每日灌胃1次,直至模型结束;SPF组小鼠给予等量超纯水灌胃。对于图5,各组受体鼠ABX 灌胃7 d 后自由饮水3 d,清除抗生素残留效应。
2.9 粪菌移植(FMT)
根据Zhang等[17]描述的方法改进,供体鼠每天灌胃SMF 0.6 g/kg,连续14 d;对照组和模型组灌胃生理盐水。于第7 天开始,每天收集各组供体鼠粪便,用生理盐水配制为100 mg/mL,涡旋振荡5 min,3 000 r/min 离心5 min,取上清液,对应灌胃至ABX 处理结束的受体鼠(0.01 mL/g),每日1次;ABX 组和ABX+LPS 组灌胃生理盐水。各模型组于供体鼠最后一次给药和受体鼠最后一次FMT 后30 min腹腔注射LPS,考察24 h药效指标。
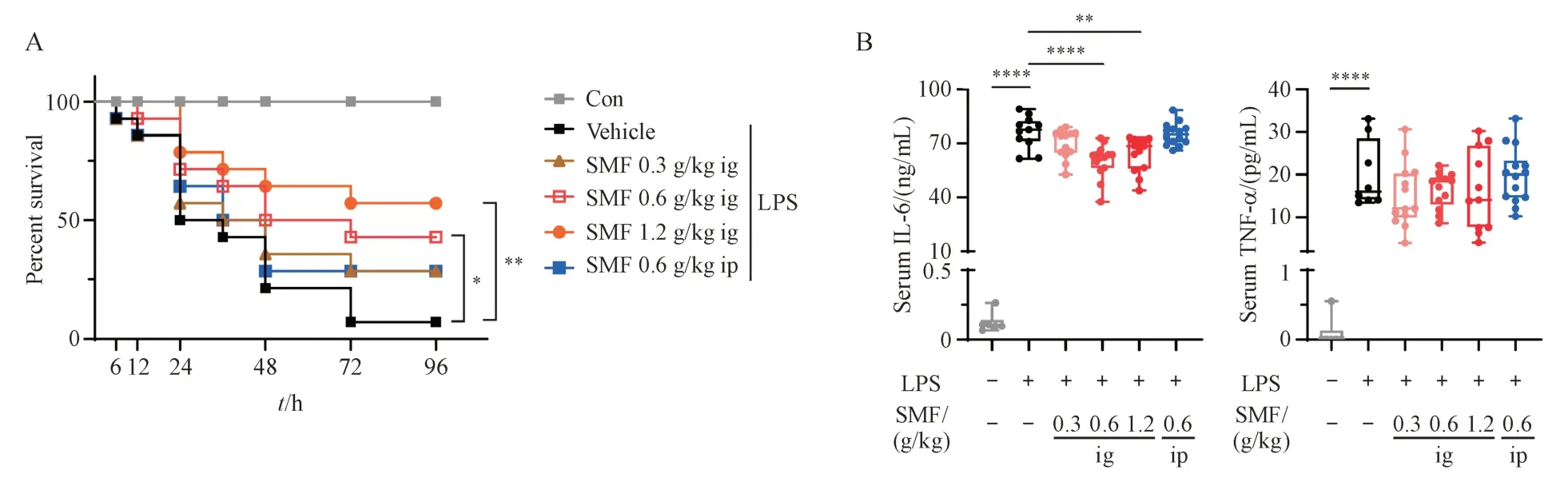
Figure 1 Gavage administration of Shengmai formula (SMF) improved the survival rate and reduced serum inflammatory factors of LPS-induced septic miceA: Survival analyses of mice during 96 h after LPS injection; B: Levels of serum IL-6, TNF-α from each group (± s, n = 28)*P < 0.05, **P < 0.01, ***P < 0.001, ****P < 0.000 1
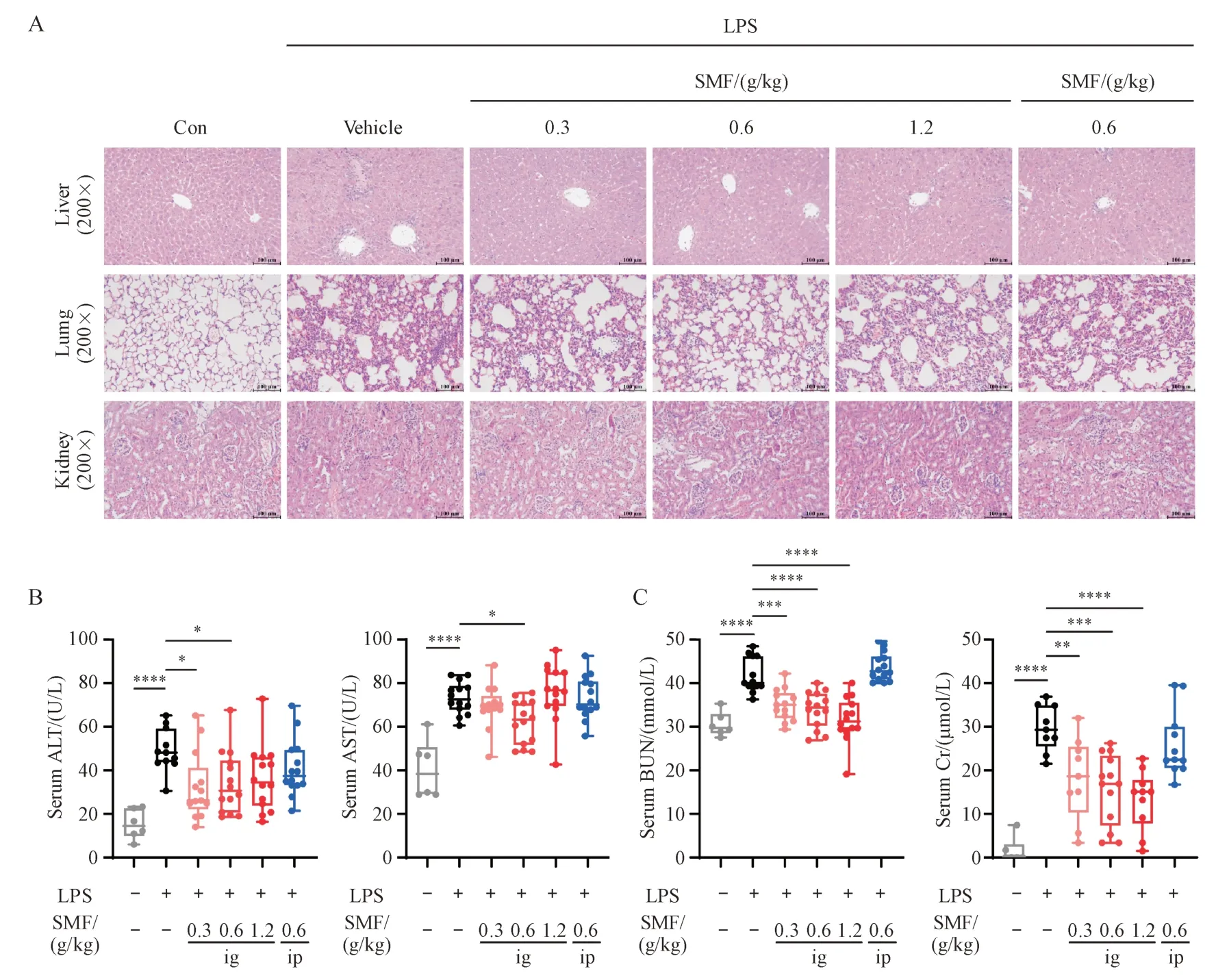
Figure 2 Gavage administration of SMF alleviated tissue damages of LPS-induced septic miceA: Representative images of the hematoxylin and eosin-stained livers, lungs and kidneys (200 ×) from each group; B-C: Levels of serum ALT, AST,BUN and Cr from each group (± s, n = 28)*P < 0.05, **P < 0.01, ***P < 0.001, ****P < 0.000 1
2.10 统计分析
所有数据统计分析均使用GraphPad Prism 8.0,各组数据以±s表示。多组样本之间采用单因素方差分析(One-way ANOVA);对于图4,多组样本间采用双因素方差分析(Two-way ANOVA)。定义P< 0.05具有统计学意义。
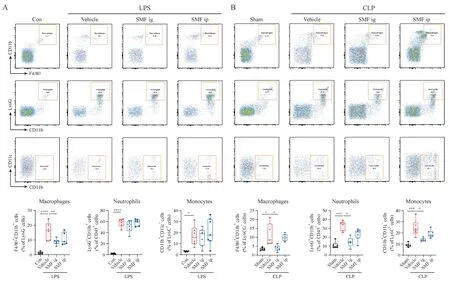
Figure 3 Gavage administration of SMF reduced the proportion of peripheral macrophages, neutrophils and monocytes of LPS (A) or CLP (B)induced septic mice. Representative flow cytometry scatter diagrams of each group are shown with gates (± s, n = 12)*P < 0.05, **P < 0.01, ***P < 0.001, ****P < 0.000 1
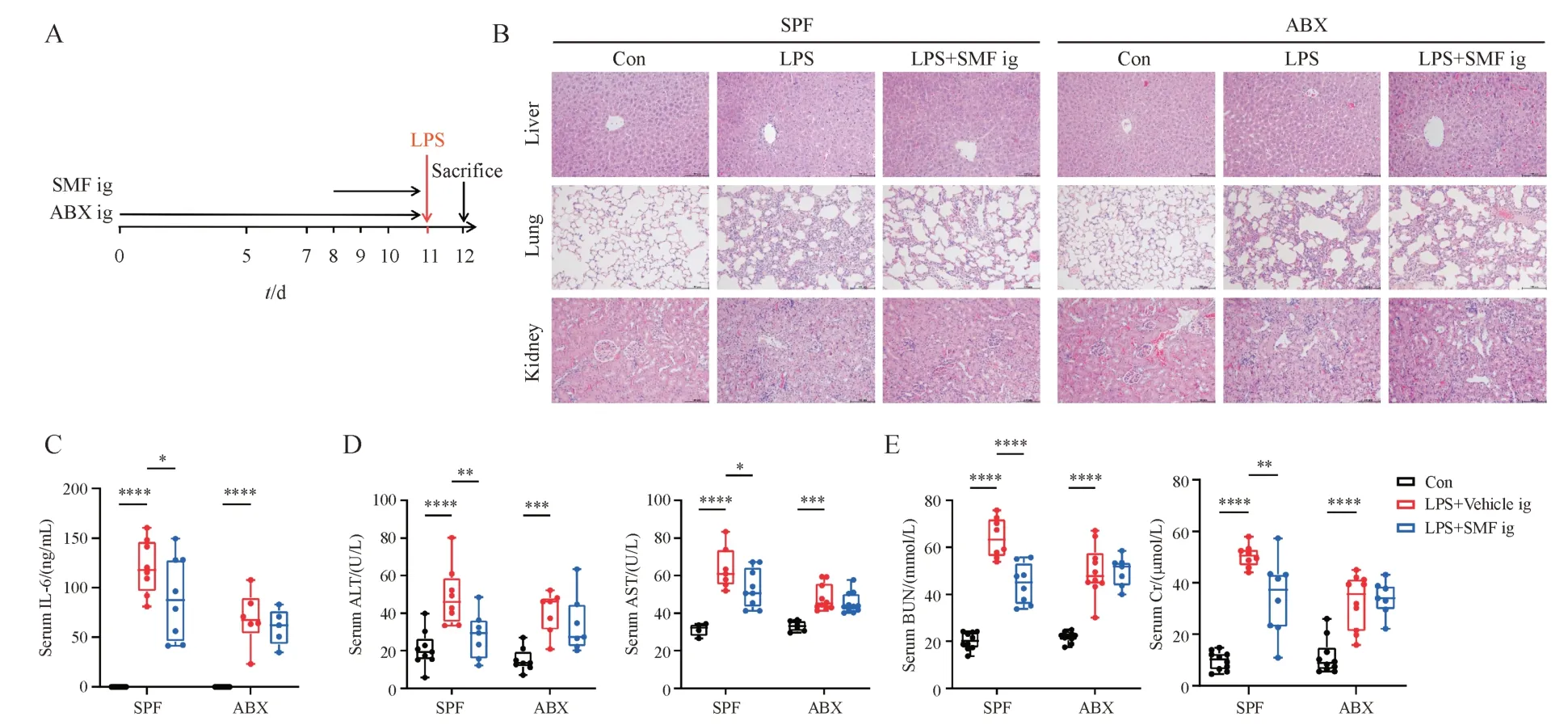
Figure 4 Gut microbiota mediates the therapeutic effect of SMF in septic miceA: Schematic illustration of the experimental design; B: Representative images of the hematoxylin and eosin-stained livers, lungs and kidneys (200 ×)from each group; C-E: Serum levels of IL-6, ALT, AST, BUN and Cr from each group (± s, n = 20)*P < 0.05, **P < 0.01, ***P < 0.001, ****P < 0.000 1 SPF: Specific pathogen free; ABX: Antibiotic cocktail
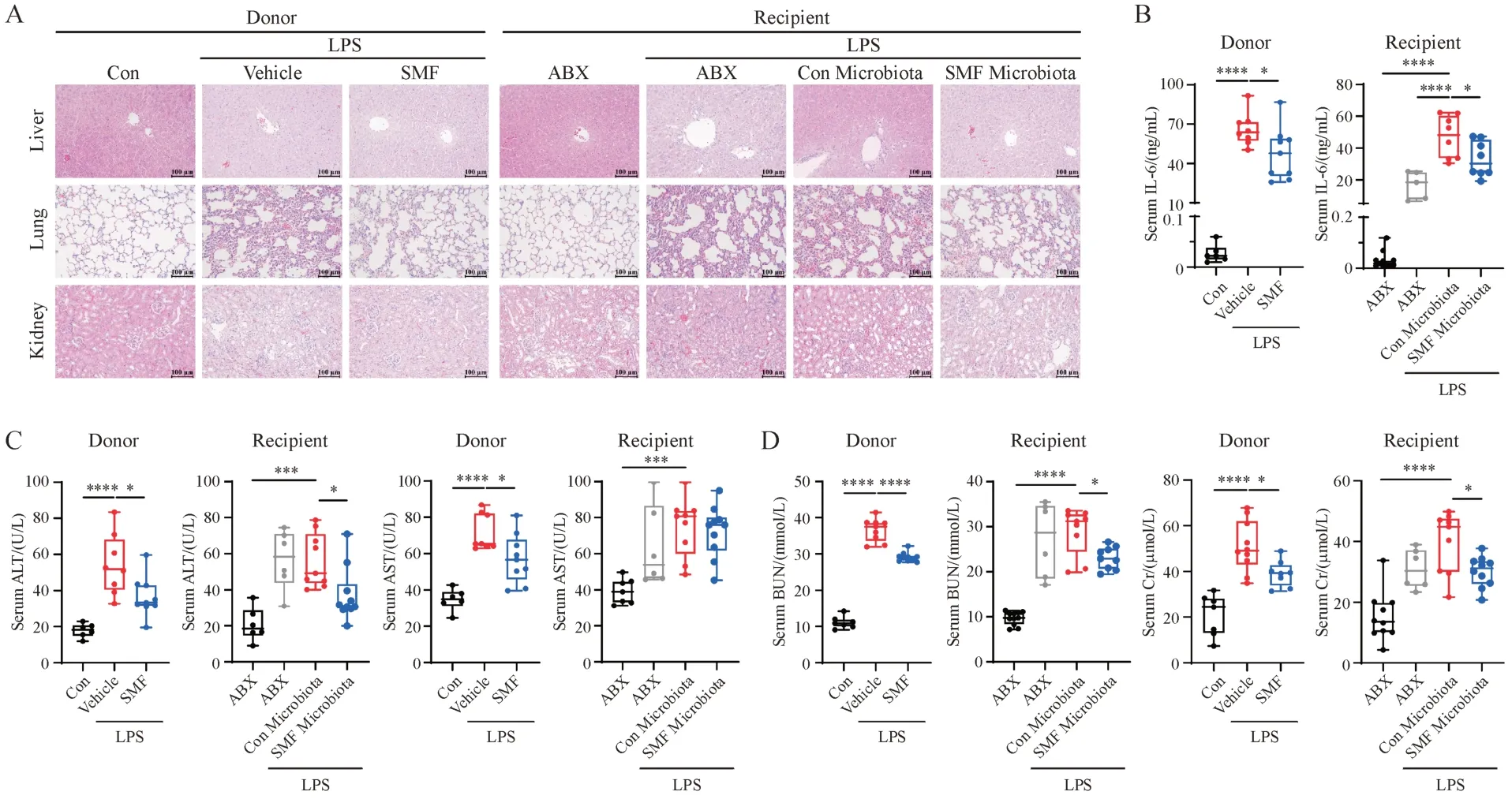
Figure 5 Fecal microbiota transplantation (FMT) ameliorates the LPS-induced sepsis in recipientsA: Representative images of the hematoxylin and eosin-stained livers, lungs and kidneys (200 ×) from each group; B-D: Serum levels of IL-6, ALT,AST, BUN and Cr from each group (± s, n = 20)*P < 0.05, **P < 0.01, ***P < 0.001, ****P < 0.000 1
3 结 果
3.1 灌胃SMF 提高脓毒症小鼠生存率,降低血清炎症因子水平
构建小鼠LPS 模型,考察SMF 灌胃或腹腔注射对脓毒症小鼠生存率、血清炎症因子水平的影响。模型组给予LPS后96 h生存率为7%,中、高剂量SMF 灌胃小鼠96 h 生存率为43%和57%,与模型组相比显著提高(图1-A)。给予LPS 后24 h 血清IL-6、TNF-α水平显著升高,中、高剂量SMF灌胃显著降低血清IL-6 水平,对TNF-α 无明显作用(图1-B)。SMF 腹腔注射对脓毒症小鼠生存率和血清炎症因子均无显著影响。
3.2 灌胃SMF减轻脓毒症小鼠组织损伤
组织切片H&E染色结果显示,与对照组相比,给予LPS 后24 h 后模型组肝脏可见细胞坏死和细胞排列紊乱,中央静脉周围可见炎性浸润;肺脏可见肺泡水肿和周围炎性浸润;肾脏可见肾小球水肿和周围炎性浸润。中剂量SMF 灌胃显著减轻肺泡水肿和周围炎性浸润,中、高剂量SMF 灌胃显著减轻肝、肾损伤和炎性浸润(图2-A)。给予LPS 后24 h 血清肝损伤指标(ALT、AST)和肾损伤指标(BUN、Cr)显著升高,低、中剂量SMF 灌胃显著降低血清ALT、AST 活力,减轻肝损伤(图2-B);SMF灌胃显著降低血清BUN、Cr 水平,缓解肾损伤,且具有剂量依赖性(图2-C)。SMF 腹腔注射对脓毒症小鼠组织损伤无显著改善作用。
3.3 灌胃SMF 降低脓毒症小鼠外周血中性粒细胞、单核细胞和巨噬细胞比例
为了考察SMF 对脓毒症早期外周血固有免疫细胞的调控作用,采用流式细胞术测定LPS和CLP脓毒症模型小鼠外周血单核、巨噬细胞和中性粒细胞比例变化。LPS模型小鼠24 h外周血单核、巨噬细胞和中性粒细胞比例显著上调,SMF 灌胃显著降低24 h 外周血巨噬细胞比例,对单核细胞和中性粒细胞比例无显著影响(图3-A)。CLP 模型小鼠24 h 外周血单核、巨噬细胞和中性粒细胞比例亦显著升高,SMF 灌胃对单核、巨噬细胞和中性粒细胞均有显著降低作用(图3-B)。SMF 腹腔注射对LPS和CLP模型外周血单核、巨噬细胞和中性粒细胞无显著影响。结果表明,SMF 灌胃显著降低脓毒症小鼠外周血固有免疫细胞水平,对脓毒症早期免疫过度激活状态具有潜在的抑制作用。
3.4 肠道菌群介导SMF对脓毒症小鼠的治疗作用
对脓毒症小鼠的药效考察发现,SMF 灌胃具有显著的脓毒症治疗作用和免疫调节作用,而腹腔注射无显著作用。为了验证SMF 是否依赖肠道菌群发挥抗脓毒症作用,使用ABX 清除小鼠肠道细菌后灌胃给药,考察SMF 抗脓毒症药效(图4-A)。组织切片H&E 染色结果表明,与模型组相比,SPF 组SMF 灌胃可显著减轻LPS诱导的肝、肺、肾组织病理损伤和炎性细胞浸润,而ABX 组SMF灌胃无显著改善作用(图4-B)。与模型组相比,SPF 组SMF 灌胃显著降低血清IL-6、ALT、AST、BUN、Cr水平,而ABX组SMF灌胃对上述指标无显著下调作用(图4-C ~ 4-E)。ABX 处理后SMF 失去抗脓毒症药效,表明SMF 灌胃的脓毒症保护作用可能由肠道菌群介导。
3.5 FMT缓解LPS诱导的小鼠脓毒症
为了进一步验证肠道菌群在SMF 抗脓毒症中的作用,小鼠经ABX 处理后作为受体鼠,移植预给药SMF供体鼠的粪菌后腹腔注射LPS,考察受体鼠是否获得了抗脓毒症表型。组织切片H&E染色结果表明,与模型组相比,SMF 灌胃14 d 显著的改善供体鼠肝、肺、肾组织损伤和炎性浸润;与移植对照粪菌相比,移植SMF 粪菌显著缓解脓毒症受体鼠肝、肺、肾组织病理损伤和炎性细胞浸润(图5-A)。与模型组相比,SMF 灌胃14 d 显著降低供体鼠血清IL-6、ALT、AST、BUN、Cr水平;与此一致,与移植对照粪菌相比,移植SMF 粪菌亦显著下调脓毒症受体鼠血清IL-6、ALT、AST、BUN、Cr 水平(图5-B ~ 5-D)。与仅给予ABX 的模型组相比,给予对照粪菌并未改善LPS诱导的脓毒症,表明正常小鼠粪菌无脓毒症保护作用。SMF 灌胃供体鼠粪菌移植使受体鼠获得抗脓毒症表型,表明SMF 作用于肠道菌群,发挥对脓毒症小鼠的治疗作用。
4 讨 论
SMF 作为临床脓毒症常规西医疗法的辅助手段,能够一定程度增强治疗效果,改善患者预后,但其药理机制尚未完全阐明。本研究基于脓毒症动物模型考察SMF 对脓毒症的药效,发现灌胃SMF 能够显著提高脓毒症小鼠生存率,降低血清炎症因子,减轻肝、肺、肾组织病理损伤,下调血清组织损伤相关生化指标,且对于肾损伤的改善作用具有显著的剂量依赖性;而SMF 腹腔注射不能改善LPS 诱导的脓毒症。SMF 主要活性成分皂苷类经口给药生物利用度极低,却有较好的抗脓毒症作用。这表明SMF 可能通过调节肠道菌群稳态,或经肠道菌群代谢后产生活性代谢物,发挥抗脓毒症作用。通过ABX 处理和FMT 初步验证了SMF 抗脓毒症组织损伤和炎症风暴的作用由肠道菌群介导。后续将进一步验证SMF 对脓毒症小鼠外周血固有免疫细胞比例的调节作用是否依赖于肠道菌群。
脓毒症状态下肠道菌群稳态破坏,菌群组成紊乱,表现为条件致病菌的相对丰度增高,进而导致肠道微生物代谢组的失调[18-19]。越来越多的证据表明,肠道菌群通过调节肠道内源性代谢(胆汁酸、短链脂肪酸等)、屏障功能(紧密连接和内毒素移位)和免疫防御功能在脓毒症发生发展中发挥至关重要的作用[20-23]。靶向肠道菌群是治疗脓毒症潜在治疗策略,SMF 可能通过调节脓毒症状态下肠道菌群的稳态(包括有益菌和致病菌的相对丰度)、肠道屏障功能和肠道菌群所介导的内源性代谢,减轻组织损伤和炎症响应,发挥免疫调控功能,但目前这种关联缺乏直接的实验证据[24]。因此未来的工作将集中于肠道微生物组和肠道代谢组的相关性分析,研究SMF 主要调节的肠道菌和相关代谢物及其下游信号通路对脓毒症病理进程的影响,以及关联代谢物作为脓毒症不同病理阶段生物标志物的开发。
SMF 的物质基础研究表明,复方中主要包括三萜皂苷、甾体皂苷、木脂素类、黄酮类、糖类和有机酸类等物质[25]。三萜皂苷类物质的抗炎活性已被广泛报道[26-27];五味子素类具有抗氧化应激活性[28]。人参皂苷已被证实通过调节肠道菌群稳态改善结肠炎、关节炎等炎症性疾病[29-30]。未来将重点关注SMF 能否通过多种活性组分调节不同肠道菌的相对丰度,进而影响肠道代谢组和肠道免疫环境,发挥多靶点协同效应。这有助于阐明SMF作为抗脓毒症药物的物质基础和分子机制,对临床预防和治疗脓毒症具有重要的研究意义。

