全胸腔镜微创心脏手术临床疗效分析
张 泽, 蒋 伟, 李思聪, 韦科全, 罗金龙, 龙小毛
随着临床技术发展和设备更新,微创手术已广泛开展,心脏外科领域已逐渐开展全胸腔镜心脏手术,其具有损伤小、易接受、恢复快和病死率低等优点[1],在临床上具有很大的推广价值[2]。西安西京医院于2000年在我国首次开展全胸腔微创心脏手术[3],近年来国内心脏外科全胸腔镜微创技术也取得了迅速发展。广西壮族自治区人民医院心胸血管外科自2013年1月至2021年5月共完成全胸腔镜微创心脏外科手术206例,临床疗效满意,现报道如下。
1 资料与方法
1.1临床资料 回顾性分析广西壮族自治区人民医院自2013年1月至2021年5月完成的206例心脏病全胸腔镜微创心脏手术的临床资料,其中男97例,女109例,年龄3~67岁。其中房间隔缺损109例,伴三尖瓣中、重度关闭不全32例;二尖瓣瓣膜病58例,伴有三尖瓣中、重度关闭不全28例,合并血栓6例;单纯三尖瓣关闭不全22例;左房黏液瘤17例。
1.2手术方法
1.2.1 体位与麻醉 患者取仰卧位,右肩垫高30°,右手手臂抬高并将右上肢固定在头侧,上臂用棉垫作保护,防止手臂过伸致神经损伤。麻醉方法同传统手术麻醉方法基本一致,成人采用双腔插管,小儿采用单腔气管插管并使用封堵器。麻醉成功后开始手术,予左侧单肺通气,升主动脉阻断后停呼吸机,体外循环结束,无活动出血后双肺通气,手术结束后更换单腔气管插管及拔除封堵器。
1.2.2 手术径路 全胸腔镜(STORZ,型号:N-90X0568-G)手术胸壁做2个孔,分别为操作孔与腔镜及辅助孔。操作孔切口3.5~4.0 cm,位于第4肋间腋前线与腋中线之间(见图1ⓐ),下腔静脉阻断带通过此孔。腔镜及辅助孔切口2~2.5 cm,位于第4肋间腋后线,腔镜、左心吸引、灌注管、上腔静脉阻断带、主动脉阻断钳、二氧化碳吹气管通过此孔。心房拉钩通过穿刺第3肋间进入胸腔,均放置保护套。
1.2.3 体外循环的建立 于右侧腹股沟区做一长2~3 cm手术切口。肝素化,分别游离股动、静脉。麻醉医师通过颈内静脉穿刺置入上腔引流管(儿童不行此插管),分别行股动、静脉插管。对于股静脉插管,成人插单腔管,儿童则插双腔管,连接好体外循环各管道后开始行体外循环。在上腔静脉回流较差的情况下,可适当使用负压吸引。通过胸腔镜观察孔在主动脉根部插入灌注针,阻断钳阻断升主动脉后,灌注心肌保护液。
1.2.4 心脏手术操作 左肺通气,于右侧膈神经前1 cm处平行右侧膈神经做心包切口,切口两侧均悬吊心包,2~3针通过腔镜孔及操作孔引出,直到充分暴露操作空间,体外循环开始。(1)右心手术(心脏不停跳):10号丝线胶管阻断上腔静脉,通过腔镜观察孔引出;棉绳胶管阻断下腔静脉,通过主操作孔引出。在房间沟上缘约1 cm处,平行切开右房,将三尖瓣及房间隔暴露,行房间隔缺损修补术及三尖瓣成形术。(2)左心手术(心脏停跳):主动脉根部荷包缝合
灌注管,阻断升主动脉后灌注氧合血停跳液或组氨酸-色氨酸-酮戊二酸(histidine-tryptophan-ketoglutarate,HTK)停跳液作心肌保护。在右心手术完成后缝合右房切口,开放上、下腔静脉。在右上下肺静脉根部平行房间沟切开左房壁,在第4肋间胸骨旁1~2 cm穿刺,使用微创左房拉钩沿穿刺孔向上方牵拉,暴露左房及二尖瓣。左房黏液瘤手术,沿着蒂部完整切除,蒂部用电凝灼烧,注意保护二尖瓣。发现左房内有血栓,则先取出血栓再行瓣膜置换或成形术。二尖瓣腱索断裂,则用Gore-Tex线重建腱索,二尖瓣瓣环则用成形环加固。二尖瓣置换术(mitral valve replacement,MVR)采用间断褥式缝合的方法,一般缝合12~14针,然后将瓣环线固定于外面金属线圈上,以防瓣环线顺序错乱及出现绕线的情况,影响手术效率。然后在体外将瓣环线缝合在人工瓣膜上,再将带有瓣环线的人工瓣膜缓慢送入心内,使用特制的推结器打结,检查线结是否牢固以及人工瓣膜瓣环活动是否受限。
1.2.5 心脏排气和复跳 主要操作快要完成前开始复温,复跳前头低位,停止左心吸引,二氧化碳填充左房,鼓肺排气后缝合左房切口,反复缓慢挤压心脏。主动脉根部排气,并将排气针的管道与静脉引流管相连,持续排气,开放升主动脉,心脏复跳。若出现心室颤动,则应用电除颤恢复心率。
1.2.6 体外循环撤离 心脏切口全部缝合完毕,心包、胸壁切口无活动性出血后才考虑停机。停机前,将双腔气管插管更换成单腔气管插管,或取出封堵器。吸除呼吸道痰液,膨肺。循环稳定后,缓慢减流量,先拔除颈内静脉插管和(或)股静脉插管,予鱼精蛋白中和肝素,观察有无鱼精蛋白过敏反应,再拔除股动脉插管。术毕于腔镜观察孔置入胸腔引流管。
2 结果
所有患者手术顺利完成,无死亡病例。全组无术后残余漏、瓣周漏,无二次开胸止血。1例患者因过度肥胖操作困难,遂扩大操作孔切口至12 cm左右,胸腔镜辅助下完成手术。术后并发症包括右侧少至中量胸腔积液12例,需穿刺抽液或胸腔闭式引流5例,胸部或腹股沟切口液化4例,均经治疗后痊愈。手术时间(268.8±70.6)min,体外循环时间(140.3±64.7)min,升主动脉阻断时间(98.1±56.3)min。术中出血量(230±140)ml。术中用血浆(232±245)ml,红细胞(2.1±1.5)U。ICU监护时间(28.6±22.4)h,呼吸机辅助时间(16.4±10.3)h。术后引流(598±210)ml,术后输血浆(446±330)ml。平均术后4.8 d拔除引流管,术后住院时间(12.6±4.7)d。56.8%(117/206)的患者在住院期间未输血。术后随访1~60个月,患者心功能良好,纽约心脏协会(New York Heart Association,NYHA)分级均≤Ⅱ级。典型病例术中、术后情况见图1。
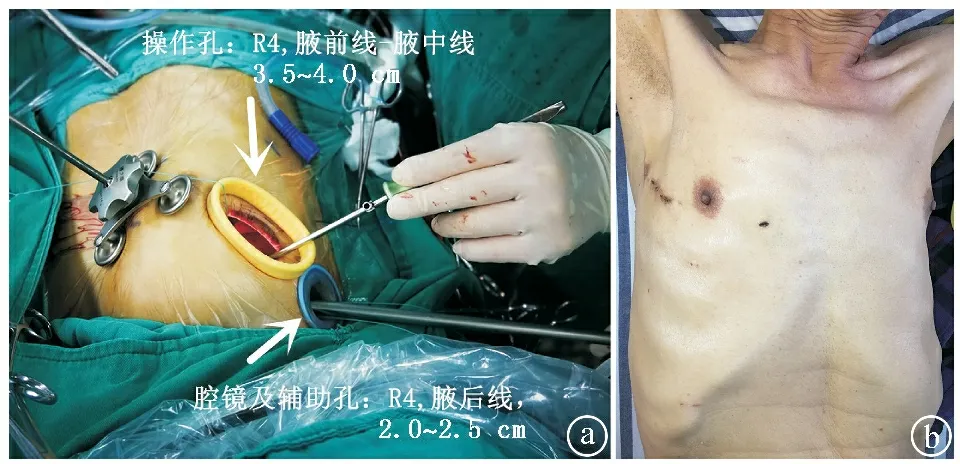
ⓐ手术切口长度及位置,R4表示第4肋间;ⓑ术后切口瘢痕
3 讨论
微创心脏手术是当前的流行术式,全胸腔镜微创心脏手术是心脏外科领域一项具有重要意义的新技术[4]。同时,机器人技术应用于心脏手术已被证实是一种可行的、安全和有效的技术[5-7]。有研究指出,完全性胸腔镜微创心脏手术具有良好的临床疗效,术后并发症更低且可以使手术切口更美观,能有效减少手术瘢痕增生[8]。与传统正中开胸手术相比,全胸腔镜手术具有损伤小、易接受和恢复快等优点,具有推广价值。
3.1手术切口选择 本组病例手术切口均为单操作孔,男性患者手术切口为右侧腋前线与腋中线第4肋间;女性患者切口为右侧乳房反褶处弧形切口,注意保护乳房正常形态,通过伤口贴膜把右侧乳房向头侧偏左方向固定,充分展开肋间隙,仍从第4肋间腋前线与腋中线之间进胸,切口长度约3.5 cm。经第4肋间腋后线切口2.5 cm作为腔镜观察孔。目前国内较早开展全胸腔镜手术心脏中心的报道大多为双操作孔[9-10],右胸壁第一孔位于右胸骨旁第3肋间,第二孔位于右腋中线第3或4肋间,第三孔位于右腋前线第7肋间。第三孔为腔镜观察孔,其余两孔为操作孔。有报道认为以乳晕切口作为主操作孔,切口看似更隐蔽、美观,但仍不可避免会破坏乳腺结构,影响乳腺发育[11-13]。本研究的单操作孔与国内大多数中心双操作孔相比,尤其是女性患者,具有更加微创的特点,更符合生理和美观的要求。本组1例患者因过度肥胖致操作空间极小、缝合极其困难,遂扩大切口改为胸腔镜辅助下完成手术,也没有增加心脏停跳时间和体外循环时间。因此,对于年轻手术医师,切口位置可以与本研究类似,但切口可以大一些,从直视切口手术到直视显示屏手术过渡,逐渐缩小切口,缩短学习曲线,即使术中有突发情况,也可延长切口,顺利完成手术。因此,本研究手术切口的选择更具有可操作性和先进性,更值得推广。
3.2停跳或不停跳手术 心脏不停跳技术一直以来存有一定争议,有研究认为非体外循环心脏不停跳技术并不能减少术后炎症因子IL-6和IL-8的产生[14];也有学者认为,心脏不停跳技术可有效减少心肌细胞凋亡、心肌缺血损伤及再灌注损伤[15-17]。心脏不停跳技术可以缩短体外循环时间、手术时间及呼吸机通气时间,降低住院时间和费用,尤其是对于高风险及二次手术患者获益更显著[18-21]。本研究的右心手术,如房缺修补或三尖瓣成形等,均可在体外循环心脏不停跳下进行,不阻断升主动脉,减少心肌缺血再灌注损伤,术中术后复查心脏彩超未见残余分流或三尖瓣中重度关闭不全。因此,对于右心手术,全胸腔镜心脏不停跳技术也是一种可以选择的、有效的术式之一,但仍需更多设计严谨、前瞻性的对比研究以及更多基础生理实验来进一步证实全胸腔镜心脏不停技术的优势。
综上所述,本研究的技术路线是可行的,先进的,切口美观,符合生理需求,学习曲线短,结合不停跳技术优势,值得临床推广。

