西格列汀通过降低脑内炎性因子水平改善糖尿病小鼠学习记忆能力
韩丽男,周 游,陈 旭,李佳男
(哈尔滨商业大学 药学院,黑龙江 哈尔滨 150076)
根据国际糖尿病联盟(The International Diabetes Federation,IDF)2021全球糖尿病地图(第10版)最新数据显示,2021年全世界有5.37亿糖尿病(diabetes mellitus,DM)患者;到2030年,DM患者预计会达到6.43亿;到2045年将上升到7.83亿[1],成为继心血管疾病和恶性肿瘤后的第三大世界公共卫生问题[2]。2型糖尿病(type 2 diabetes mellitus,T2DM)是较常见的一种DM类型,占DM总数的95 %以上[3]。T2DM患者的典型特征为高血糖,持续的高血糖状态会引起机体炎症反应,其中神经炎症可损坏脑功能的完整性,导致认知功能下降[4]。肿瘤坏死因子α(tumour necrosis factor-α,TNF-α)、白介素6(interleukin,IL-6)、IL-1β等在神经炎症中发挥着重要作用[5]。
二肽基肽酶4(dipeptidyl peptidase 4,DPP-4)抑制剂是口服治疗DM药物,以葡萄糖依赖的方式进行血糖调节[6]。本研究采用高糖高脂饮食联合小剂量(80 mg/kg)STZ建立T2DM小鼠模型,探讨DPP-4抑制剂磷酸西格列汀对T2DM小鼠的学习记忆能力的影响。
1 仪器与材料
1.1 仪器
ZZ-611800自主活动仪(成都泰盟科技有限公司);WMT-100Morris分析系统(成都泰盟软件有限公司);TDL-60B低速台式离心机(上海安亭科学仪器厂);RT-6000酶标分析仪(深圳雷杜生命科学股份有限公司)。
1.2 试药
磷酸西格列汀片(杭州默沙东制药有限公司);链脲佐菌素(美国Sigma公司);GSP、TC、TG、LDL-C、HDL-C测试盒(南京建成生物工程研究所);INS、C-P、IL-6、TNF-α、IL-1β试剂盒(上海酶联生物科技有限公司)。
1.3 动物
SPF级健康雄性ICR小鼠45只,体重(20±2)g(长春市亿斯实验动物技术有限责任公司),实验动物许可证号:SCXK(吉)-2020-0002。符合国家实验室动物伦理保护标准及相关法律规定。实验期间动物自由采食饮水。
2 方法
2.1 模型制备、动物分组及给药
所有小鼠适应性喂养1 w后,按体重随机抽取15只小鼠作为空白对照组,其余小鼠高脂饲料喂养4 w后,禁食不禁水14 h,腹腔注射STZ柠檬酸-柠檬酸钠缓冲液(80 mg/kg),空白组小鼠注射等剂量的柠檬酸-柠檬酸钠缓冲液。2 w后尾静脉采血测定小鼠的空腹血糖(fasting blood glucose,FBG),并以FBG>11.1 mmol/L视为模型复制成功的标准。
将模型复制成功的小鼠分为模型组、西格列汀组。西格列汀组动物灌胃给药16.32 mg/(kg·d),模型组和正常对照组每天灌胃等体积纯净水,连续灌胃56 d。
2.2 体质量及空腹血糖的测定
分别于给药的0,2,4,6,8 w测量一次体质量及FBG。
2.3 自主活动、水迷宫、热Y迷宫评价小鼠的活跃程度及学习记忆能力
分别于给药2,4,6,8 w进行自主活动,将小鼠放入自主活动仪适应后,记录5 min内小鼠的活动数及站立数。给药第8 w进行水迷宫及热Y迷宫实验。Morris水迷宫记录120 s内找到平台的时间,即逃避潜伏期;热Y迷宫每臂底部及交界处均铺设电热板,顶部装有信号灯,开始实验时,小鼠适应20 s后,随机选择一臂亮灯不通热,其余两臂不亮灯通热(60~80 ℃),小鼠从起始臂进入,受到热刺激后到达亮灯区停留5 s即为一次训练,每只小鼠重复训练直至达标(以连续20次训练中≥18次正确为达标),最后记录30次实验内的错误次数。综合以上3种方法评价小鼠的活跃程度及学习记忆能力。
2.4 样本采集
所有小鼠禁食不禁水14 h,眼底静脉丛取血,分离血清,置于-80 ℃冰箱中保存。取血完毕后,剥离脑组织,-80 ℃冰箱中保存。进行HE染色的小鼠用1 %戊巴比妥钠腹腔注射麻醉,先用生理盐水、后用多聚甲醛进行心脏灌流,分离小鼠脑组织于多聚甲醛溶液中保存。
2.5 指标检测
2.5.1 血糖血脂相关指标检测 取2.4项下冻存的血清,严格按试剂盒说明书测定C-P、FINS、GSP、TC、TG、HDL-C和LDL-C水平,按相应公式计算胰岛素抵抗指数(HOMA-IR),即HOMAIR=FBG×FINS/22.5。
2.5.2 脑组织炎性因子TNF-α、IL-6、IL-1β含量测定 取2.4项下冻存的脑组织,严格按照试剂盒说明书测定炎性因子TNF-α、IL-6、IL-1β含量。
2.5.3 HE染色观察海马神经元形态 取2.4项下保存的脑组织,乙醇梯度脱水,二甲苯脱腊,置于苏木精-伊红中进行染色,荧光显微镜下观察海马神经元的形态结构。
2.6 统计学分析
应用SPSS 26.0统计软件分析数据,结果均以平均值±标准差(±s)表示。两组间比较采用独立样本t检验,多组均数比较采用单因素方差分析,两两比较采用LSD。P<0.05为差异有统计学意义,P<0.01为差异有高度统计学意义。
3 结果
3.1 西格列汀对T2DM小鼠体质量的影响
与空白组比较,模型组体重显著上升(P<0.01,P<0.05);与模型组比较,西格列汀组体质量有下降趋势但差异无统计学意义(P>0.05);给药第4 w西格列汀组体质量下降,与模型组比较,差异有统计学意义(P<0.05)。结果显示西格列汀对T2DM小鼠体重有一定的改善作用。见图1。

图1 西格列汀对糖尿病小鼠体质量的影响
3.2 西格列汀对T2DM小鼠FBG的影响
与空白组比较,模型组FBG 显著上升(P<0.01),表明模型建立成功;与模型组比较,西格列汀组FBG显著下降(P<0.01,P<0.05)。结果显示西格列汀对T2DM小鼠有显著的降血糖作用。见图2。
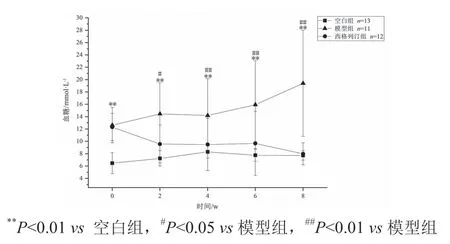
图2 西格列汀对糖尿病小鼠FBG的影响
3.3 西格列汀对T2DM小鼠行为学的影响
与空白组相比,模型组自主活动活动数及站立数均低,第2,8 周与空白组差异有高度统计学意义(P<0.01),表明糖尿病使小鼠行为活跃程度下降;西格列汀组与模型组相比,自主活动活动数及站立数均有所升高,第8周与模型组差异有统计学意义(P<0.05,P<0.01)。结果表明西格列汀能改善T2DM小鼠精神萎靡的状态。见表1、表2。
表1 西格列汀对糖尿病小鼠自主活动活动数的影响(±s)
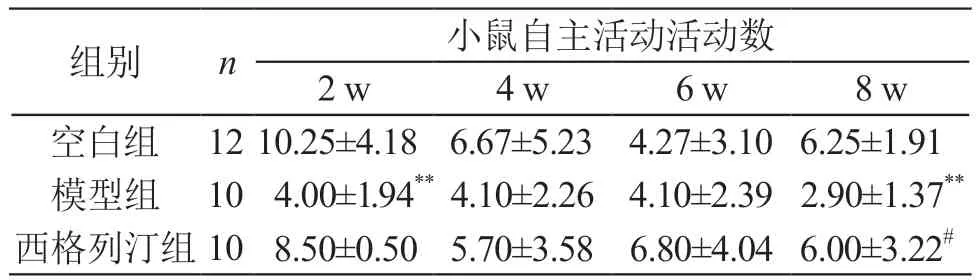
表1 西格列汀对糖尿病小鼠自主活动活动数的影响(±s)
注:**P<0.01 vs 空白组;#P<0.05 vs 模型组
组别 n 小鼠自主活动活动数2 w 4 w 6 w 8 w空白组 12 10.25±4.18 6.67±5.23 4.27±3.10 6.25±1.91模型组 10 4.00±1.94** 4.10±2.26 4.10±2.39 2.90±1.37**西格列汀组10 8.50±0.50 5.70±3.58 6.80±4.04 6.00±3.22#
表2 西格列汀对糖尿病小鼠自主活动站立数的影响(±s)
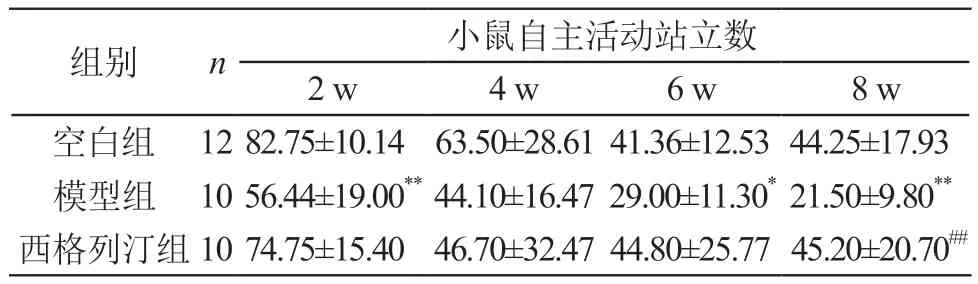
表2 西格列汀对糖尿病小鼠自主活动站立数的影响(±s)
注:**P<0.01 vs 空白组;##P<0.01 vs 模型组
组别 n 小鼠自主活动站立数2 w 4 w 6 w 8 w空白组 12 82.75±10.14 63.50±28.61 41.36±12.53 44.25±17.93模型组 10 56.44±19.00** 44.10±16.47 29.00±11.30* 21.50±9.80**西格列汀组10 74.75±15.40 46.70±32.47 44.80±25.77 45.20±20.70##
通过Morris水迷宫实验发现,与空白组相比,模型组的逃避潜伏期有延长趋势,第1次、第7次及第11次测试与空白组差异有统计学意义(P<0.05),表明T2DM小鼠的空间学习记忆能力出现减退;西格列汀组与模型组相比,逃避潜伏期有缩短趋势,但差异无统计学意义(P>0.05)。见图3。与空白组比较,模型组测试期轨迹图较复杂;与模型组比较,西格列汀组测试期轨迹清晰。见图4。
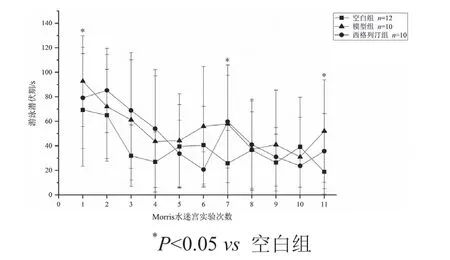
图3 西格列汀对糖尿病小鼠逃避潜伏期的影响
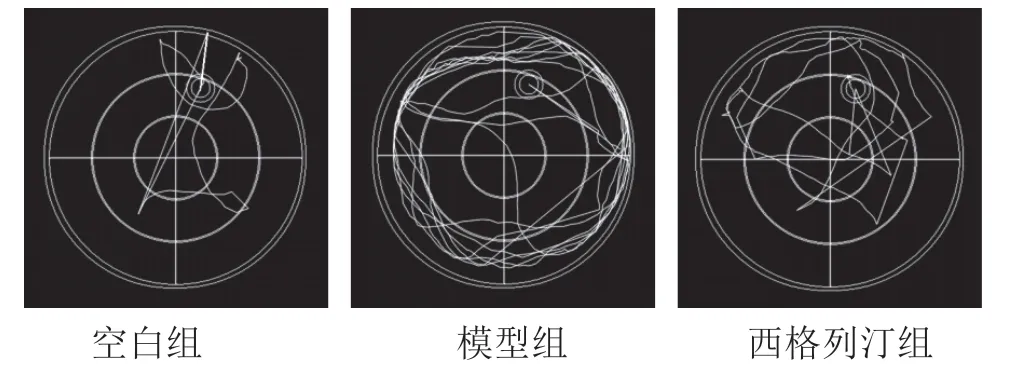
图4 各组小鼠测试期定位航行轨迹图
与空白组相比,模型组热Y迷宫学习次数及错误次数显著增多(P<0.01);与模型组相比,西格列汀组学习次数及错误次数显著减少(P<0.05,P<0.01)。见表3。

表3 西格列汀对糖尿病小鼠热Y迷宫学习次数及错误次数的影响
Morris水迷宫和热Y迷宫数据结果表明西格列汀能改善DM小鼠学习记忆能力。
3.4 西格列汀对T2DM小鼠糖代谢相关指标的影响
与空白组相比,模型组FINS、HOMA-IR、GSP水平及C-P水平显著升高(P<0.01),表明给予高糖高脂饲料联合小剂量STZ诱导后的T2DM小鼠血糖维持着较高水平,胰岛素水平升高,出现明显的胰岛素抵抗特征;与模型组相比,西格列汀组FINS、HOMA-IR、GSP水平及C-P水平显著降低(P<0.01,P<0.05),结果表明西格列汀对T2DM小鼠降糖效果较好,改善胰岛素抵抗效果极佳。见表4。
表4 西格列汀对糖尿病小鼠糖代谢相关指标的影响(±s)
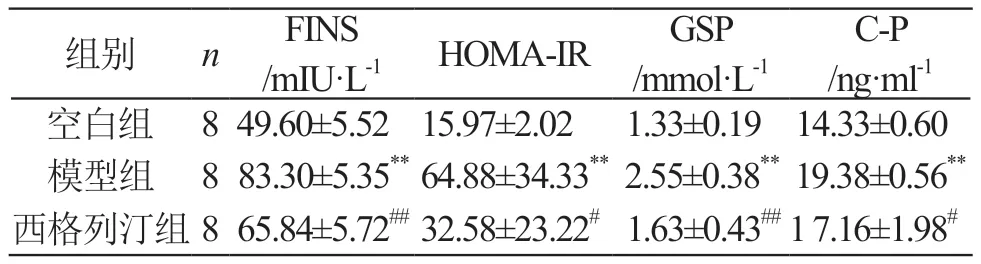
表4 西格列汀对糖尿病小鼠糖代谢相关指标的影响(±s)
注:**P<0.01 vs 空白组;#P<0.05 vs 模型组,##P<0.01 vs 模型组
组别 n FINS/mIU·L-1 HOMA-IR GSP/mmol·L-1 C-P/ng·ml-1空白组 8 49.60±5.52 15.97±2.02 1.33±0.19 14.33±0.60模型组 8 83.30±5.35**64.88±34.33** 2.55±0.38** 19.38±0.56**西格列汀组8 65.84±5.72## 32.58±23.22# 1.63±0.43##1 7.16±1.98#
3.5 西格列汀对T2DM小鼠脂代谢相关指标的影响
与空白组相比,模型组TG、TC、LDL-C水平显著升高(P<0.01,P<0.05),而HDL-C水平显著降低(P<0.05),表明T2DM小鼠体内脂质代谢发生紊乱;与模型组相比,西格列汀组TG、TC水平显著降低(P<0.05),同样LDL-C水平也降低但差异无统计学意义(P>0.05),HDL-C水平显著升高(P<0.01),说明西格列汀对T2DM小鼠脂质代谢紊乱有较好的调节作用。见图5A、B、C、D。
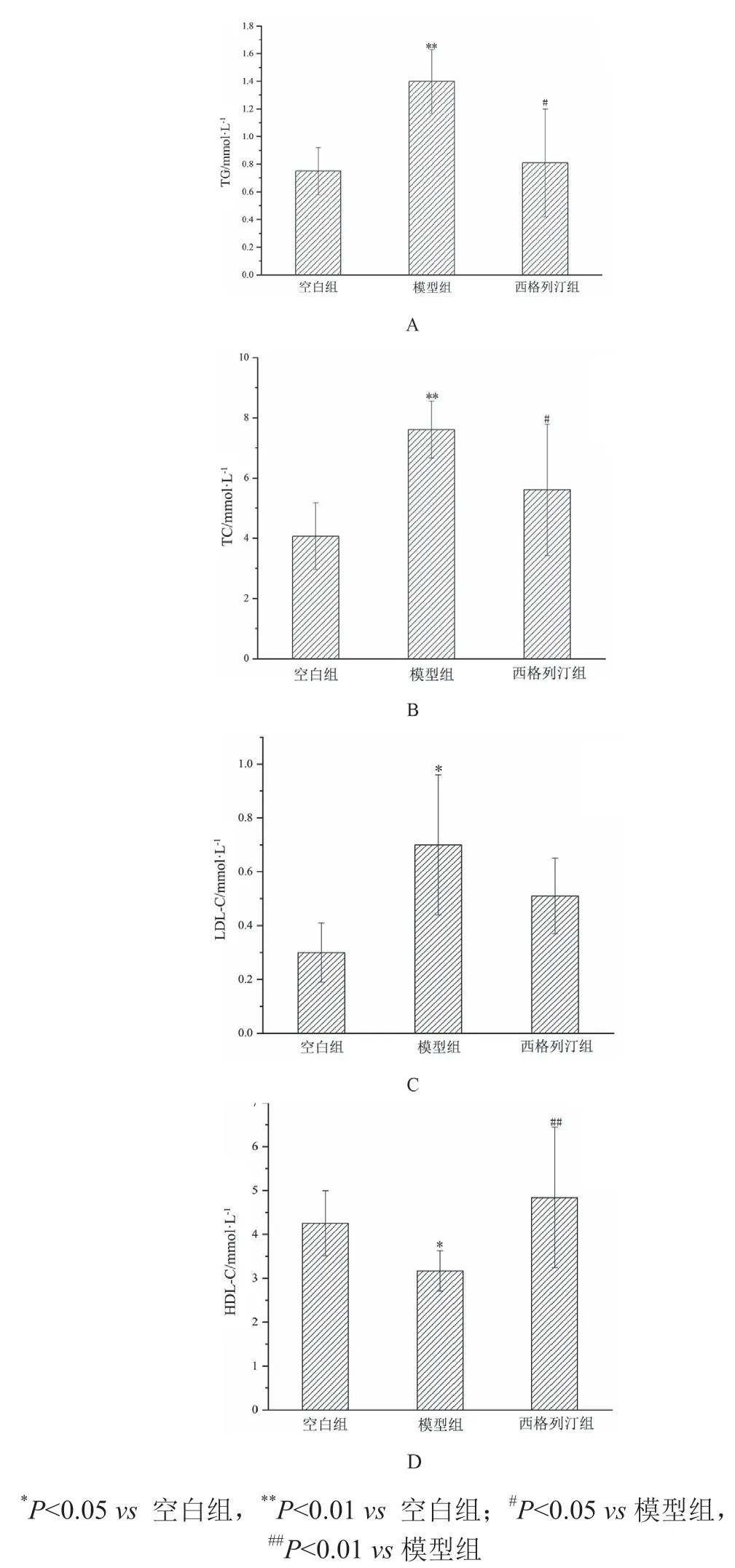
图5 西格列汀对糖尿病小鼠脂代谢相关指标的影响
3.6 西格列汀对T2DM小鼠脑组织炎性因子TNF-α、IL-6、IL-1β的影响
与空白组相比,模型组TNF-α、IL-6、IL-1β水平显著升高(P<0.01);与模型组相比,西格列汀组TNF-α、IL-6、IL-1β水平显著降低(P<0.01)。西格列汀可显著降低DM小鼠脑组织炎性因子TNF-α、IL-6、IL-1β水平。见表5。
表5 西格列汀对糖尿病小鼠脑组织炎性因子TNF-α、IL-6、IL-1β的影响( ±s)

表5 西格列汀对糖尿病小鼠脑组织炎性因子TNF-α、IL-6、IL-1β的影响( ±s)
注:**P<0.01 vs 空白组;##P<0.01 vs 模型组
组别 n TNF-α/pg·L-1 IL-6/pg·L-1 IL-1β/pg·L-1空白组 7 2.81±0.30 198.82±31.46 475.61±40.79模型组 7 5.37±0.21** 320.75±16.60** 611.33±64.13**西格列汀组7 3.44±1.10## 216.84±34.12##502.31±41.40##
3.7 西格列汀对T2DM小鼠海马CA1、DG区的影响
空白组小鼠海马CA1、齿状回(dentate gyrus,DG)区细胞排列紧密,胞核清晰;模型组小鼠海马CA1、DG区细胞排列松散;西格列汀组CA1、DG区细胞排列松散现象减轻。见图6。
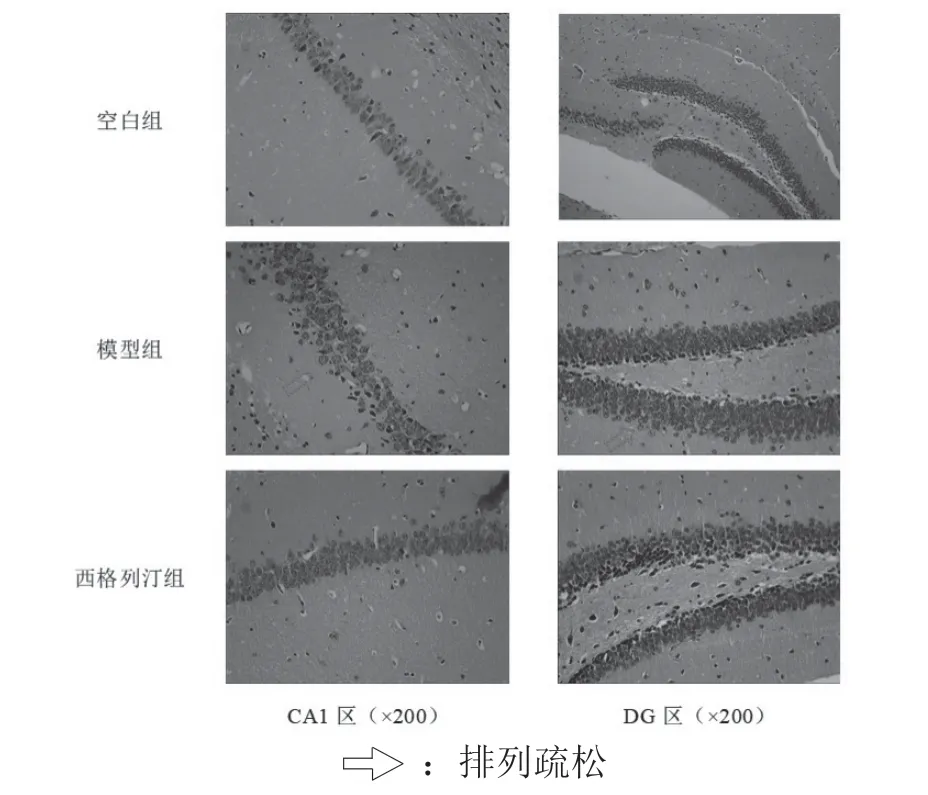
图6 西格列汀对糖尿病小鼠海马CA1、DG区的影响
4 讨论
T2DM已经成为威胁人类生命健康的全球性问题,T2DM患者中60 %~70 %会伴有轻度认知障碍(mild cognitive impairment,MCI)[7],严重者可发展为痴呆。目前T2DM并发MCI的机制尚未完全阐明,可能与非病理因素如高龄、文化程度低、吸烟[8],病理因素如T2DM病程长、高血糖、炎症反应、氧化应激、胰岛素抵抗相关。近年炎症因子在T2DM并发MCI机制探究中受到高度重视。
本实验室前期采用高糖高脂饲料联合不同剂量(80,90,100 mg/kg)的1%STZ进行T2DM模型的复制,发现80 mg/kg和100 mg/kg剂量下成模率均高于90 mg/kg,且二者成模率相近,本着节约成本原则,最终采用80 mg/kg进行腹腔注射。正常机体各项指标会维持在一个稳定的水平,而T2DM小鼠糖脂代谢发生紊乱,当给予西格列汀后,与模型组相比,TG、TC、LDL-C含量下降,HDL-C提升,FBG、FINS、HOMA-IR、GSP、C-P均有所不同程度的改善。
西格列汀作为第一个上市的DPP-4抑制剂[9],通过抑制DPP-4活性,减少机体胰高糖素样肽1(glucagon like peptide-1,GLP-1)分解,从而提高GLP-1水平,刺激胰岛素分泌,达到降血糖的目的。该降糖作用具有葡萄糖依赖性,因此发生低血糖的风险较低,安全性高,与实验室前期使用的二甲双胍相比,胃肠道不良反应小,降低了在水迷宫实验中小鼠因体力差异造成的实验结果误差。同时西格列汀还具有保护胰腺、肝脏、肾等器官及抗炎作用,GLP-1可抑制TNF-α等引起的炎性反应[10]。血糖升高会诱导小胶质细胞激活,激发炎症反应,导致促炎因子分泌增加[11],TNF-α、IL-6、IL-1β是关键的炎性因子。本实验结果表明,与空白组相比较,模型组促炎因子TNF-α、IL-6、IL-1β水平显著增加。TNF-α、IL-6表达增加会破坏血脑屏障[12-13],TNF-α还可通过增加神经兴奋性引起海马缺血性损伤,IL-1β可损害神经网络结构[14],这些炎性因子相互作用,产生联级反应,发生神经炎症,进一步导致认知受损。给予西格列汀药物后DM小鼠脑组织TNF-α、IL-6、IL-1β水平下降显著。
本实验联合3种行为学方法进行学习记忆能力的测试。自主活动可反应中枢神经系统的兴奋性,可清晰直观地反映出T2DM鼠精神萎靡、不爱活动的特点;水迷宫是探究空间学习记忆能力的经典实验,在精神科学领域广泛应用[15],该实验方法记录小鼠搜寻目标的时间和运动轨迹,有助于探究其学习、记忆、空间定向及认知能力;热Y迷宫实验装置由本实验室自主设计[16],热Y迷宫与传统的Y迷宫相比,给予热刺激可增加小鼠的运动趋向性,比八臂迷宫更为简单,实用性强。自主活动、水迷宫及热刺激联合Y迷宫3种方法联合使用,可提高行为学实验结果的准确度。模型组部分小鼠出现毛色无光泽、精神萎靡、自发活动减少的现象,给予西格列汀药液后小鼠毛色及精神状态有所改善。行为学实验结果显示,与空白组相比,模型组小鼠学习记忆能力出现异常;给予西格列汀的小鼠学习记忆能力得到改善,在热刺激联合Y迷宫实验中小鼠学习和记忆能力的提高尤为明显,这可能与西格列汀下调炎性因子TNF-α、IL-6、IL-1β水平,减轻小鼠脑部炎性损伤有关。
综上,本实验制备的T2DM小鼠模型表现出肥胖、高血糖、胰岛素抵抗、行为学出现异常,提示复制的T2DM小鼠可作为探究T2DM小鼠的学习记忆能力的实验模型。西格列汀能有效改善T2DM小鼠的糖脂代谢水平,并可能通过降低脑组织炎性因子水平提高T2DM小鼠的学习记忆能力。

