基于多指标综合评分法优选参菖益智胶囊组方配比
曲远均,张天泽,邱丽丽,师 冉
(1. 山东中医药大学附属医院,山东 济南 250011;2. 北京中医药大学中医学院,北京 100029;3. 滨州职业学院,山东 滨州 256603;4. 山东第一医科大学第一附属医院中医科,山东 济南 250011)
老年痴呆症又名阿尔茨海默症,是一种起病隐匿的进行性发展的神经系统退行性疾病,以记忆力下降、认知功能障碍、意识障碍、生活自理能力及社会活动能力下降甚至丧失为特征[1]。由于该病的发病机制尚不明确,目前上市的药物对于该病的治疗仅能延缓疾病进程和改善症状,治疗效果有限。近年中药复方凭借其多组分、多靶点和协同作用的特点,在治疗复杂疾病中显示出了极大的优势,中药复方治疗老年痴呆药物研发领域也受到了愈来愈多的关注[2-4]。目前市场上治疗老年痴呆的中药制剂,或处方庞大,工艺、剂型相对落后,影响药物作用的集中发挥;或产品研发定位单一;亦或是产品的作用机制不够明确[5-7]。针对老年痴呆痰瘀痹阻、肾精亏虚及心肾不交的致病特点,经方开心散在治疗老年痴呆方面有疗效确切、效果显著等优点[8-13],但仍存在制备工艺落后、质量标准不完备等缺点。
本课题前期以临床疗效和抗老年痴呆的有效组分为依据,对经方开心散开展了处方优化和药物剂量筛选,结合相关文献资料[8,14-17],最终将人参和石菖蒲两味药作为处方药味。由于人参与石菖蒲中的成分颇多,在试验过程中若单纯以君药人参中人参皂苷的转移率作为质量控制指标优化人参和石菖蒲的配伍比例,不能确定药效是否最佳。本研究利用氢溴酸东莨菪碱诱导建立小鼠痴呆模型,借助Morris水迷宫定位航行和空间探索实验,选取典型药效指标,结合君药人参中人参皂苷Rg1、Re、Rb1的转移率,对人参与石菖蒲的不同配伍比例进行综合评价筛选。
1 仪器与材料
1.1 仪器
Agilent 1260高效液相色谱仪(美国安捷伦科技有限公司);Morris水迷宫动物行为学分析系统(上海欣软信息科技有限公司);Mettler AE240十万分之一电子分析天平(德国Mettler公司);LC-600B型数控超声波仪(山东济宁鲁超超声设备有限公司);电子天平(赛多利斯科学仪器有限公司)。
1.2 材料
人参皂苷Rg1对照品(中国食品药品检定研究院,批号:110703-201933,纯度91.7 %);人参皂苷Re对照品(中国食品药品检定研究院,批号:110754-202028,纯度100 %);人参皂苷Rb1对照品(中国食品药品检定研究院,批号:110704-202028,纯度100 %);乙腈,甲醇,磷酸(色谱纯,美国TEDIA天地试剂公司);氢溴酸东莨菪碱(上海阿拉丁生化科技有限公司,批号:F1713061);吡拉西坦片[华润双鹤利民药业(济南)有限公司,批号:2011228];0.9 %生理盐水(四川科伦药业股份有限公司);水为娃哈哈纯净水。石菖蒲(亳州市沪谯药业有限公司,批号:2102180462);人参(亳州市沪谯药业有限公司,批号:210415),经山东中医药大学附属医院张学顺老师鉴定,各药材饮片均符合《中国药典》2020年版一部项下的有关规定。
1.3 动物
SPF级昆明小鼠,6~8周龄,18~22 g,雄性,购自济南朋悦实验动物繁育有限公司,合格证号:SCXK(鲁)20210007。小鼠饲养于标准条件下,保持12 h/12 h明暗周期(7:00开灯,19:00关灯),温度21±1 ℃,湿度45 %±5 %,自由摄食饮水。饲养小鼠在上述环境中,每日行抓握(控制期)平行操作,熟悉环境,消除人为操作的影响。适应期小鼠5只一笼饲养,随后进入实验,所有实验操作均在暗淡红灯(<25 lux)下进行。本研究涉及的动物实验操作遵从于美国NIH颁布的《实验动物护理和使用指南》,并由山东中医药大学实验动物伦理委员会批准(批准号:DWSY201703013)。
2 方法与结果
2.1 不同配比人参-石菖蒲提取液中人参皂苷Rg1、人参皂苷Re、人参皂苷Rb1的含量测定
2.1.1 色谱条件 Agilent TC-C18色谱柱(4.6 mm×250 mm,5 μm);流动相为0.1 %磷酸水溶液(A)-乙腈(B),梯度洗脱,洗脱程序:0~30 min:19%B(81%A);30~35 min:19%B→24%B(81%A→76%A);35~60 min:24%B→40%B(76%A→60%A);体积流量1.3 ml/min;柱温30 ℃;检测波长203 nm;进样量20 μl。
2.1.2 对照品溶液的制备 精密称取人参皂苷Rg1、Re、Rb1对照品适量,加甲醇制成每1 ml各含200 μg的溶液(人参皂苷Rg1的浓度为213.2 μg/ml,人参皂苷Re 的浓度为202.8 μg/ml,人参皂苷Rb1的浓度为259.6 μg/ml的混合对照品溶液。
2.1.3 供试品溶液的制备 根据人参与石菖蒲不同配伍比例,分为2:1配比组(人参10 g,石菖蒲5 g),2:3配比组(人参10 g,石菖蒲15 g)和2:5配比组(人参10 g,石菖蒲25 g)。称取药材,按前期优化提取方法,各加12倍量水,浸泡1 h,提取2次,每次2.5 h,合并滤液,浓缩,置250 ml量瓶中,用水分次洗涤容器和残渣,洗液滤入量瓶中,加溶剂定容至刻度,摇匀。精密量取10 ml提取液,加二氯甲烷10 ml,萃取3次,弃去二氯甲烷液,置蒸发皿中蒸干,残渣加甲醇溶解并转移至5 ml量瓶中,加甲醇稀释至刻度,摇匀,滤过,取续滤液,即得。
2.1.4 阴性对照溶液的制备 按处方比例,不加人参药材,按2.1.3项下方法制备样品,作为阴性对照溶液。
2.1.5 系统适应性试验 精密量取2.1.2,2.1.3,2.1.4项下对照品溶液、供试品溶液和阴性对照溶液各10 μl,注入高效液相色谱仪。结果供试样品在人参皂苷Rg1、人参皂苷Re、人参皂苷Rb1对照品色谱峰位处有相应色谱峰出现,阴性样品无相应色谱峰出现,说明样品无干扰,专属性良好。
2.1.6 线性关系考察 精密分别吸取2.1.2项下混合对照品溶液1,3,5,7,9,11 μl,置于20 ml量瓶中,加水稀释并定容至刻度,摇匀,注入高效液相色谱仪中进行分析,记录峰面积。以峰面积Y对进样量X(μg)进行线性回归,求得人参皂苷Rg1的回归方程:Y=246.09X-3.03(r=0.9999),表明在0.21~2.35 μg范围内,人参皂苷Rg1线性关系良好;人参皂苷Re的回归方程:Y=222.40X-0.71(r=0.9998),表明在0.20~2.23 μg范围内,人参皂苷Re线性关系良好;人参皂苷Rb1的回归方程:Y=145.41X-3.68(r=0.9999),表明在0.26~2.86 μg范围内,人参皂苷Rb1线性关系良好。
2.1.7 精密度试验 精密吸取2.1.2项下混合对照品溶液,按2.1.1项下色谱条件重复进样6次,分别测定人参皂苷Rg1、人参皂苷Re 和人参皂苷Rb1的峰面积,人参皂苷Rg1的平均峰面积为631.99,RSD=0.05 %;人参皂苷Re的平均峰面积为447.19,RSD=0.12 %;人参皂苷Rb1的平均峰面积为369.16,RSD=0.13 %。结果表明仪器的精密度良好。
2.1.8 重复性试验 精密平行称取人参与石菖蒲配比2:3组样品6份,按2.1.3项下方法制备供试品溶液,按2.1.1项下色谱条件进样测定,人参皂苷Rg1的含量平均值为0.25 %,RSD=0.41 %;人参皂苷Re的含量平均值为0.19 %,RSD=0.96 %;人参皂苷Rb1的含量平均值为0.25 %,RSD=0.30 %。结果表明本法重复性良好。
Effects of parameters of washing machine on the detergency upon different stains 1 48
2.1.9 稳定性试验 精密平行称取2:3配比组样品6份,按2.1.3项下方法制备供试品溶液,按2.1.1项下色谱条件分别于0,2,4,6,8,12,24 h进样,记录峰面积,考察供试品溶液稳定性。结果表明,人参皂苷Rg1的峰面积平均值为633.86,RSD=0.06 %;人参皂苷Re的峰面积平均值为360.23,RSD=0.21 %;人参皂苷Rb1的峰面积平均值为297.90,RSD=0.14 %;表明供试品溶液在24 h内稳定。
2.1.10 加样回收试验 按2:3配伍比例,称取人参药材1.0 g(已知人参样品中人参皂苷Rg1的含量为0.25 %,人参皂苷Re的含量为0.19 %,人参皂苷Rb1的含量为0.25 %)、石菖蒲药材1.5 g,精密称定,共6份,分别置250 ml圆底烧瓶中,各精密加入混合对照品溶液(Rg1的浓度为265.20 μg/ml,Re的浓度为196.60 μg/ml,Rb1的浓度为253.00 μg/ml)10 ml,再按2.1.3项下方法制备供试品溶液。结果表明,人参皂苷Rg1的平均回收率为99.93 %,RSD=2.11 %;人参皂苷Re的平均回收率为102.08 %,RSD=2.05 %;人参皂苷Rb1的平均回收率为102.15 %,RSD=1.80 %。结果表明本法合理可靠。
2.1.11 不同配比人参-石菖蒲提取液的含量测定取2.1.3项下的供试品溶液,按2.1.1项下色谱条件进行测定,每份样品测3次,每一样品之间插测1次混合对照品,参照《中国药典》附录中高效液相色谱法,计算人参皂苷Rg1、人参皂苷Re、人参皂苷Rb1的含量,结果见表1。结果表明,人参与石菖蒲配比2:3时,3种人参皂苷的提取率较配比2:1时显著提高,与配比2:5时的提取率差别不大。
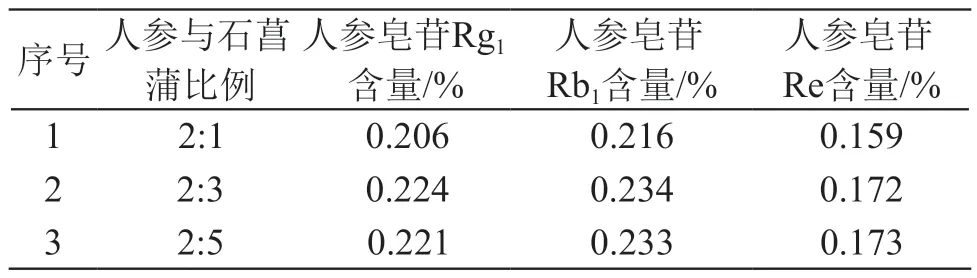
表1 不同配比人参-石菖蒲提取液中3种人参皂苷的含量(n=3)
2.2 不同配比人参-石菖蒲提取液对氢溴酸东莨菪碱诱导的小鼠痴呆模型学习记忆能力的影响
2.2.1 动物分组和造模 54只雄性KM小鼠,体质量20±2 g,适应性饲养3 d后,每组10只,按随机区组设计方法分为6组:正常组、模型组、阳性对照组(吡拉西坦组)、实验组(2:1配比组、2:3配比组、2:5配比组)。模型组、阳性对照组和实验组每日按2 mg/kg剂量腹腔注射,正常组每日注射等量的生理盐水,直至实验结束。
2.2.2 动物给药 造模5 d后,根据前期试验结果,按0.01 ml/g的剂量灌胃给药,阳性对照组和实验组分别给予吡拉西坦溶液和人参石菖蒲提取液3个不同剂量配比(人参与石菖蒲剂量配比分别为2:1,2:3,2:5),正常组和模型组不进行药物干预,每日按相同剂量灌胃给予稀释药物用的灭菌纯净水,连续给药7 d。
2.2.3 统计学方法 采用Spss17.0统计软件对Morris水迷宫定位航行实验和空间探索性实验结果进行分析,数据分析结果以均数±标准差(±s)表示。组间比较采用单因素方差分析(one-way ANOVA)和双因素重复测量的方差分析(two-way repeatedmeasures ANOVA)。方差齐时两两比较采用LSD法,方差不齐则采用Dunnett’s检验。P<0.05为差异具有统计学意义。
2.2.4 Morris 水迷宫实验 采用 Morris 水迷宫进行学习记忆功能的检测。将黑色素食用色粉以温水冲开以隐藏平台,并令其摄像时与小鼠颜色保持鲜明对比,便于追踪。平台位于水面下0.8 cm,水深高21 cm,定位于NW象限,水迷宫内的水温用加热棒保持在恒温22~24 ℃。
2.2.4.1 定位航行实验 按既定的次序选择入水象限,将小鼠托起让其背向池中心,轻轻放入水中。每只小鼠在训练中如能在60 s内找到平台并在平台上留滞时间超过2 s,则认为小鼠寻台成功,记录小鼠进入水中到寻找到平台所需要的时间,记为潜伏期;如小鼠60 s内没有找到平台,则将这只小鼠的潜伏期记为60 s。然后将小鼠放到平台上,让其在平台上停留10 s,以让其熟悉适应平台。每只小鼠每日训练4次,每次训练间隔约为0.5 h左右,持续训练4 d。记录小鼠每次潜伏期,计算每只小鼠每日4次潜伏期平均值,作为评价小鼠空间记忆获得能力的指标。

表2 Morris水迷宫空间记忆采集(隐藏平台寻找实验)实验起始象限
以潜伏期作为因变量,时间作为时间因素,组别作为自变量纳入重复测量的方差分析模型,时间与组别间有交互作用(F=1.640,P=0.043)。组间两两比较结果:与正常组同时间比较,模型组4 d潜伏期均延长(P<0.05),表明建立实验模型的方法可行。2:3配比剂量组潜伏期均缩短(P<0.05),4 d的训练中效果最好(P<0.01);2:1配比剂量组训练4 d潜伏期缩短(P<0.05);2:3配比剂量组训练2 d潜伏期缩短(P<0.05),结果见表3。由表3可见,与模型组相比,各给药组潜伏期均呈下降趋势,其中2:3配比剂量组潜伏期趋向于平稳下降。
表3 定位航行实验中各组小鼠行为学比较(±s)
注:*P<0.05 vs 正常组,**P<0.01 vs 正常组;#P<0.05 vs 模型组,##P<0.01 vs 模型组
组别 不同时间定位航行试验潜伏期/s 1 d 2 d 3 d 4 d正常组 32.35±1.79 30.75±1.62# 32.40±1.56## 31.9±1.603#模型组 43.12±2.47* 39.97±2.42** 33.31±1.71* 37.21±2.60*吡拉西坦组 26.98±2.07* 26.76±1.50# 28.08±1.75## 28.00±1.79*#2:1配比 35.22±1.01 33.12±1.30## 31.39±1.35# 32.98±1.22*#2:3配比 24.72±0.93* 23.55±0.86*# 23.21±0.90*# 23.2±1.59**#2:5配比 33.14±1.02* 28.95±1.28*# 28.41±1.16# 27.95±1.16
2.2.4.2 空间探索实验 训练4 d后撤除平台,第5天按半随机方式将小鼠从距离目标象限最远的入水点背向池中心紧挨着池壁轻轻放入水中,每只小鼠每个象限测试1次。观察并记录小鼠60 s内搜索原平台的游泳轨迹,穿过原平台所在位置的次数、原平台象限游程比率及时间比率(即动物在原平台象限的游程及时间占总游程及总时间的比率)作为评价小鼠空间记忆能力的指标。
与模型组数据相比,吡拉西坦组、2:1配比组、2:3配比组和2:5配比组在原平台象限的时间比均显著升高(P<0.05)。与吡拉西坦组相比,2:3配比组穿过原平台所在位置的次数、原平台象限游程比率及时间比率3项指标均显著升高(P<0.05),2:1配比组只有时间比率显著升高(P<0.05),2:5配比组原平台象限游程比率和时间比率显著升高(P<0.05)。结果见表4。
表4 空间探索实验中各组小鼠行为学比较(±s)
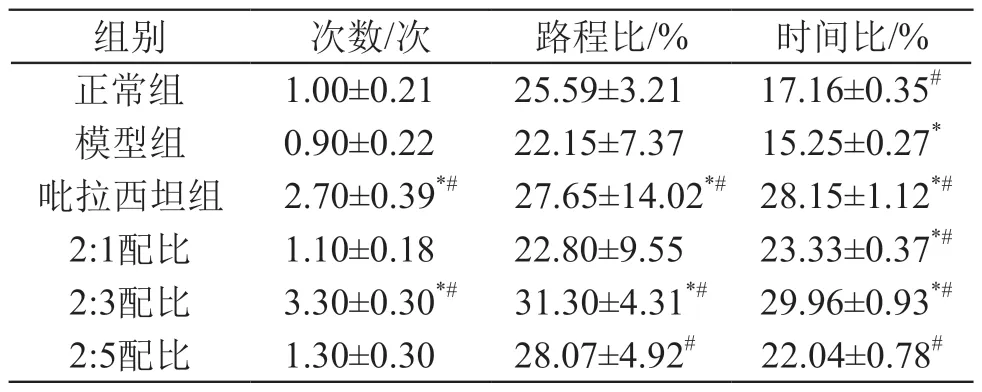
表4 空间探索实验中各组小鼠行为学比较(±s)
注: *P<0.05 vs 正常组;#P<0.05 vs 模型组
组别 次数/次 路程比/% 时间比/%正常组 1.00±0.21 25.59±3.21 17.16±0.35#模型组 0.90±0.22 22.15±7.37 15.25±0.27*吡拉西坦组 2.70±0.39*# 27.65±14.02*# 28.15±1.12*#2:1配比 1.10±0.18 22.80±9.55 23.33±0.37*#2:3配比 3.30±0.30*# 31.30±4.31*# 29.96±0.93*#2:5配比 1.30±0.30 28.07±4.92# 22.04±0.78#
此外,各组小鼠在整个训练过程中的游速没有显著差别,平均为9 cm/s。根据以上结果初步推断,人参与石菖蒲具有改善小鼠痴呆引起的学习记忆障碍作用,数据显示以2:3配比组效果最佳。
2.3 有效组分与药效学指标的相关性分析
通过Spss17.0软件将3种配比的样品中人参皂苷Rg1、Re、Rb1含量分别与各组小鼠原平台象限的游程比进行Spearman等级相关分析,相关系数(r)值分别为0.958,0.932,0.907,表明人参皂苷Rg1、Re、Rb1的含量与各组小鼠的游程比均呈正相关,且3种人参皂苷的含量与各组小鼠游程比的相关性为Rg1>Re>Rb1,因此本课题选择2:3作为人参与石菖蒲的最佳配比。
3 讨论
本课题以治疗健忘症的开心散为基础方,原方散剂治疗老年痴呆临床疗效确切,但存在服用量大、药物稳定性差、对机体刺激性大等缺点,不适用易吸潮及对光热不稳定的药物。为使本方更好地应用于临床,针对老年痴呆病症对其展开了处方优化,结合相关文献资料,最终选择了人参和石菖蒲两味药作为新药的药味组成,二者均有益智开窍之功,人参主补益,石菖蒲主开窍,二者相辅相成,临床疗效确切。
常规多采用单一的多指标成分含量和出膏率对中药复方质量进行评价,但由于人参和石菖蒲两味药材出膏率较低,化学成分复杂,且中药复方作用机制尚不明确,若单纯以人参皂苷的含量来优选最佳配比,不能说明所提取成分的药效最佳。因此本课题采用Morris水迷宫实验,以人参有效组分含量测定与药效相结合的评价方法,避免了单一评价不能有效反映药效结果的弊端,使优选出来的最佳配比更有依据。
由Morris水迷宫实验结果可知,人参与石菖蒲提取液可改善小鼠痴呆引起的学习记忆能力障碍,结果显示3种配比中以人参与石菖蒲2:3的配比效果最佳。另采用高效液相色谱探讨两者不同比例配伍对人参主要药效成分人参皂苷Rg1、人参皂苷Re、人参皂苷Rb1含量的影响,发现人参与石菖蒲2:3配比组提取液与2:5配比组提取液的人参皂苷提取效率没有显著差异,均高于2:1配比组提取液,并与Morris水迷宫实验的结果一致,因此,确定人参与石菖蒲2:3为参菖益智胶囊中人参与石菖蒲的最佳配伍比例。

