CPI-203通过抑制p38 MAPK/AKT通路改善类风湿关节炎
林燕雯,张 玲,尹佳璇,潘继红,
(1. 山东第一医科大学 生物医学科学院暨山东省医药生物技术中心生物化学教研室,山东 济南 250000;2. 山东第一医科大学第一附属医院 类风湿关节炎科,山东 济南 250000;3. 国家卫健委生物医药重点实验室,山东 济南 250000;4. 山东省罕见病防治重点实验室生物化学教研室,山东 济南 250000)
类风湿关节炎(RA)是一种全身性自身免疫性疾病,导致严重的炎症和骨骼组织的形态变化,包括骨骼和关节损伤、软骨退化、滑膜增生、成纤维样滑膜细胞向软骨和骨表面浸润、软骨下骨侵蚀等,这些都是RA的病理标志[1]。全世界每200名成年人中大约1人受累,女性的发病率是男性的2~3 倍。主要发病年龄在50~59岁[1]。RA滑膜成纤维细胞(RASF)已成为RA发病机制中的关键参与者,具有转化细胞的表型和分子特征。RASF能分泌细胞因子、趋化因子和关节损伤酶,从而促成RA的炎症状态和关节损伤。RASF具有的凋亡抗性及对巨噬细胞和淋巴细胞等炎症细胞的招募是RA关节滑膜组织过度增生的主要原因。此外,RASF具有侵袭性和迁移性,可导致疾病传播到未受影响的关节。
尽管进行了广泛的研究工作,但RA的病因尚未确定,发病机制复杂。目前的治疗方法在控制症状方面大多有效,但部分患者仍对多种治疗方法,包括抗肿瘤坏死因子α(TNF-α)治疗无效。因此,对现有治疗方案的医疗需求尚未得到满足,仍缺乏理想的治疗药物和治疗策略。最近研究表明小分子药物寻找新药靶可能为RA治疗提供新方法[2-4]。
CPI-203是一种强效的BET bromodomain抑制剂,也是一种新型的细胞渗透性小分子药物,在口服给药时显示出良好的生物利用度。已有研究报道表观遗传调节蛋白的小分子抑制剂可阻断与类风湿关节炎相关的致病机制,具有分子量小且毒性低等优点[5-6]。近期小分子药物通过保护药物靶点从而发挥治疗或缓解疾病研究仍被持续关注[2-4],然而CPI-203在 RASF中存在的其他潜在药物靶点仍未可知,有被进一步开发为新的、安全的药物,以在功能上治愈RA的潜力。
1 仪器与材料
1.1 仪器
Eclipse E100 显微镜(日本尼康);SpectraMax iD3酶标仪(Molecular Devices);20R低温高速离心机(德国Backman);Quantum GX Micro-CT(日本Perkin Elmer);iCAN细胞培养箱(美国Thermo Scientific);1384超净工作台(Thermo);Light Cycler 480荧光定量检测仪(瑞士Roche);SDS-PAGE电泳仪(美国Bio-Rad公司);HH-1水浴锅(常州国华);ECL Plus检测系统(美国Thermo Scientific)。
1.2 试剂
DMEM 培养基(美国Gibico);胎牛血清(美国Gibico);青霉素链霉素双抗(美国Gibico);PBS(美国Gibico);EDTA-胰酶(美国Gibico);Ⅱ型胶原酶(索莱宝);Ⅲ型胶原酶(索莱宝);二甲基亚砜(索莱宝);IL-1β(Abbkine);TRIzol(诺唯赞);RNA反转录试剂盒(诺唯赞);SYBR Mixture(康维公司);4 %组织细胞固定液(索莱宝);结晶紫/龙胆紫混合染色液(索莱宝);小室(BD);基质胶(Corning);ELISA试剂盒(联科生物);引物(华大基因);CPI-203(Selleck生物公司);Bradford蛋白浓度测量试剂盒(碧云天)。
1.3 动物
雄性DBA 1/J小鼠购自北京华阜康生物科技有限公司,8周龄,20~25 g。小鼠饲养于山东第一医科大学生物医学科学学院SPF级动物房,符合山东第一医科大学动物饲养及管理条例。所有动物实验和流程严格按照山东第一医科大学实验动物条例进行。
1.4 细胞
从RA患者中收集滑膜组织在膝关节置换手术期间(n=14,男性5例,女性9例,年龄35~75岁,平均年龄53岁)。患者均符合 1987 年美国风湿病学会修订的类风湿关节炎诊断标准。获得每位患者的书面知情同意书及委员会批准(批准号:2019-02)。将滑膜组织浸泡在生理盐水中,使用II型和III型胶原酶消化6~8 h,于37 ℃,含5 % CO2细胞培养箱培养48 h等待成纤维样细胞贴壁。提取的细胞在含10 % 胎牛血清和1 %双抗的DMEM完全培养基中进行培养并传代,传代至5~7代使用。
1.5 软件
GraphPad Prism 9软件包。
2 方法
2.1 RASF细胞增殖-毒性检测
取4×104个细胞/ml的RASF 9.6 ml接种于96孔板,于细胞孵箱培养12 h,待贴壁后设置分组为空白组、细胞未处理组、DMSO组、CPI-20(0.5,1,2,5 μmol/L)组,每组设4个重复孔,给药后继续培养48 h。向每孔加入 10 μl CCK-8溶液,孵育 1 h后用酶标仪测定450 nm处吸光度。计算细胞增殖率和半数抑制浓度。增殖率(%)=(加药孔OD值-空白孔OD值)/(未加药孔OD值-空白孔OD值)×100。
2.2 RASF侵袭、迁移、血管形成数测算
2.2.1 实验分组及处理 取5.6×105个细胞/ml的RASF 4 ml,接种于12孔板,设置分组为正常对照组、IL-1β(10 ng/ml)诱导组、CPI-203(1 μmol/L)用药组(有或无IL-1β 诱导),用药组以1 μmol/L CPI-203处理24 h,IL-1β 刺激 12 h,每组设3个重复孔。
2.2.2 RASF侵袭数测算 在Transwell上室每个室中加入100 μl稀释后的基质胶,于细胞孵箱中静置1 h。RASF按2.2.1项下方法处理后,按4×104个细胞/ml接种于Transwell上室(其中加入含2 % 胎牛血清的DMEM完全培养基),待细胞贴壁后,在下室添加含15 % 胎牛血清的完全培养基。继续培养过夜后,将侵袭到下表面的细胞进行染色并计数,每个分组包括3个重复视图,并计算侵袭细胞的平均数量。
2.2.3 RASF迁移数测算 按2.2.1项下方法进行实验分组和细胞处理,用无血清无抗生素的培养基换液并进行划痕,拍摄0 h和12 h细胞迁移图片并使用 Image-J计算培养0 h和12 h细胞划痕面积。创伤愈合率(%)=(12 h细胞划痕面积-0 h细胞划痕面积)/0 h细胞划痕面积×100。
2.2.4 体外血管形成能力评估 按2.2.1项下方法进行实验分组和细胞处理,用无血无抗培养基按1:3比例稀释基质胶,于48孔板铺稀释好基质胶50 μl,置于37 ℃孵箱静止1 h后,分别取各处理组细胞上清,按每孔105个细胞重悬后,加入铺好基质胶的培养板,于孵箱继续培养4 h后镜下观察拍摄成管情况,使用Image-J计算管形成数。
2.3 RASF中IL-6、IL-8、MMP-1/3、TIMP-3、VEGF mRNA的检测
采用qRT-PCR方法。取5.6×105个/ml的RASF 4 ml,接种于12孔板,设置分组为正常对照组、IL-1β(10 ng/ml)诱导组、CPI-203(1 μmol/L)用药组(有或无IL-1β诱导),用药组以1 μmol/L CPI-203处理24 h,IL-1β刺激12 h,每组设3个重复孔。按试剂盒使用说明书,使用TRIzol试剂从培养的细胞中提取总RNA,再经逆转录成cDNA。使用Light Cycler 480进行qRT-PCR。实验重复3 次,采用2-ΔΔCt方法计算目的基因相对表达水平。引物序列见表1。

表1 引物序列
2.4 RASF上清中IL-6、IL-8、MMP-1、MMP-3、TIMP-3水平的检测
采用ELISA法。取5.6×105个/ml的RASF 4 ml接种于12孔板,设置分组为正常对照组、IL-1β(10 ng/ml)诱导组、CPI-203(1 μmol/L)用药组(有或无IL-1β诱导),用药组以1 μmol/L CPI-203处理24 h,IL-1β刺激12 h,每组设3个重复孔。培养36 h后,收集上清,用ELISA试剂盒检测IL-6、IL-8、MMP-1、MMP-3、TIMP-3分泌水平。
2.5 RASF中p-p38、p-AKT表达水平的检测
采用Western blot法。取8.8×105个细胞/ml的RASF4 ml接种于6孔板,设置分组为正常对照组、IL-1β(10 ng/ml)诱导组、CPI-203(1 μmol/L)用药组(有或无IL-1β诱导),用药组以1 μmol/L CPI-203处理24 h,IL-1β刺激12 h,每组设3个重复孔。培养48 h后,收集细胞提取蛋白,用Bradford蛋白浓度测量试剂盒检测蛋白浓度。经100 ℃,7 min变性后进行聚丙烯酰胺凝胶(SDS-PAGE)电泳,并将蛋白转至硝酸纤维素膜,用5 %脱脂奶粉封闭1 h ,再用p-p38、p-AKT、p-38、AKT和β-tubulin 抗体过夜孵育,Tris-HCl 缓冲盐溶液+Tween 20 (TBST)洗3遍后与二抗共孵育1.5 h。再用TBST洗3遍后使用ECL Plus检测系统进行检测。
2.6 CIA小鼠模型构建
2.6.1 模型构建 DBA 1/J雄性小鼠尾根部注射2 mg/ml牛II型胶原和完全弗氏佐剂1:1乳化剂200 μl,后正常饲养,21 d后小鼠尾根部二次免疫注射牛II型胶原和不完全弗氏佐剂1:1乳化剂200 μl。每天对小鼠进行一次关节炎症状监测,待鼠爪肿胀完全,提示CIA模型建立成功。
2.6.2 分组及给药 将18只DBA 1/J雄性小鼠随机均分为正常对照组、诱导组、CPI-203用药组。CPI-203用药组构建CIA模型后,第一次注射胶原和弗氏完全佐剂混合乳化剂后第 50 天即小鼠关节炎发病高峰时,腹腔注射CPI-203 30 d(200 mg/kg),每两天注射1次,观察并记录小鼠鼠爪炎症缓解情况。正常对照组不构建CIA模型。诱导组构建CIA模型后,腹腔注射等量DMSO。
2.7 小鼠血清中炎性因子水平测定
CPI-203治疗30 d后,取小鼠血清,离心去除微粒后,按ELISA试剂盒操作步骤检测血清中IL-6、IL-8水平。
2.8 Micro-CT 成像和苏木精-伊红(HE)染色
对鼠爪进行Micro-CT扫描,并对扫描结果进行二次重建分析小鼠骨关节的微观结构。后将鼠爪在10 %组织固定液中固定24 h,并在15 %乙二胺四乙酸(EDTA)中脱钙。然后将鼠爪包埋于石蜡中,并从鼠爪矢状面以5 μm厚度连续切片,切片用HE染色。
2.9 统计学方法
使用GraphPad Prism 9软件包对数据进行统计。数据符合正态分布,检验采用Shapiro-Wilk方法,符合正态分布的计量资料以±s表示,两组均值比较采用t检验,多组间均值比较采用单因素方差分析(one-way ANOVA)。检验水准=0.05(双侧),P<0.05为差异有统计学意义。
3 结果
3.1 CPI-203抑制RASF增殖
用药组细胞增殖率随药物浓度增加而减少,表明CPI-203对细胞增殖有较好的抑制作用,且作用呈浓度依赖性。CPI-203的IC50值为1.18±0.19 μmol/L,确定后续给药浓度为 1 μmol/L。
3.2 CPI-203降低IL-1β诱导的RASF侵袭、迁移、血管形成数
正常对照组、I L-1 β 诱导组、C P I-2 0 3(1 μmol/L)用药组、CPI-203+IL-1β组细胞侵袭数目分别为(84.60±2.966),(63.80±1.643),(134.6±3.362),(75.60±4.393)个。与正常对照组相比,IL-1β诱导组侵袭细胞数目增多(P<0.001);且CPI-203可降低IL-1β诱导的RASF侵袭数目增多(P<0.001),见图1A。各组迁移细胞创伤愈合结果见图1B。与IL-1β诱导组比较,CPI-203+IL-1β组细胞的迁移能力下降(P<0.001)。正常对照组血管形成数为(82.67±8.021),IL-1β诱导组血管形成数为(171.3±3.05),CPI-203(1 μmol/L)用药组血管形成数为(53.67±12.86),CPI-203+IL-1β组血管形成数为(133.7±10.07)。与IL-1β诱导组相比,CPI-203+IL-1β组血管形成数减少(P<0.005),见图1C。

图1 CPI-203对RASF侵袭(A)、迁移(B)、血管形成数(C)的影响(n=3)
3.3 CPI-203作用后逆转IL-1β诱导的IL-6、IL-8、MMP-1/3、CCL-2、VEGF的mRNA表达及TIMP-1/3的抑制
与正常对照组相比,CPI-203对RASF中炎症介质因子IL-6、IL-8、MMP-1/3、VEGF的表达具有显著抑制作用(P均<0.03),同时诱导了TIMP-1/3的表达(P<0.0007)。不同处理组 IL-6、IL-8、MMP-1/3、TIMP-1/3、CCL-2、VEGF表达水平见图2。
3.4 CPI-203作用后RASF上清中IL-6、IL-8、MMP-1/3、TIMP-3的分泌水平变化
结果见图3。由图3可见,CPI-203降低IL-1β诱导的IL-6、IL-8、MMP-1/3表达(P均<0.001),同时逆转IL-1β诱导的TIMP-3的抑制(P<0.001)。
3.5 CPI-203对CIA模型小鼠关节炎发生发展的影响
结果见图4。由图4可见,与DMSO处理的小鼠相比,CPI-203处理的小鼠表现出明显改善,关节炎评分明显降低。鼠爪厚度和肿胀程度、受累关节的组织学及影像学分析显示滑膜增生、软骨降解和骨破坏减少。与阳性对照组相比,实验组小鼠血清IL-6、IL-8蛋白水平降低(P<0.001),差异有高度统计学意义。以上结果表明,CPI-203可改善CIA小鼠关节炎的发生发展。
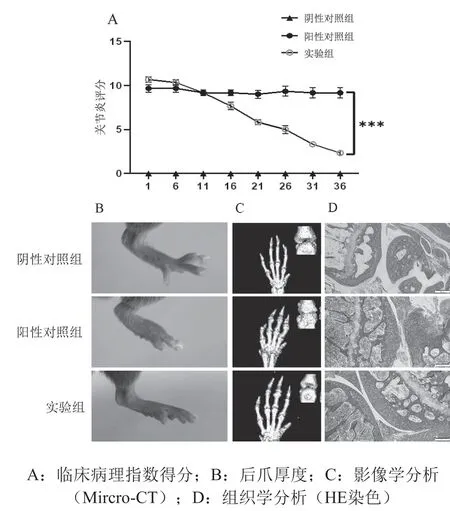
图4 CPI-203对CIA小鼠关节炎的影响(n=6)
3.6 CPI-203对IL-1β诱导的MAPK、AKT通路的影响
p38 MAPK及AKT通路激活后转录因子p-p38和p-akt在炎症方面发挥重要作用。Western blot结果显示CPI-203显著抑制IL-1β诱导的p-p38和p-akt磷酸化水平,表明CPI-203对炎症具有抑制作用,这与细胞及小鼠血清中炎症因子水平变化的结果一致。
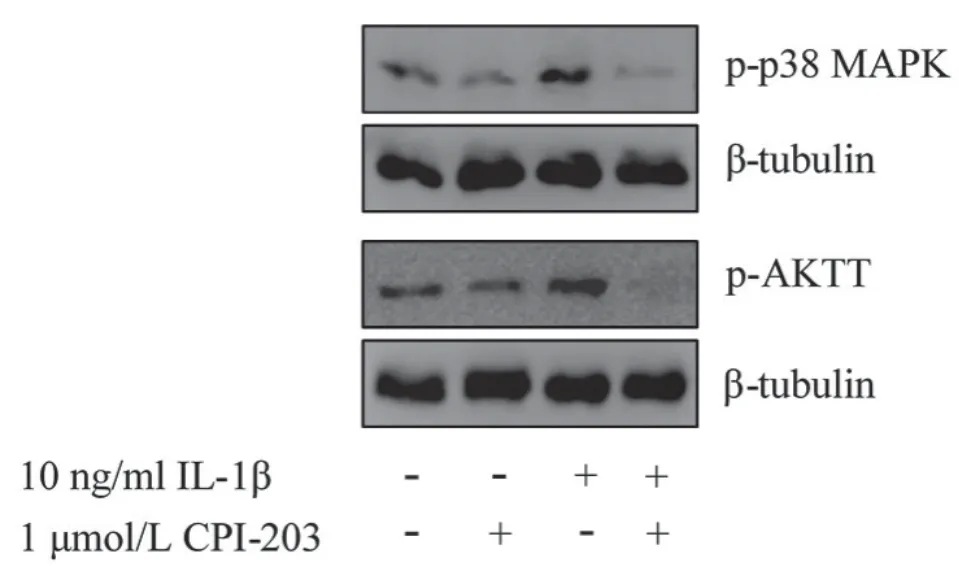
图5 CPI-203 对 MAPK、AKT 通路的影响(n=3)
4 讨论与结论
本研究发现CPI-203可抑制RASF的炎症、基质降解、增殖和趋化因子表达,表明在RA中CPI-203的治疗潜力。体外研究结果表明,CPI-203可在体外抑制RA的促炎因子表达、侵袭、迁移和血管生成行为。体内研究表明,经CPI-203治疗的小鼠的关节肿胀、炎症和滑膜增生、骨侵蚀及骨降解明显少于未治疗的阳性对照组动物。
本项研究仍有一些局限性。文中仅分析了CPI-203治疗过程中MAPK和AKT信号通路的变化。推测可能有其他重要通路可调节这一过程。因此,计划在未来使用高通量测序等方法研究其他潜在的关键通路和药物靶点,以冀为小分子抑制剂的发展和应用做出贡献。

