基于干旱胁迫转录组信息的蚕豆ASPAT基因家族分析
魏正欣刘昌燕陈宏伟李 莉孙龙清韩雪松焦春海,*沙爱华
1长江大学农学院 / 湿地生态与农业利用教育部工程研究中心, 湖北荆州 434025;2湖北省农业科学院粮食作物研究所 / 粮食作物种质创新与遗传改良湖北省重点实验室, 湖北武汉 430064
蚕豆(Vicia fabaL.), 属于豆科、野豌豆属, 又称胡豆、罗汉豆、佛豆等, 是世界上第三大重要的冬季食用豆作物[1-2]。我国是世界第一蚕豆生产大国,其分布区域广, 种质资源极其丰富, 种植面积约占世界总种植面积近50%[3]。它具有高蛋白、低脂肪、富含淀粉的营养特征, 是蛋白质、能量和纤维的良好来源, 被广泛种植作为食物和饲料, 具有重要的营养价值和商业价值[4]。随着环境条件不断变化, 干旱已成为限制全球粮食生产的重要环境因素之一,干旱严重地限制了我国经济发展[5]。蚕豆各个生长阶段都可能受到干旱胁迫的影响, 致使蚕豆产量降低[6-7]。尽管现今有一些关于蚕豆耐旱性研究, 如肖贵等[8]、李萍等[9]分别从栽培、蛋白组学方面研究蚕豆的耐旱机制, 但仍缺乏有效的手段提高蚕豆耐旱性。蚕豆由于其基因组巨大(~13 Gb), 且85%基因组富含重复序列, 导致很难通过基因组测序和图位克隆的方法克隆相关耐旱基因, 应用于分子标记辅助育种和基因工程育种。二代(NGS)和三代测序技术(single-molecule, real-time sequencing technology, SMRT)的发展, 使得通过二代结合三代测序技术的转录组测序获得全基因组转录产物参考基因组成为可能, 能够很好的解决一些基因组较大且缺乏参考基因组的问题, 便于在这些物种中开展分子标记和相关基因功能研究。在前期研究中, 我们利用蚕豆耐旱品种CDAS105和蚕豆干旱敏感品种鄂蚕豆1号, 应用二代结合三代技术获得了一个包含17,927个单一非冗余基因的转录参考基因组, 通过比较2个品种干旱胁迫和正常生长条件下的基因转录水平, 鉴定出大量的差异表达基因, 天冬氨酸转氨酶(aspartate amino transferase, ASPAT)便是其中的一类基因(DDBJ/ENA/GenBank, 登录号为GISP00000000)。
ASPAT又名谷氨酸-草酰乙酸转氨酶, 属于转氨酶I类[10], 催化天冬氨酸(aspartate, ASP)的氨基转移到α-酮戊二酸生成草酰乙酸和谷氨酸及其逆反应的进行, 是合成天冬氨酸家族氨基酸的关键酶, 与糖酵解、氧化磷酸化等代谢途径密切相关, 是植物体代谢网络中关键一环[11-12]。在植物中, ASPAT以多种形式存在, 一种是真核型天冬氨酸氨基转移酶(AAT), 另一种是原核型天冬氨酸氨基转移酶(PAT)。PAT不仅有ASPAT活性, 还有预苯酸转氨酶活性, 主要定位于细胞质、线粒体和质体中[13]。ASPAT在植物代谢中起重要作用, 一方面是氨基酸代谢的核心酶, 在蛋白质合成中生成ASP, 另一方面通过苹果酸-天冬氨酸穿梭参与亚细胞结构之间还原当量的转移[14]。
ASPAT不仅参与植物代谢, 还参与植物非生物胁迫响应通路。在拟南芥中共鉴定出5个ASPAT基因家族成员, 由5种真核型AAT和1种原核型PAT组成[15], 细胞质中的AtASPAT2在光照下参与合成天冬氨酸(aspartate, Asp),AtASPAT2突变导致植株生长迟缓[16];AtASPAT1和AtASPAT3在大多组织中具有较高表达[17], 且AtASPAT3在干旱、寒冷和高盐胁迫下转录水平增高[18]。在杨树中, 鉴定出10个ASPAT成员, 该基因家族包含多个与激素、干旱、氧化等相关的顺势作用元件[19]。在水稻中, 灌浆期高温下水稻(粳稻越光、籼稻IR72)籽粒中的AAT的活性较正常情况显著提高[20], 且AAT的过量表达显著提高了水稻中ASP的含量[21]。有研究认为ASP是一种干旱胁迫特异性反应代谢物, 干旱处理下, 鹰嘴豆耐旱品种叶片中ASP含量高于敏感品种[22-23]。在小麦科7种作物及不同器官中, 干旱胁迫下ASP含量显著增加[24]。Ali等[25]也报道了天冬氨酸在非生物胁迫响应中的重要作用, 在胁迫中含量增加。ASPAT是合成天冬氨酸的关键酶, 推测其可能参与干旱和其他非生物胁迫响应。迄今, 在蚕豆中并未见ASPAT基因的相关报道。
本文基于已建立的蚕豆转录参考基因组和基因差异表达数据, 从全基因组水平鉴定了蚕豆ASPAT基因家族成员, 开展了相关生物信息学分析, 明确了这些基因家族成员的理化特性和对干旱胁迫的响应, 为进一步研究蚕豆ASPAT的抗旱功能, 应用ASPAT提高蚕豆抗旱性奠定了基础。
1 材料与方法
1.1 试验材料
供试蚕豆(Vicia fabaL.)种子干旱敏感品种鄂蚕豆1号是湖北省农业科学院选育品种, 耐旱品种CDAS105为埃塞俄比亚引进品种。于2019年7月选取形态饱满、大小一致的干旱敏感品种鄂蚕豆1号和耐旱品种CDAS105两品种蚕豆种子进行发芽试验, 并统计萌发率。用7.5%的甘露醇(天津市科密欧化学试剂科技有限公司)处理, 每个处理3个重复,分别取16 h和64 h带有萌发蚕豆胚胎1/4部分的样品, 置于液氮冷冻, 于-80℃冰箱保存。
1.2 蚕豆ASPAT基因家族成员筛选鉴定
以蚕豆干旱胁迫转录组测序数据(DDBJ/ENA/GenBank, 登录号为GISP01000000)为基础, 根据NR、Swiss-prot和COG数据库中注释为ASPAT基因,并用TBtools[26]提取相应的蛋白序列后, 在NCBI中进行BLAST比对, 利用CDD对序列保守结构域进行预测, 去除非ASPAT基因编码序列、重复序列及冗余转录本。
1.3 蚕豆ASPAT蛋白理化性质及结构分析
将所得的8个ASPAT蛋白序列提交在线工具ExPASy-ProtParam tool (https://web.expasy.org/protparam/), 分析蚕豆ASPAT蛋白的分子量、等电点、蛋白疏水性和不稳定系数等理化性质, 使用在线工具SOPMA预测蚕豆ASPAT蛋白质二级结构。
1.4 系统发育分析
通过拟南芥全基因组数据库(TAIR)下载获得6个拟南芥ASPAT蛋白序列, 通过Ensembl Plants下载大豆、水稻、玉米、小麦、杨树的蛋白序列。使用软件MEGA-X中的ClustalW程序对蚕豆、拟南芥、大豆等ASPAT蛋白进行同源序列比对, 并采用邻接法(Neighbor-Joining, NJ)构建蚕豆ASPAT蛋白家族系统发育树, 校验参数Bootstrap重复值为1000,其他参数为默认值。
1.5 VfASPAT基因家族亚细胞定位预测、基因结构、蛋白结构域及Motif分析
利用在线网站Plant-mPLoc (http://www.csbio.sjtu.edu.cn/bioinf/plant-multi/)对8个候选家族成员的蛋白序列进行亚细胞定位预测分析; 根据基因组注释信息, 利用TBtools软件对ASPAT基因结构进行可视化分析; 利用 Pfam (https://pfam.xfam.org/)和TBtools对蛋白结构域进行分析; 利用MEME(https://meme-suite.org/)在线网站分析蚕豆ASPAT家族蛋白的Motif类型和排列顺序, 预测数目设置为10, 长度为6~50, 其他参数不变, 获得该基因家族Motif特点。
1.6 蚕豆ASPAT蛋白质互作网络预测分析
利用STRING数据库(STRING: functional protein association networks (string-db.org))构建蚕豆ASPAT蛋白互作网络, 在数据库中上传VfASPAT的蛋白序列, 以大豆蛋白为参考进行比对, 根据已知的蛋白质互作关系, 对VfASPAT基因家族的蛋白互作信息进行评估和预测, 并使用软件Cytoscape[27](版本3.7.2)进行美化修饰。
1.7 VfASPAT基因表达模式分析与验证
采用FPKM (fragments per kilobase million)法[28]计算蚕豆干旱胁迫转录组测序文库中各基因的表达量, 数据标准化后, 使用TBtools软件绘制在不同处理时间和不同品种间的ASPAT基因表达量热图。使用华越洋试剂盒提取蚕豆芽期胚的总RNA, 用1%琼脂糖凝胶电泳检测, 并用微量分光光度计检测RNA纯度(OD260/280)和浓度。采用Primer Premier 5.0软件设计荧光定量引物(表1), 以蚕豆VfNADHD4为内参基因[29]。使用SYBR Green荧光定量预混试剂盒(天根生化科技(北京)有限公司)进行实时荧光定量PCR检测蚕豆ASPAT基因家族成员在处理16 h和64 h的2个蚕豆品种中的表达情况。反应体系10 μL, 包含模板cDNA 1 μL、正/反引物各0.2 μL、2×Real Universal PreMix (SYBR Green) 5 μL和ddH2O 3.6 μL。扩增程序为95℃预变性15 min; 95℃变性10 s, 57℃退火20 s, 72℃延伸30 s, 共40个循环; 95℃ 10 min,59℃ 0.05 s, 95℃ 0.5 s。每个样品设3次技术重复, 采用2-ΔΔCt[30]方法计算VfASPAT基因的表达量。

表1 实时荧光定量PCR所用的引物Table 1 Primers used for qRT-PCR
2 结果与分析
2.1 干旱胁迫下蚕豆发芽率统计分析
为统计蚕豆耐旱品种和敏感品种干旱胁迫下萌发的情况, 本研究对干旱敏感品种鄂蚕豆1号和耐旱品种CDAS105种子萌发过程进行记录并统计自干旱胁迫处理开始至96 h的发芽率。在对照条件下,鄂蚕豆1号和CDAS105在48 h有47.6%和61.9%的种子开始发芽(表2)。然而, 在干旱胁迫下CDAS105在64 h和72 h发芽率分别为4.8%和9.5%, 而鄂蚕豆1号在64 h和72 h时未发芽。

表2 干旱胁迫处理两蚕豆品种发芽率比较Table 2 Comparison of germination rate between two faba bean varieties under drought stress (%)
2.2 蚕豆ASPAT蛋白理化性质、结构及亚细胞定位预测
从蚕豆中共鉴定到8个ASPAT基因家族成员,编码的蛋白氨基酸数目为394 (VfASPAT5)~481(VfASPAT4)个(表3), 相对分子质量43,469.05(VfASPAT5)~52,060.7 (VfASPAT4), 蛋白质理论等电点(pI)介于5.59~8.42之间, 脂融指数79.48~96.91。除VfASPAT2和VfASPAT7的不稳定指数大于 40, 为不稳定蛋白, 其他均为稳定蛋白。VfASPAT4和VfASPAT6疏水性分值(GARVY)大于0, 推测为疏水性蛋白, 其他为亲水性蛋白。通过SOPMA预测蚕豆ASPAT蛋白质二级结构可知(表4),8个蚕豆ASPAT蛋白的二级结构主要包括α-螺旋、延伸链、无规则卷曲和β-转角, 其中VfASPAT1~VfASPAT7均以α-螺旋占比最大39.09%~45.28%, 无规则卷曲次之为31.47%~35.34%。VfASPAT8 α-螺旋占35.29%, 无规则卷曲占36.38%。对8个ASPAT家族成员蛋白进行亚细胞定位(表3)发现, VfASPAT1定位在线粒体, VfASPAT3在叶绿体和线粒体中均有分布, 其他蛋白仅存在于叶绿体中。推测蚕豆ASPAT蛋白主要在叶绿体和线粒体中参与反应。
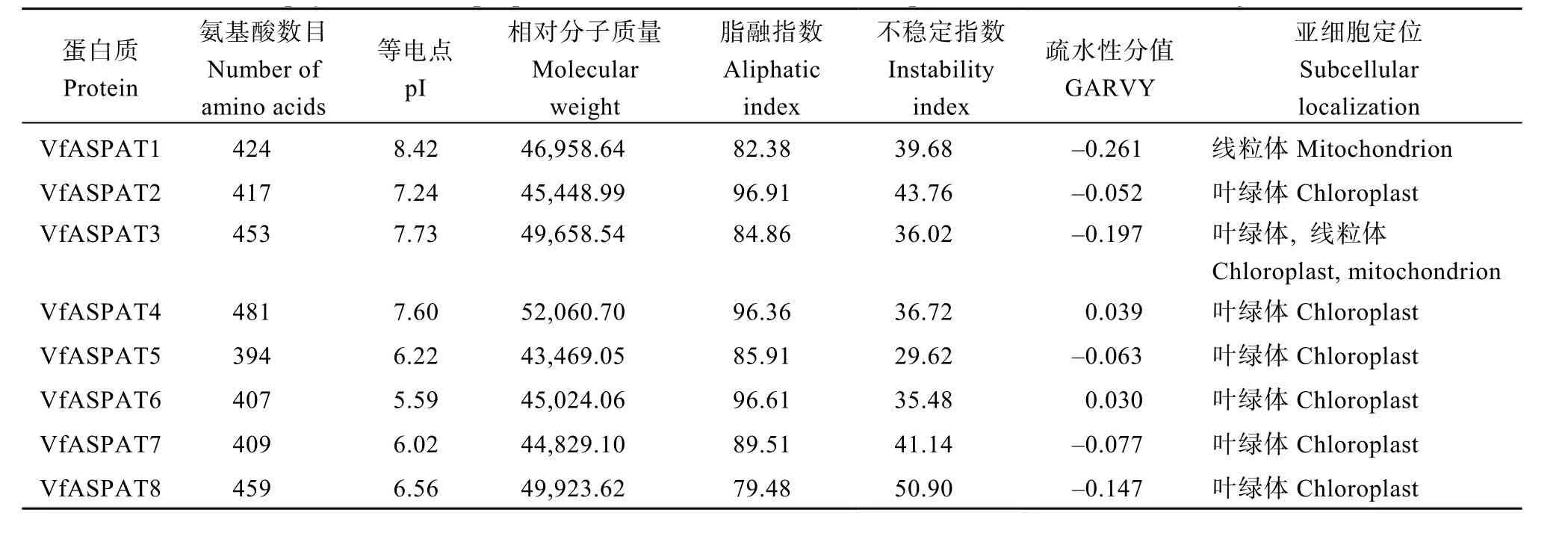
表3 蚕豆ASPAT蛋白理化性质及亚细胞定位预测Table 3 Prediction of physicochemical properties and subcellular localization prediction of ASPAT inVicia fabaL.
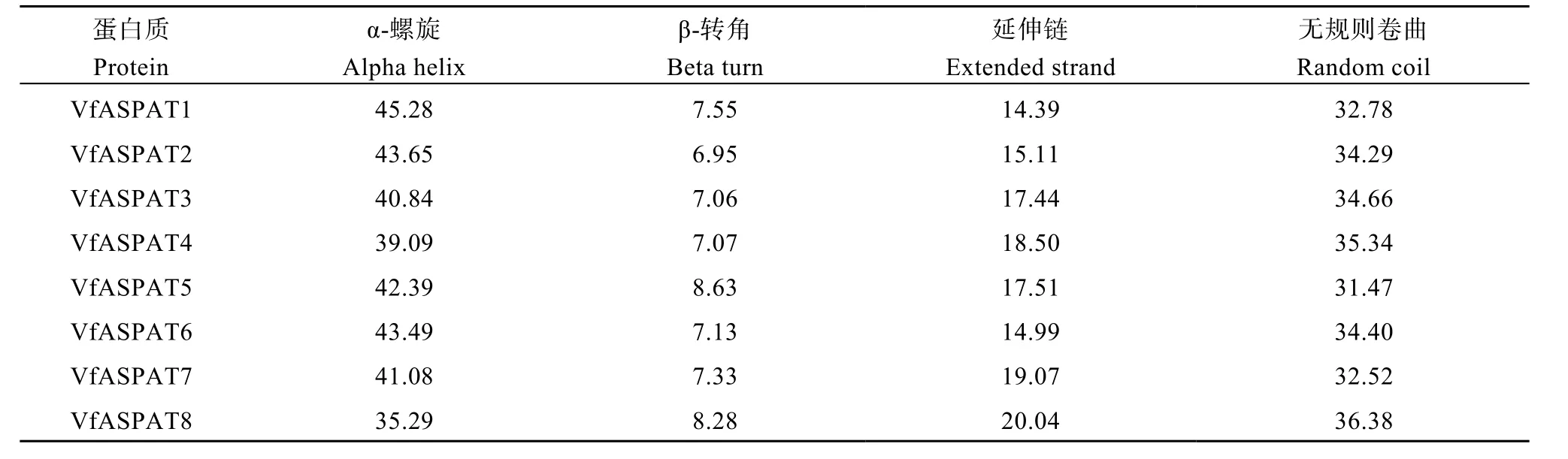
表4 蚕豆ASPAT蛋白二级结构预测分析Table 4 Prediction of secondary structure of ASPAT protein inVicia fabaL. (%)
2.3 系统进化分析
采用MEGAX的邻接法将蚕豆中鉴定的8个ASPAT家族成员与拟南芥、大豆、水稻、玉米、小麦、杨树中的ASPAT蛋白保守域序列构建系统发育进化树并进行聚类分析(图1)发现, VfASPAT分别与其他物种聚中对应的亚家族蛋白聚在同一分支上,参照拟南芥ASPAT基因家族的分类, 拟南芥和蚕豆等6个物种的ASPAT蛋白可分为Iα和Iβ 2个亚族,Iα为真核型ASPAT, 进而可分为3类Iα-A、Iα-B和Iα-C。蚕豆中VfASPAT1~VfASPAT3这3个家族成员属于Iα。Iα-A中包括VfASPAT1, Iα-B中包括VfASPAT2, VfASPAT3属于Iα-C。其中, VfASPAT3与AtASPAT5序列相似度高达92%, 由此推测这2个基因亲缘关系更近, 在生物过程中可能行使相同的功能。VfASPAT1与大豆 Glyma06g275700,VfASPAT2与大豆Glyma06g082400, VfASPAT3与大豆Glyma14g111800、Glyma17g216000在一个进化分支上, 且同源性高达99%, 与小麦、玉米和水稻的相似性相对较低。VfASPAT4~VfASPAT8这4个家族成员属于Iβ亚族为原核型ASPAT, 具有天冬氨酸转氨酶和预苯酸转氨酶2种活性。
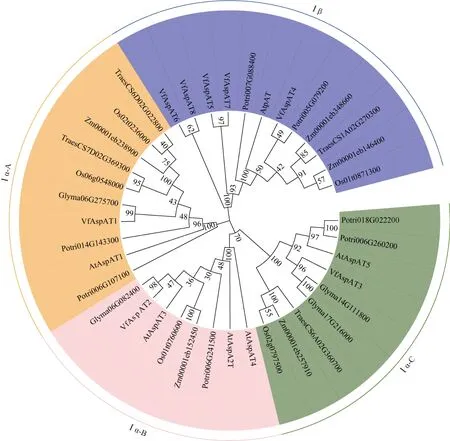
图1 蚕豆ASPAT蛋白家族的进化分析Fig. 1 Phylogenetic analysis of ASPAT protein inVicia fabaL.
2.4 VfASPAT基因结构和蛋白结构域分析
根据基因组注释信息, 利用TBtools软件对ASPAT基因的基因结构进行可视化分析(图2-A), 除VfASPAT7无5′端UTR区, 其他ASPAT家族成员均含有UTR区和完整的CDS区。利用Pfam在线工具和TBtools软件对ASPAT蛋白结构域进行分析(图2-B)发现, 该基因家族蛋白都拥有保守的蛋白结构域Aminotran-1-2。
2.5 蚕豆VfASPAT蛋白保守基序和多序列比对
通过TBtools软件对蚕豆ASPAT蛋白保守结构域进行分析(图2-C)得到10个保守的motif, 命名为motif 1~motif 10, 但ASPAT家族成员之间所含的motif的种类、数目及排序有所不同, VfASPAT1~VfASPAT8均含有motif 1、motif 3、motif 9三个保守基序, 说明这3种motif为该家族中非常重要的保守基序, VfASPAT1~VfASPAT3包含motif种类最多, 均含有8个motif且所含motif种类及排序一致, VfASPAT4、VfASPAT5和VfASPAT7均含有5个motif, 分别为motif 1、motif 3、motif 8、motif 9和motif 10, VfASPAT6含有4个motif, VfASPAT8含有motif数量最少只有3个。通过蚕豆与拟南芥多序列比对结果分析(图3)发现, 与拟南芥蛋白序列相似, 蚕豆也具有磷酸吡哆醛结合位点, 但AAT和PAT 2种蛋白的结合位点和数量有一定的差异, 蚕豆AAT蛋白有6个磷酸吡哆醛结合位点, PAT蛋白仅具有1个磷酸吡哆醛结合位点。

图2 VfASPAT基因结构、蛋白结构域和保守基序分析Fig. 2VfASPATgene structure, protein domain, and conserved motifA: 基因结构; B: 蛋白结构域; C: motif; D: motif氨基酸序列。A: gene structure; B: protein domain; C: motif; D: amino acid sequence of motif.

图3 蚕豆和拟南芥ASPAT蛋白磷酸吡哆醛结合位点Fig. 3 Pyridoxal phosphate binding site of ASPAT protein in faba bean andArabidopsis thaliana红色矩形框分别为AAT和PAT蛋白磷酸吡哆醛结合位点。The red rectangle box indicates the pyridoxal phosphate binding sites of AAT and PAT.
2.6 蚕豆ASPAT蛋白互作PPI网络分析
利用分子互作网络在线工具STRING数据库预测VfASPAT基因家族蛋白质互作关系发现, 整个蛋白互作网络共有12个节点, 12个节点间共存在45组蛋白互作关系。由图4可知, 蛋白互作网络中每一个蛋白节点与其他蛋白节点都有一定的互作关系,其中蛋白VfASPAT1、VfASPAT2和VfASPAT3与其他4个家族成员蛋白均有相互作用关系, 另外该家族成员均与 HPPD (4-hy-droxyphenylpyruvate dioxygenase, 4-羟基苯基丙酮酸双加氧酶)有相互作用。MDH (malate dehydrogenase, 苹果酸脱氢酶)与VfASPAT1、VfASPAT2、VfASPAT3、VfASPAT4、VfASPAT5、VfASPAT7、VfASPAT8相互作用。DAPE(Diaminopimelate epimerase, 二氨基庚二酸异构酶)和HTPA-reductase (4-hydroxy-tetrahydrodipicolinate reductase, 4-羟基四氢二吡啶甲酸还原酶)只与PAT蛋白互作。
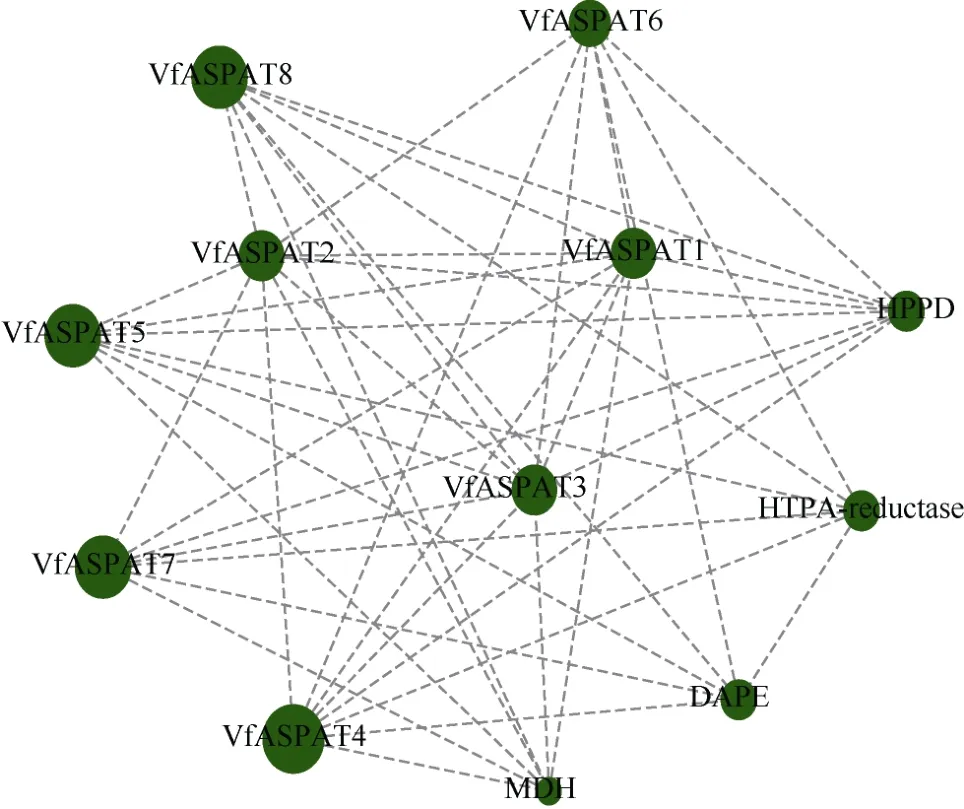
图4 蚕豆ASPAT蛋白质互作网络Fig. 4 Protein-protein network of ASPAT inVicia fabaL.
2.7 VfASPATs响应干旱胁迫表达分析
通过分析蚕豆ASPAT基因家族成员转录组表达热图发现, VfASPAT基因家族成员在耐旱品种CDAS105和敏感品种鄂蚕豆1号不同胁迫状况下表达模式不同(图 5)。在干旱处理 16 h时, 除VfASPAT3、VfASPAT4和VfASPAT6在两品种中表达无差异外, 其他基因在CDAS105中的表达量均高于鄂蚕豆1号。在干旱处理64 h时,VfASPAT2、VfASPAT3、VfASPAT7和VfASPAT8在CDAS105中表达量高于鄂蚕豆1号, 而VfASPAT1、VfASPAT5和VfASPAT6在2个品种中的表达情况则相反, 其中VfASPAT2和VfASPAT3表达水平最高。值得注意的是,VfASPAT2在CDAS105中干旱胁迫16 h和64 h表达均显著高于鄂蚕豆1号, 而VfASPAT3主要在干旱胁迫64 h时在CDAS105表达显著高于鄂蚕豆1号。此外, 在鄂蚕豆1号中,VfASPAT6在正常处理16 h,VfASPAT4、VfASPAT8在正常处理64 h表达较高, 而VfASPAT1、VfASPAT5、VfASPAT7在CDAS105正常处理64 h表达较高。为进一步验证上述结果,并确定蚕豆ASPAT基因在蚕豆干旱胁迫下的参与情况, 利用荧光定量PCR技术在2个蚕豆品种和2个处理时间中进行差异表达分析。由图6可知, 8个家族成员基因表达有所差异,VfASPAT1在干旱处理16 h和64 h时表达量上调, 后者与转录组分析结果不一致,VfASPAT2、VfASPAT3、VfASPAT4、VfASPAT7和VfASPAT8在干旱处理16 h和64 h表达量均上调,VfASPAT4转录组数据在干旱16 h和64 h无差异且表达量很低,VfASPAT5在干旱16 h时上调非常明显,64 h时表达量上调但不显著,VfASPAT5在转录组数据分析中64 h表达量下调, 两者结果不一致;VfASPAT6在干旱处理16 h时表达量上调, 64 h下调,64 h的表达量变化与转录组数据结果一致。综合转录组数据与荧光定量结果显示,VfASPAT1和VfASPAT5主要在干旱胁迫16 h时发挥作用,VfASPAT3主要在处理64 h时响应干旱胁迫,VfASPAT2、VfASPAT7和VfASPAT8在干旱处理16 h和64 h时均参与一定的生物过程,VfASPAT2和VfASPAT3差异最为显著。

图5 转录组鉴定蚕豆ASPAT表达Fig. 5 Relative expression pattern of ASPAT genes inVicia fababased on transcriptomeCK1-16/CK1-64为鄂蚕豆1号正常处理16 h/64 h; CK2-16/CK2-64为CDAS105正常处理16 h/64 h; T1-16/T1-64为鄂蚕豆1号干旱处理16 h/64 h; T2-16/T2-64为CDAS105干旱处理16 h/64 h。CK1-16 /CK1-64 represents 16 h/64 h normal treatments of Ecandou 1; CK2-16/CK2-64 represents 16 h/64 h normal treatments of CDAS105; T1-16/T1-64 represents 16 h/64 h drought stress of Ecandou 1; T2-16/T2-64 represents 16 h/64 h drought stress of CDAS105.

图6 实时荧光定量PCR分析VfASPAT在鄂蚕豆1号和CDAS105中的表达差异Fig. 6 Relative expression level ofVfASPATbetween Ecandou 1 and CDAS105 by qRT-PCRCK-16和CK-64分别为正常处理16 h和64 h时CDAS105/鄂蚕豆1号的表达量比值; T1-16和T1-64分别为干旱处理16 h和64 h时CDAS105/鄂蚕豆1号的表达量比值。小写字母表示差异显著性(P< 0.05)。CK-16 and CK-64 indicates the expression ratio of CDAS105/Ecandou 1 at 16 h and 64 h under normal condition; T-16 and T-64 indicates the expression ratio of CDAS105/Ecandou 1 at 16 h and 64 h under drought stress. Lowercase letters indicate significant difference in the 0.05 probability level among the treatments.
3 讨论
ASPAT是一个小基因家族, 广泛存在于动物、植物和微生物中。在植物中, ASPAT是调节碳和氮代谢的关键酶, 在整个生命活动中发挥重要作用[31]。然而, 由于蚕豆基因组巨大, 全基因组序列还未公布,所以还未见关于蚕豆VfASPAT基因的相关研究。本研究根据蚕豆干旱胁迫转录组数据, 对蚕豆VfASPAT基因家族进行分析, 根据系统发育关系、保守基序、基因结构和蛋白结构域等特征将其分为不同的亚族, 并对不同品种和不同干旱处理下的表达模式进行分析。基于干旱转录组数据分析, 共鉴定出8个VfASPAT基因家族成员, 3个编码AAT蛋白, 5个编码PAT蛋白, 并命名为VfASPAT1~VfASPAT8, 与已公布的其他植物物种如拟南芥[17]、杨树等一样[32], 系统发育分析结果表明蚕豆ASPAT蛋白主要可分为2个亚族, 即Iα和Iβ, Iα又进一步分为Iα-A、Iα-B和Iα-C三类, Iα-A中的VfASPAT定位于线粒体, Iα-C中VfASPAT在线粒体和叶绿体中均有分布, Iα-B和Iβ含有叶绿体VfASPATs, 说明他们在参与生物过程中具有不同的功能。Motif分析表明蚕豆ASPAT均含有motif 1、motif 3、motif 9三个保守基序, 说明这3种motif为该家族中非常重要的保守基序, 且AAT和PAT蛋白均具有磷酸吡哆醛结合位点, 磷酸吡哆醛是代谢中转氨酶的重要辅酶, 在代谢中起重要作用, 该结果与前人研究结果一致[32]。基因结构和蛋白结构域分析结果显示他们都具有相似的基因结构和共同的蛋白结构域Aminotran-1-2, 表明该家族成员的保守性。通过对VfASPAT蛋白质互作关系分析显示, 该家族蛋白主要与HPPD、MDH、DAPE和HTPA-reductase这些蛋白酶互作, 其中HPPD与该家族所有成员均有相互作用关系, 它是植物体中维生素E和质体醌合成途径的关键酶, 而质体醌是叶绿体光合电子传递链中电子传递的媒介[33], MDH是三羧酸循环中的关键酶, 参与植物抗逆境的反应过程[34], 它与VfASPAT1~5、VfASPAT7~8相互作用, 推测该家族成员参与了植物体内主要的代谢过程, 并与植物抗逆性有一定的关联。基因表达模式可在一定程度上反应基因功能, 通过研究蚕豆干旱胁迫过程中, 在不同品种不同处理时间下基因表达的变化, 反应参与干旱胁迫的基因功能, 但具体功能与作用方式还需进一步研究。本文基于蚕豆干旱胁迫转录组数据,分析蚕豆VfASPAT基因的表达模式并采用qRT-PCR进一步验证发现, 该家族8个成员基因在干旱处理条件下变化各异,VfASPAT2、VfASPAT7和VfASPAT8的表达量在干旱处理16 h和64 h时均上调,VfASPAT1和VfASPAT5在干旱处理16 h时上调,VfASPAT3在处理64 h时上调,VfASPAT6表达量在干旱处理64 h时下调, 表明蚕豆VfASPAT基因家族成员参与干旱胁迫过程, 且主要起正向调控的作用, 这与Seki等[18]、Su等[19]等的研究结果一致。在本研究的系统发育分析部分显示VfASPAT2与拟南芥的AtASPAT3亲缘关系最近, 且VfASPAT2在干旱胁迫后表达量均上调, 这与Seki等[18]研究一致, 在干旱或盐胁迫开始后的10 h和24 h,AtASPAT3转录水平提高。本研究的结果中各家族成员的表达既有上调也有下调, 这与杨树杂交种(P. deltoides×P. nigra)的ASPAT基因家族在干旱胁迫下的表达既有上调也有下调[35]的结果一致; 对大豆根瘤中ASPAT基因研究表明在干旱胁迫下基因表达下调[36], 本研究与此结果有些出入, 至于基因表达的差异可能与物种、植物组织部位、胁迫处理程度以及ASPATs基因的功能分化有关。
4 结论
基于蚕豆干旱胁迫转录组测序数据, 鉴定了8个蚕豆VfASPAT基因, 根据系统进化分析分为2个亚族, 均含有保守结构域, 存在于线粒体和叶绿体,根据蛋白互作分析该家族参与植物抗逆代谢过程。在干旱胁迫下, 蚕豆ASPAT基因家族成员在不同处理时间响应有差异, 除VfASPAT4和VfASPAT6外其他基因表达量都呈上调趋势,VfASPAT2和VfASPAT3差异最为明显, 推测在蚕豆遭受干旱胁迫过程中,这些基因可能存在着正向调控的作用。

