基于5-脂氧合酶代谢通路的中药复方干预动脉粥样硬化炎症的新思路
周铭涛 郭琰
(云南省药物研究所 云南省中药和民族药新药创制企业重点实验室,云南 昆明 650111)
心脑血管疾病的患病率和死亡率一直处于持续上升状态,动脉粥样硬化(atherosclerosis,AS)是发生急性心脑血管事件的病理基础,而目前AS的发病机制和确切病因尚未十分明确,现较为公认的是“炎症-损伤-反应”学说。
炎症是机体对外来入侵物的一种保护性反应,一个完整的炎症过程包括促炎期和炎症消散期。促炎期是当机体组织受损或微生物入侵时,机体释放促炎介质,在趋化因子和黏附因子的作用下,单核细胞进入受损部位分化成巨噬细胞,巨噬细胞吞噬并杀死外来入侵物,其后进入炎症消散期,在促消散介质的作用下,巨噬细胞将凋亡细胞吞噬清除,此过程也称为胞葬作用,并随淋巴排出炎症部位,恢复机体的稳态平衡。但当促炎介质分泌过多,导致机体长期处于炎症状态,炎症消散不足进而形成慢性炎症[1]。普遍认为AS是一种发生在血管壁的慢性炎症性病理过程,具有慢性炎症的“共同点”,即炎症介质的持续释放和促炎症消散的缺失。抗炎(抑制炎症介质的释放)一直是防治AS的有效途径,而促炎症消散则是近年来研究的热点。内源性促炎症消散介质和促炎介质失衡是AS斑块形成的重要原因。抑制炎症介质的释放、促进炎症消散和恢复机体的稳态平衡是治疗AS的关键。但由于炎症介质和促炎症消散介质一般都由不同的信号通路所介导,单靶点药物可能无法做到双方面的兼顾,而中药复方的多成分、多途径、多靶点的作用特点可能更具优势。5-脂氧合酶(5-lipoxygenase,5-LOX)代谢产物白三烯B4(leukotriene B4,LTB4)和脂氧素(lipoxin,LX)具有相反的作用特点,为中药复方抗炎和促炎症消散的理论提供了依据。本文从5-LOX代谢产物的角度出发,系统总结了LTB4和LX在AS炎症进程中的作用机制,从一条通路出发,以慢性炎症两个方面(促炎和炎症消散)的角度探讨中药复方防治AS的可能作用途径和新思路。
1 5-LOX与AS
花生四烯酸(arachidonic acid,AA)代谢通路是体内一条重要的炎症通路,对AS炎症具有显著的调节作用。生长因子和细胞因子活化磷脂酶,活化后的磷脂酶类可催化细胞膜磷脂产生AA,随后AA可在不同代谢酶的作用下合成具有不同生物学效应的脂质介质[2]。在这个过程中至少有3种代谢酶参与了AA的代谢:细胞色素P450酶,脂氧合酶( lipoxygenase,LOX)和环氧合酶(cyclooxygenase,COX),组织和细胞类型决定了何种代谢酶参与AA代谢。有意义的是,经LOX代谢合成的脂质介质LTB4(促炎介质)和LX(促炎症消散介质)在AS炎症中具有相反的生物活性[3],而5-LOX是二者合成的关键酶[4]。因此,调节5-LOX在细胞中的活性及表达对LX和LTB4的合成具有决定性作用。
5-LOX表达于白细胞、B淋巴细胞、肥大细胞、单核/巨噬细胞、树突状细胞和粒细胞[5]等。在AS巨噬细胞源性泡沫细胞中,转化生长因子-β(transforming growth factor-β,TGF-β)可上调5-LOX表达,在树突状细胞源性泡沫细胞中,集落刺激因子亦可上调5-LOX的表达[6]。
5-LOX虽说是合成LX和LTB4的关键酶,但到底合成哪一类与5-LOX在细胞中的活化有关。在细胞未受到刺激时,5-LOX主要表达于细胞核质和胞质中[7]。但当细胞受到刺激时,5-LOX被活化,活化后的5-LOX从核质和胞质中转移到细胞核的核膜上,与核膜上的AA反应生成LTB4,这也是LTB4合成的唯一途径。有文献[8]报道5-LOX的活化与其在细胞内的磷酸化和Ca2+浓度有关。5-LOX的磷酸化主要依赖于ERK1/2、PKA、CaMKⅡ和p38 MAPK等信号通路,ERK1/2、CaMKⅡ和p38 MAPK信号通路的活化可促进5-LOX转移至细胞膜的核膜上而合成LTB4,而PKA信号通路的激活则可抑制5-LOX转移至核膜,进而促进LX的合成[9-11]。
2 5-LOX促炎代谢产物LTB4与AS
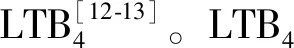
在生物活性方面,LTB4对多种炎症性细胞均具有趋化诱导作用,是导致AS形成的重要趋化因子和致炎因子[16]。文献报道,5-LOX、FLAP和LTA4H在AS的粥样硬化病变处均处于高表达状态。在低密度脂蛋白受体基因敲除(LDLR-/-)和载脂蛋白E基因敲除(ApoE-/-)的AS小鼠模型中,LTB4受体抑制剂可显著下调AS斑块面积;在AS炎症中,LTB4可上调尿激酶型纤维蛋白酶原激活剂、集落刺激因子、骨桥蛋白、清道夫受体CD36和趋化因子CCL2的表达[17]。值得一提的是,LTB4与CCL2的相互作用是一个阳性反馈回路:首先,LTB4可上调CCL2的表达,促进单核/巨噬细胞的聚集;其次,CCL2亦可活化AA代谢通路,合成更多的LTB4。此外,LTB4和CD36的相互作用亦构成一个阳性反馈回路,一方面,LTB4可上调CD36的表达,促进单核/巨噬细胞对氧化型低密度脂蛋白(oxidized low-density lipoprotein,ox-LDL)的吸收而形成泡沫细胞;另一方面,CD36也可促进趋化因子的产生而诱导LTB4的合成[18]。
在机制调节方面,LTB4通过活化NF-κB、JNK/MAPK和ERK1/2等信号通路而上调单核细胞趋化蛋白-1(monocyte chemotactic protein-1,MCP-1)的表达[19];通过活化p38 MAPK信号通路而上调CD36的表达[20];LTB4还可促进超氧阴离子的生成和激活磷脂酶D。此外,BLT1受体可抑制腺苷酸环化酶(adenylate cyclase,AC)的活性,进而阻断cAMP-PKA信号通路。
3 5-LOX促炎症消散代谢产物LX与AS
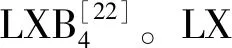
在生物活性方面,LX在AS的防治中发挥了重要作用。文献报道,LX可抑制脂多糖诱导的CD11/CD18的表达和白细胞介素(interleukin,IL)-8的释放;可抑制肿瘤坏死因子-α诱导的IL-1β的表达和超氧阴离子的释放;可抑制IL-1β诱导的基质金属蛋白酶的表达;可下调趋化因子MCP-1、血管细胞黏附因子-1和细胞间黏附因子-1的表达;此外,LX还能上调抗炎因子TGF-β、IL-13、IL-10和IL-4的释放[25]。以上生物活性主要体现LX的抗炎作用,而在促炎症消散方面,LX能促进树突状细胞和巨噬细胞从炎症病灶处排出;能促进巨噬细胞(M1)向巨噬细胞(M2)的转化;能抑制中性多形核白细胞向内皮细胞的迁移与黏附;促进组织修复,调节机体的稳态平衡[26]。
在抗炎机制调节方面,LX能抑制血管内皮生长因子诱导的p38 MAPK信号通路的表达;可抑制脂多糖诱导的活化蛋白-1和NF-κB信号通路的活化;通过与TGF-β结合而抑制ERK和PI3K/Akt信号通路的活性。在促炎症消散机制调节方面,LX能促进细胞因子信号转导抑制因子-2的释放;LX能激活AC,进而活化cAMP-PKA信号通路,在LX诱导的胞葬作用中PKA信号通路的活化尤为重要;此外,LX能通过外钙内流和内钙释放的途径上调细胞内Ca2+浓度,对Ca2+浓度的调节亦是与活化PKA信号通路有关,与PKC通路无关[27-29]。
4 LTB4与LX失衡
AS作为一种慢性炎症过程,表现为促炎介质的持续释放和促消散介质分泌不足,二者的失衡是AS炎症形成和发展的重要原因。在AA介导的炎症通路中,5-LOX活化代谢产生的脂质介质LTB4和LX表现出截然相反的生物学作用,对AS炎症起到“双刃剑”式的调节。大量泡沫细胞的产生以及死亡崩解后留下的粥样斑块是AS发生发展的重要环节,而在这个环节中巨噬细胞扮演了举足轻重的作用。LTB4和LX在AS炎症中对巨噬细胞的作用是不同的。LTB4作为趋化因子和促炎介质,可促进巨噬细胞向血管内皮下的聚集和转移,还可上调CD36蛋白的表达从而促进巨噬细胞吸收ox-LDL形成巨噬细胞源性泡沫细胞。LX同时兼备促炎症消散和抗炎活性,能促进巨噬细胞(M1)向巨噬细胞(M2)的转化,抑制黏附因子和趋化因子的释放,进而阻碍泡沫细胞的增多,促进巨噬细胞(M2)对泡沫细胞的吞噬,增强胞葬作用。在AS形成的整个过程中,LTB4和LX合成的趋向取决于组织和细胞类型及病灶的微环境、酶的激活条件、不同配体等状况。在AS炎症的发展进程中,LTB4在5-LOX催化合成中处于优势表达,同为5-LOX催化产物的LX并未占据主导地位,无法准确及时地将AS炎症介质消散进而导致AS的持续恶化。
5 中药复方干预AS炎症的新思路
针对5-LOX及其代谢产物LTB4的研究目前主要集中在咳嗽变异性哮喘、慢性阻塞性肺疾病等呼吸系统变态反应性疾病上。在LTB4或5-LOX与AS关系方面的研究及药物开发方面的研究上,国外研究较多。有文献报道COX-2抑制剂塞来昔布[30]、5-LOX抑制剂阿曲留通[31]和FLAP抑制剂维夫拉朋[32]等均可通过减少5-LOX和LTB4的产生而抑制AS的发展。在国内,中药或中药复方干预5-LOX介导的AS炎症的报道并不多见,传统活血化瘀中药秃毛冬青叶的成分青心酮能减轻ApoE-/-小鼠AS病变,可能与其抑制5-LOX,减少LTB4有关[33];中药止痛贴(pain-relieving plaster)可通过抑制5-LOX和COX-2通路而减轻慢性炎症性疾病[34];柴朴汤(Saiboku-to)中的黄芩也具有抑制5-LOX和降低LTB4的作用[35]。在有关5-LOX介导的炎症性疾病中,尚未见针对促炎症消散方面的中药或中药复方的研发报道。
抗炎作为抗AS的一条有效途径,是目前中医药干预AS及AS炎症的主要研究方向,本课题组在长期的AS炎症研究中发现,促炎症消散的缺失是AS炎症发展的重要原因,但目前研究较少。促炎介质和促炎症消散介质的失衡是AS血管慢性、非可控炎症出现的本质原因之一,二者的再平衡能有效缓解AS的进程。因此,从促炎介质和促炎症消散介质的“平衡”和“重塑”的角度开展防治AS药物的发现及其作用机理的研究,将具有重要的理论意义和实用价值[36]。
促炎介质和促炎症消散介质一般都是由不同的信号通路所介导,同时针对二者开展药物开发确实具有难度。然而5-LOX代谢通路介导的脂质介质LTB4和LX恰好在AS炎症中分别扮演了促炎和促炎症消散的角色。将抑制炎症介质的释放和促进炎症消散的研究转化为对LTB4和LX的研究,可同时使针对促炎和促炎症消散的研究简单化,也为针对二者的药物研发提供理论支撑和研究捷径。中药复方干预5-LOX代谢通路促炎和促炎症消散可能的作用方式详见图1。在针对不同的靶点药物开发中,中药复方较单靶点药物有着独特的优势,中药复方药效的特点就是具有多成分、多途径、多靶点的整合调节作用,与促炎和促炎症消散的研究较为契合。课题组针对AS炎症性疾病开发的参莲方,就具有抗炎和促炎症消散的双重作用,不仅可抑制促炎介质LTB4,还可上调促炎症消散介质LX的表达,相关的研究成果已在发表中。课题组在长期的研究及前期研究基础上认为中药复方干预5-LOX介导的AS炎症的途径可能有:(1)抑制LTB4和增强LX的释放;(2)抑制LTB4和上调LX受体的表达;(3)抑制LTB4和增强LX介导的细胞因子的表达,例如MCP-1和IL-10等;(4)改变5-LOX的磷酸化,抑制p38 MAPK、ERK1/2、CaMKⅡ等信号通路,激活PKA和PPARγ等促炎症消散信号通路。
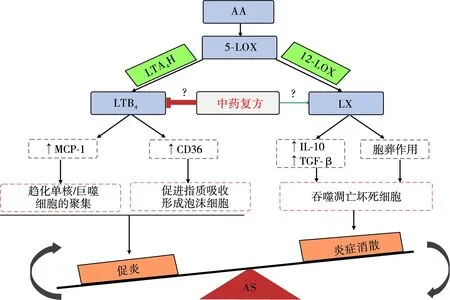
图1 中药复方干预5-LOX代谢通路促炎和促炎症消散可能的作用方式
6 总结与展望
在炎症发生发展的过程中,促炎症消散介质和促炎介质相辅相成、同等重要,处于一种动态平衡中,维持着机体的稳定,二者分泌过多或过少都是有害的[37]。AS是体内内源性促炎症消散介质不足和促炎介质持续释放引起的慢性炎症性病理过程。目前,在AS炎症药物的研发中,针对抗炎方面的研究较多,主要是针对其中一条或几条炎症通路而开展,相对于AS庞大的炎症网络通路,大多数研究已进入瓶颈期,近年来也未见相关药物的上市。而在促炎症消散方面的研究却鲜有报道,更未见针对AS炎症消散的药物研究。课题组前期大量的工作经验及研究基础认为从抗炎和促炎症消散两方面入手开展防治AS药物的研发及其作用机制的研究更具有意义。
5-LOX介导的AS炎症在AS进程中是一把“双刃剑”,其代谢产物LTB4和LX在AS炎症中分别扮演了促炎和促炎症消散的角色。因此,将抗炎和促炎症消散的研究转移到对5-LOX代谢产物的研究上,可为药物研发提供理论支撑和研究捷径。中药复方的作用特点与AS炎症的“稳态”和“平衡”等研究理念更为契合,是研究针对抗炎和促炎症消散药物开发的首选。本文系统总结了5-LOX代谢产物在AS炎症中截然相反的生物学特点,为从抗炎和促炎症消散两方面调节的角度寻求抗AS中药复方研究提供科学依据和理论参考。