补体C1q肿瘤坏死因子相关蛋白9与其受体的相互作用
路旭阳 焦凯 刘德敏 剧红娟 谷国强
(1.河北医科大学第二医院心内科,河北 石家庄 050000; 2.河北医科大学第二医院超声科 ,河北 石家庄 050000)
脂联素(adiponectin,APN)是一种由脂肪组织大量分泌到循环中的蛋白质,能改善全身能量稳态,对心血管系统及其他多个器官具有保护功能[1]。补体C1q肿瘤坏死因子相关蛋白(C1q and tumor necrosis factor-related proteins,CTRPs)家族是一个蛋白质超家族,目前已有15个成员,除CTRP4[2]含有两个球形C1q结构域,发挥抗炎作用,其余成员与APN结构相似(图1),包含一个氨基末端的信号肽结构域、一个短可变结构域、一个胶原样结构域和一个羧基末端的球状C1q结构域[3]。在CTRPs家族中,CTRP9与APN相似度最高[4],主要由白色脂肪组织分泌[5],脂肪细胞及基质细胞均可分泌CTRP9。人CTRP9蛋白含有333个氨基酸残基,相对分子质量约为3.2×104,其胶原样结构域含有56个Gly-X-Y重复结构[6]。CTRP9通过脂联素受体(adiponectin receptor,AdipoR)1、AdipoR2等受体介导多种功能,包括调节机体的能量和代谢平衡、稳定动脉粥样硬化斑块、调节血管舒张与收缩、抑制血小板活化和保护内皮细胞等[7]。
1 CTRP9的存在形式与组织中表达水平
在血浆中,CTRP9主要以球状结构域同种型(gCTRP9)的形式存在,为全长CTRP9(fCTRP9)经过蛋白酶水解切割产生,具有更强的生物活性[8]。gCTRP9通常以三聚体形式聚合,fCTRP9以低分子量和高分子量多聚体形式存在[9],此外,CTRP9还能与CTRPs家族其他成员及APN形成异聚体[4,10]。CTRP9在循环中的浓度与多种因素有关。Wong等[4]的研究发现,在小鼠模型中,与雄性小鼠相比,雌性小鼠血清CTRP9浓度较高;相同周龄的小鼠中,与瘦弱小鼠相比,肥胖小鼠CTRP9浓度较高;同时,随着年龄增长,血清中CTRP9浓度呈下降趋势。然而,Hwang等[11]发现,在人群中,女性与男性无明显差别,而CTRP9浓度与年龄、内脏脂肪量、血压、空腹血糖和甘油三酯水平呈负相关,与正常人群相比,患有代谢综合征患者的血清CTRP9浓度较低。Asada等[12]调查发现,2型糖尿病患者中,慢性肾脏病(chronic kidney disease,CKD)患者血清CTRP9浓度较高,无CKD的糖尿病患者血清CTRP9浓度与动脉粥样硬化相关。CTRP9在不同组织中表达不同。Wong等[4]发现,在筛选的 21 个器官/组织中,CTRP9 主要在心脏和脂肪组织中表达,在肾脏、肺、骨骼肌、前列腺、胸腺和子宫中亦有表达。
2 CTRP9受体的结构与表达
CTRP9目前主要有两种受体:AdipoR与N-钙黏蛋白(又称钙黏着蛋白-2)(N-cadherin,CDH2)受体。AdipoR包括AdipoR1和AdipoR2。二者属于一个新的含有七个跨膜域的受体家族,称为孕酮和AdipoR家族[13]。在人体器官中,AdipoR1主要在骨骼肌和心脏中表达,而AdipoR2则大多在肝脏中表达[4]。神经元、星形胶质细胞和小胶质细胞表达AdipoR1[14]。主动脉内皮细胞表达两种受体类型,但主要是AdipoR1[15]。脂肪细胞和正常乳腺上皮细胞[16]、子宫内膜腺体、管腔上皮细胞和基质细胞[17]等多种细胞中均有AdipoR1与AdipoR2的表达。AdipoR1与AdipoR2也在多种肿瘤细胞中表达。肝癌细胞中表达较多的AdipoR2,较少的AdipoR1[18]。前列腺癌细胞、乳腺癌细胞、子宫内膜癌细胞、结肠和神经母细胞瘤癌细胞[19]、胃上皮细胞、胃癌上皮细胞[20]和胶质母细胞瘤(glioblastoma,GBM)细胞[21]中均表达AdipoR1和AdipoR2。
CDH2是一种包含五个细胞外钙黏合素结构域重复序列、一个跨膜区和一个高度保守的细胞质区的完整膜蛋白,属于钙黏着蛋白家族中的经典钙黏合素[22]。钙黏合素大多集中分布在细胞间的黏附连接中,介导细胞间黏附,同时,CDH2还可能影响各种细胞过程的信号网络,包括细胞增殖、分化和凋亡,稳定细胞膜表面的成纤维细胞生长因子受体,从而介导细胞内信号传导[23]。CDH2的作用取决于其所在组织,如在心肌细胞中,CDH2能介导心肌细胞间的强黏附作用,维持心脏完整性,而在移行性成纤维细胞或间充质细胞上的CDH2,能被肿瘤细胞利用,促进肿瘤的侵袭和转移[23]。研究认为,CDH2参与心肌细胞间的间隙连接,影响心脏传导速度,重构缝隙连接,CDH2基因敲除增加室性心律失常的发生,与多种心脏疾病包括心肌肥厚、缺血性心肌损伤和扩张型心肌病有关。Li等[24]发现,CDH2基因敲除后的小鼠在6~8周后出现室性自主性心律失常引起的猝死。
然而,以往的文献表明,APN的生物学效应不仅取决于APN的相对循环浓度,还取决于其受体的表达水平和功能[13]。同理,CTRP9的生物学效应取决于其相对循环浓度,还取决于其受体的表达水平和功能,因此,探讨影响CTRP9受体的因素有助于对CTRP9的作用有更深的了解,见图2。
多种因素可影响AdipoR的表达。激素及细胞因子可影响AdipoR的表达。Mistry等[25]在研究肥胖与前列腺癌时发现,肥胖引起性激素及细胞因子的改变,通过影响AdipoR的表达,影响前列腺癌的生长与分化。睾酮降低雄激素敏感的前列腺癌细胞系前列腺淋巴结癌细胞AdipoR1和AdipoR2的表达水平,在雄激素不敏感的前列腺癌细胞系前列腺癌细胞中,AdipoR1和AdipoR2的表达水平则几乎不受影响。双氢睾酮、雌二醇、细胞因子肿瘤坏死因子-α和瘦素在不同细胞系中对AdipoR的表达影响不同。该研究表明激素和细胞因子可能通过AdipoR,介导肥胖对前列腺癌的促进作用。
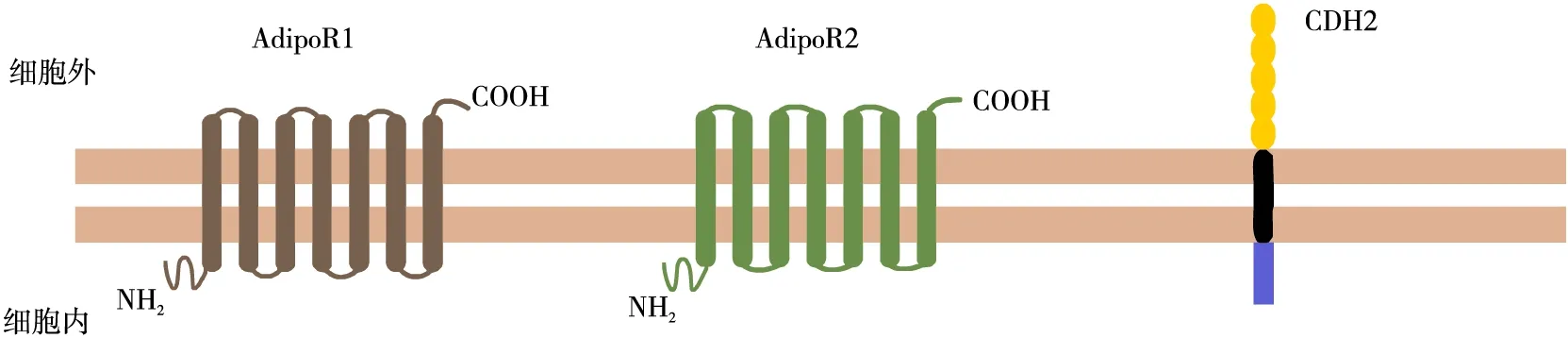
图2 CTRP9已知的3个受体
部分药物可影响AdipoR的表达。Duan等[26]研究发现,在糖尿病小鼠模型中,神经细胞经过竹节参皂苷预处理后,AdipoR1的表达随其浓度增加而增加,呈剂量依赖性。Gasbarrino等[27]研究发现,与未服用他汀类药物的颈动脉粥样硬化患者相比,服用高剂量阿托伐他汀(40~80 mg)或瑞舒伐他汀(20~40 mg)使巨噬细胞表达的AdipoR减少。这一发现可能解释了一部分使用他汀类药物的患者仍具有残余的患心血管疾病风险的可能原因。Shen等[28]的研究发现,吡格列酮能预防高血糖诱导的冠状动脉平滑肌细胞的AdipoR的表达水平的下降。随后的研究发现替米沙坦能通过激活冠状动脉平滑肌细胞中的过氧化物酶体增殖物激活受体-γ来改善AdipoR1和AdipoR2的表达[29]。
细胞癌变、细胞极化及转化生长因子-β(transforming growth factor-β,TGF-β)影响AdipoR的表达。Otani等[20]发现,AdipoR1和AdipoR2的表达水平在胃上皮细胞癌变后降低,在两种胃癌细胞系中发现,TGF-β具有降低两种AdipoR的潜力,据此推测,癌细胞以自分泌或旁分泌的形式分泌TGF-β,降低其表面AdipoR表达水平,促进癌细胞的生长。van Stijn等[30]研究发现,以小鼠骨髓和腹腔巨噬细胞为模型,巨噬细胞可分化为具有不同生物学特征的亚型,包括经典途径活化的M1型巨噬细胞和替代途径活化的M2型巨噬细胞[31]。巨噬细胞极化表型不同,AdipoR表达数量不同。M1型AdipoR的表达下降,M2型则保留AdipoR的表达。
3 CTRP9与AdipoR结合的作用
CTRP9与AdipoR结合可对心血管系统及其他系统产生多种影响。CTRP9对血管钙化具有保护作用。马雅楠等[32]研究表明,在糖尿病患者中,CTRP9是冠状动脉血管钙化的保护因子。Miyatake等[33]的研究发现,在接受肾移植的患者中,CTRP9可通过AdipoR1防止主动脉钙化的进展。血清CTRP9浓度的变化与血清高分子量APN浓度的变化密切相关。血清CTRP9浓度的变化与主动脉钙化面积指数的变化呈负相关,表明CTRP9可能是血管钙化的抑制因子。Moradi等[34]研究表明,CTRP9可能通过AdipoR1,抑制内皮细胞黏附分子的表达,防止机械损伤血管的内膜增厚和血管重塑[35],抑制血管平滑肌细胞的增殖,抑制新生内膜形成[36],防止主动脉血管钙化。CTRP9通过与AdipoR结合介导血管舒张作用。Zheng等[15]发现在人脐静脉内皮细胞上,CTRP9通过AdipoR1介导对血管的舒张作用,其机制主要为AMP活化蛋白激酶/蛋白激酶B/内皮型一氧化氮合成酶磷酸化,生成一氧化氮,引起血管舒张。CTRP9通过AdipoR减轻心肌缺血再灌注损伤。Kambara等[37]研究显示血液循环中的CTRP9能通过心肌细胞上的AdipoR1,激活AMP活化蛋白激酶,抑制炎症反应,减轻心脏缺血再灌注后出现的急性心脏损伤。
CTRP9与AdipoR结合可对其他系统发挥多种作用。其中,可对免疫系统产生多重影响。以巨噬细胞为例,CTRP9与AdipoR结合,可通过抑制肿瘤坏死因子-α和单核细胞趋化蛋白-1的表达[38],发挥抗炎作用,同时通过丝裂原活化蛋白激酶/线粒体动力蛋白相关蛋-1促进线粒体分裂[39],改善免疫代谢,促进巨噬细胞的胞葬作用。
CTRP9与AdipoR结合可能抑制神经细胞凋亡,保护神经系统。Zhao等[40]发现,在脑出血小鼠模型中,CTRP9通过与AdipoR1结合,降低血脑屏障的通透性,改善小鼠的神经功能缺损。Zhao等[14]发现,重组CTRP9还具有减少脑出血后神经元凋亡的作用。因此,补充CTRP9有可能成为减轻脑出血后神经损伤的有效方法。
CTRP9与AdipoR结合可能增加骨骼系统对炎症的耐受。Wang等[41]以体外的软骨细胞为模型,发现CTRP9通过AdipoR1,保护其免受白细胞介素-1β诱导的炎症损伤。CTRP9能通过循环到达全身,与不同细胞上的AdipoR结合,发挥多重作用,但CTRP9对多个系统的影响的具体机制仍待研究。
4 CTRP9与CDH2结合的作用
CDH2可介导CTRP9的心肌保护作用,还可能成为一种新型细胞表面标志物,预测骨髓细胞分化能力。Yan等[42]的研究中发现CTRP9结合CDH2通过多种新型信号通路,调节脂肪来源干细胞的分化,增强它们对缺血性心脏损伤的保护作用,从而提高干细胞治疗效果。Ishimine等[43]研究发现,CDH2是新的人骨髓间充质干细胞(mesenchymal stem cells,MSCs)表面标志物。当对具有分化为心肌细胞潜力的MSCs系的细胞表面标志物进行分析,发现高度表达CDH2的MSCs具有更高的心肌细胞分化能力,CDH2阳性比CDH2阴性的MSCs分化为跳动能力心肌细胞的能力更好。CTRP9可能通过影响MSCs的分化,以及心肌细胞之间的连接,提高MSCs的治疗效果。
5 其他可能结合的受体与作用
Ye等[44]研究发现,APN作为脂质调理素,能与一系列阴离子磷脂和鞘脂结合,如磷脂酰丝氨酸和硫酸盐,具有促进脂质清除的活性。这一特性可延伸到多个CTRPs和C1q家族成员,包括Cbln1、CTRP1、CTRP5 和 CTRP13,这表明其调理素功能是针对具有特定质膜磷脂成分的细胞。这些发现为研究CTRPs家族功能提供了一个新的视角。
据报道,钙网蛋白(calreticulin,CRT)具有介导调节炎症反应的作用。CRT与α2巨球蛋白受体共同参与APN介导的凋亡细胞的摄取[45]。抗钙素抗体预处理也被证明可减少APN与心肌细胞的结合,抑制APN刺激的蛋白激酶B激活和心肌细胞存活的增加[46]。或许CTRP9也可通过CRT与CD91发挥抗炎作用,有待进一步研究。
CRT可介导CTRP9的心肌保护作用。Zhao等[47]以CTRP9基因敲除的SD(Sprague Dawley)大鼠为模型的研究发现,心肌细胞来源的CTRP9通过结合内质网分子伴侣——CRT,激活蛋白激酶A/cAMP反应元件结合蛋白通路,抑制心肌细胞凋亡,进而减少心肌缺血和再灌注损伤。
松弛素/胰岛素样肽受体1(relaxin/insulin-like family peptide receptor 1,RXFP1)可能为CTRP9的新型受体。CTRP家族具有激活癌细胞中RXFP1介导的信号通路的潜力。CTRP8和CTRP1通过其N端肽模式“YAAFSVG”激活RXFP1,介导肿瘤细胞的侵袭。家族中的其他蛋白的翻译后修饰是否影响其与RXFP1有待研究,其结构的相似性也许能推广到其他成员[48]。
6 结语
本文讨论了CTRP9与其受体的结构与表达,总结了部分影响AdipoR的因素,并阐述了CTRP9通过其受体对心血管系统及对机体其他系统造成的影响,最后提出CTRP9的潜在作用途径。众多的相关研究为CTRP9的作用机制以及影响因素提供更加明确的线索,从而指导未来CTRP9的临床应用,为CTRP9提供更全面的信息。然而,目前的研究偏向AdipoR较多,对于其他受体的研究较少;对CTRP9与其受体结合的影响因素也较少提及基因水平及分子机制;另外,CTRP9的动物模型较少,仍需进一步开发,为CTRP9的相关研究提供更多资料。

