TBX15在结直肠癌组织中的表达及其临床意义
陈代儒,罗香蓉,李 胜,喻远尤,张 斌,刘天云
(南华大学附属邵阳医院,湖南 邵阳 422000)
结直肠癌是我国最常见的恶性肿瘤之一。其发病率在我国所有恶性肿瘤中居于第3 位,致死率居于第5 位(在城市地区仅次于肺癌居于第2 位)[1]。2015 年全国新发和死亡的结直肠癌患者分别占全部恶性肿瘤患者的9.87% 和8.01%[2]。内镜手术切除+术后辅助放化疗是结直肠癌标准的治疗方式。有研究指出,结直肠癌较容易发生转移,14% ~25% 的结直肠癌患者在原发肿瘤确诊时就发生了转移,高达50% 的患者在发病过程中会发生肝转移,最终会有40% ~50% 的患者死于结肠癌远处转移[3-4]。局部淋巴结转移及远处转移是影响结直肠癌患者预后的重要因素,Ⅲ、Ⅳ期结直肠癌患者的五年生存率仅为58.4%、14.4%[5]。TNM 分期是目前预测结直肠癌患者预后的最佳指标。近年来临床上发现了一些预测指标能够协助判断结直肠癌患者的预后。TBX15 是T-box家族中的一员,在人体生长发育中发挥着多种生理作用。TBX15 基因的突变缺失可能导致人类及小鼠外耳形态发育异常[6],TBX15 在人类前脂肪细胞中过表达会降低细胞内甘油三酯的积累量,抑制线粒体的呼吸作用、负向调节氧化作用。其能够驱动脂肪细胞中糖酵解代谢的增加。有研究指出,TBX15 在前脂肪细胞中的表达水平与糖酵解代谢标志物水平呈正相关,与肥胖程度呈负相关,其可能成为肥胖治疗的靶点[7-8];同时其在骨骼肌的糖酵解中发挥着重要作用,其缺失可能导致代谢综合征表型的发展,包括肥胖、肝脂肪变性和葡萄糖耐受不良[9]。研究表明,TBX15 在多种肿瘤的发生发展中扮演着重要的角色,TBX15 过表达能增强肿瘤细胞抗凋亡特性,促进肿瘤细胞的生长和转移。在转染TBX15 48 小时后,甲状腺癌细胞的增殖能力会显著增强,其抗凋亡性也会得到增强[10]。有研究指出,TBX15 在肾透明细胞癌组织中的过表达能够促进癌细胞的增殖、迁移和侵袭[11]。TBX15 有可能成为肿瘤的潜在治疗靶点。TBX15 与结直肠癌的关系目前临床上暂无报道。本研究主要是通过采用免疫组化法检测TBX15 蛋白在结直肠癌组织中的表达来探究其与结直肠癌患者临床病理特征及预后的关系。
1 资料与方法
1.1 标本及数据收集
收 集2016 年7 月1 日 至2017 年7 月31 日 在 南华大学附属邵阳医院经手术切除的结直肠癌组织标本103 例及癌旁正常组织50 例。通过南华大学附属邵阳医院住院电子病理系统收集患者临床病理资料的相关信息(包括年龄、性别、肿瘤位置、大体类型、组织学类型、分化程度、浸润深度、最大直径、淋巴结转移、神经脉管浸润、临床分期等)。纳入标准:(1)术后病理提示结直肠癌,且术前未接受放化疗及免疫靶向治疗;(2)患者知情同意参与研究;(3)临床资料完整。排除标准:(1)有其他恶性肿瘤病史;(2)合并其他脏器的严重病变及功能不全。本研究使用的标本均为手术治疗后采集标本,标本采集前均经患者同意(已签署同意书)。术后随访主要通过电话回访、门诊复查、术后化疗追踪等形式展开,随访截止时间为2022 年8 月31 日,随访时间为60 个月。患者总生存时间为手术治疗日期至末次随访日期或死亡日期(死亡原因均为结直肠癌及其复发或转移)。
1.2 主要试剂及相关仪器
兔 抗 人TBX15 多 克 隆 抗 体 购 于 上 海ABMART 公 司,DAB 染 色 液、PBS 缓 冲 液 及 二 抗〔MaxVisionTMHRP(Mouse/Rabbit)IHC Kit〕购 于福州迈新生物技术开发有限公司。手动切片机购自德国Leica 公司,PT Link 抗原修复仪购于丹麦Dako 公司,光学显微镜购自日本OLPMPUS 公司。
1.3 实验过程及结果判读
所有组织均用10% 的中性甲醛固定,行石蜡包埋。由同一切片机以4 μm 厚行连续切片,65℃干烤1 h 或60℃烤箱过夜,常规脱蜡至水。以ETDA(pH 9.0)行98℃ 20 min 抗原修复,PBS 缓冲液冲洗3 min×3次,3% 双氧水阻断内源性过氧化物酶。PBS 缓冲液冲洗3 min×3 次,滴加一抗后置入4℃冰箱孵育过夜(一抗浓度为1:150)。PBS 缓冲液冲洗3 min×3次,滴加二抗孵育20 min。PBS 缓冲液冲洗3 min×3次,DAB 显色10 min,流水冲洗1 min,苏木素染液复染5 min。流水冲洗1 min,1%盐酸水溶液分化3 s,饱和碳酸锂返蓝30 s。流水冲洗5 min,湿封片。以PBS 代替一抗作为阴性对照。结果由两位高年资病理医师在盲法条件下独立评估,结果不同则重新阅片确定最终结果。采用免疫组化积分法(总得分= 阳性肿瘤细胞百分比的得分× 染色强度的得分)进行染色结果的判定。阳性细胞百分比小于25% 计为1 分,25% ~50%计为2 分, 大于50% 计为3 分;无色计为0 分, 淡黄色计为1 分, 棕黄色计为2 分, 棕褐色计为3 分。总得分小于6 分定为低表达,大于或等于6 分定为高表达。
1.4 TCGA 数据分析
从癌症基因图谱TCGA 数据库(https://portal.gdc.cancer.gov) 中下载经统一标准化的TBX15 基因在结直肠癌及癌旁组织中的表达数据,导入R 软件(Version 3.64)进行进一步数据分析。纳入标准:(1)病理确诊为结直肠癌。(2)研究对象接受手术治疗。最后纳入结直肠癌患者380 例,癌旁正常组织样本50 例,其中包含32 对配对样本。
1.5 统计学方法
运用SPSS 27.0 及R 软件对数据进行统计学分析。TBX15 的表达情况与结直肠癌临床病理的关系选用χ² 检验。TCGA 数据计量资料均以±s表示,非配对样本差异性采用Wilcoxon Rank Sum Tests,配对样本差异检验使用t检验;采用Kaplan-Meier 法绘制生存曲线,Log-ranks 法比较两组生存曲线的差异性,检验水准α=0.05。
2 结果
2.1 TBX15 蛋白在结直肠癌组织和正常组织中的表达情况。
HE 染色如图1 所示,结直肠癌组织呈筛状并浸润性生长,细胞有异形,核浆比高,染色质粗染,可见病理性核分裂象,而正常结肠组织呈腺管状,排列均匀,细胞质红染。

图1 正常结肠组织和结直肠癌组织的HE 染色结果(10×10)
免疫组化结果如图2 所示,在50 例正常结直肠组织中高表达6 例,低表达44 例。在103 例结直肠癌组织中36 例患者TBX15 蛋白高表达,67 例低表达,差异有统计学意义(χ²=8.903,P<0.05)。
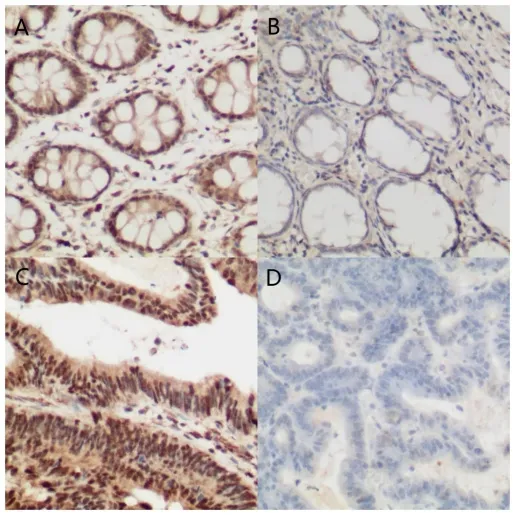
图2 正常结直肠组织与结直肠癌组织的TBX15 免疫组化结果(10×20)
2.2 TBX15 表达与结直肠癌临床病理的关系
进行TBX15 蛋白表达情况与103 例结直肠癌患者临床病理特征关联性分析的结果显示,TBX15 蛋白的表达与神经侵犯、脉管浸润相关,数据差异有统计学意义(χ2=9.482,P=0.002;χ2=7.690,P=0.006);与年龄、性别、肿瘤位置、大体类型、组织学类型、分化程度、浸润深度、最大直径、淋巴结转移、临床分期等临床病理特征均无明显的相关性。见表1。根据TBX15 蛋白表达情况绘制生存曲线,如图3 所示。由图3 可见,TBX15 高表达患者的生存时间短于低表达患者(χ2=8.337,P=0.004)。这表明,TBX15 蛋白低表达患者有着更好的预后。

图3 不同TBX15 表达情况结直肠癌患者的生存曲线
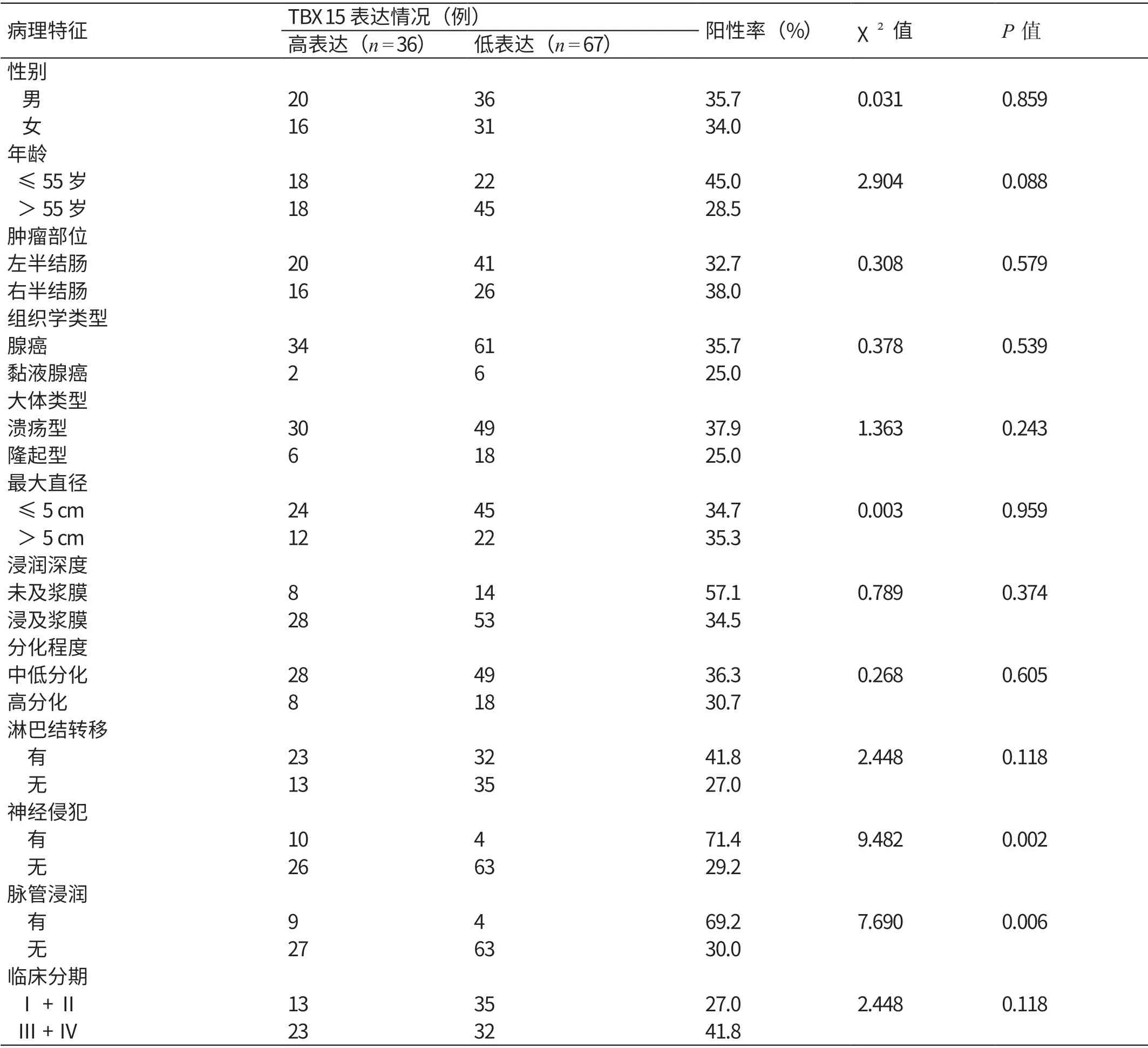
表1 TBX15 蛋白表达情况与103 例结直肠癌患者临床病理特征的关联性分析
2.3 TBX15mRNA 在正常结直肠组织及结直肠癌组织中表达情况的分析
2.3.1 TBX15 mRNA 在癌组织和癌旁组织中的差异表达 用R 软件(version 3.6.4) 分析50 例结直肠正常样本和380 例肿瘤样本TBX15 mRNA 表达的差异性,使用非配对的Wilcoxon Rank Sum Tests 进行差异显著性分析, 结果显示结直肠癌组织的TBX15 mRNA 表达(-2.42±1.60)较正常结直肠组织(-5.13±1.41)显著上调(P<0.0001)。见图4。

图4 TBX15 mRNA 在结直肠组织和结直肠癌组织中的表达情况
2.3.2 TBX15 mRNA 在配对癌组织和癌旁组织中差异表达的分析 用R 软件分析32 例配对样本中TBX15 mRNA 的差异性表达,差异检验使用配对样本的t检验。结果显示,TBX15 mRNA 在配对癌组织和癌旁组织中的表达(-2.40±1.42 VS -4.92±1.44)相比,具有显著差异(P<0.0001)。见图5。这表明,癌组织中的TBX15 mRNA 表达较配对正常组织样本明显升高。
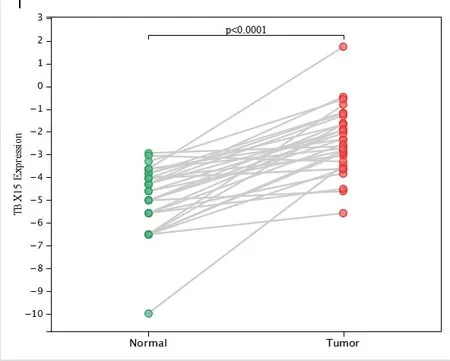
图5 TBX15 mRNA 在结直肠组织与结直肠癌组织中表达的差异性
2.3.3 分析TBX15 mRNA 表达与总生存时间的相关性根据380 例结直肠癌患者TBX15 mRNA 的表达高低百分位数(50%)将患者分成高低两组,进一步使用R 软件包survival 的survfit 函数分析两组的预后差异,并绘制K-M 曲线。利用logrank test 方法评估两组样本之间预后差异的显著性。结果显示,两组间存在显著的预后差异(P=0.03)。TBX15 mRNA 低表达患者的生存时间较长,TBX15 mRNA 高表达患者的预后较差。见图6。
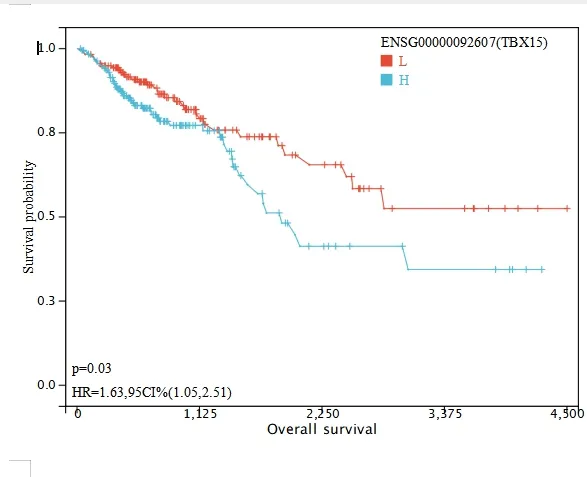
图6 TBX15 mRNA 的表达水平与结直肠癌患者生存时间的关系
3 讨论
box 基因家族是一个古老的基因家族,在所有后生动物体内均能够检测到(在其整个生物发育过程中具有重要意义)。在哺乳动物体内至少存在17 个T-box 基因,包括5 个亚科(T、Tbx1、Tbx2、Tbx6和Tbr1)。在人类发育过程中,T-box 基因在控制胚胎发育,参与癌症的进展和转移及在癌症转移治疗的抗性中都发挥着重要的作用。T-box 基因的上调或下调与多种不同类型癌症相关,并有可能是促进肿瘤形成的因素[12-13]。Tbx2 亚科中Tbx2、3 水平的升高与多种癌症相关,如黑色素瘤、胰腺癌、乳腺癌等;其可通过调节细胞增殖、肿瘤形成、转移、细胞存活和耐药性来促进肿瘤发展[14-15]。T 亚科中Brachyury的过表达与上皮间质转化(EMT)、肿瘤转移、癌症干细胞标志物的表达及对化疗和放疗的抵抗有关[16]。Tbr 亚科中的Tbx21 能够间接影响肿瘤的转移,通过影响NK 细胞的正常发育来影响机体适应性抗肿瘤免疫反应,从而使机体对转移性癌症的易感性大大增加[17]。TBX15 是T-box 基因家族中Tbx2 亚科中的一员。TBX15 的表达与甲状腺癌和肾细胞癌相关。有研究指出,TBX15 在前列腺癌组织中的高表达与其不良预后显著相关,此指标已被推荐作为前列腺癌的标志物[18]。Wu TI 等[19]在研究中指出,TBX15 作为多种表观遗传生物标志物之一, 可用于诊断卵巢癌,其在联合AMPD3、NRN1 时具有较高的灵敏度,有望成为宫颈癌筛查的指标。GOZZI 等[20]在研究中发现, 有82% 的卵巢癌病例存在TBX15 基因高甲基化、TBX15 蛋白表达水平较低的情况,而在所有甲基化水平低的卵巢肿瘤样本的几乎所有肿瘤细胞中都可观察到TBX15 蛋白的表达。GOZZI 认为,TBX15 可作为卵巢癌的生物标志物,用于相关早期检测、治疗及进展监测等各方面。对于TBX15 在结直肠癌组织中的表达情况及其与结直肠癌临床病理及预后等的关系目前临床上暂未见报道。本实验通过免疫组织化学法检测TBX15 蛋白在结直肠癌组织及癌旁正常组织中的表达情况,发现TBX15 蛋白在103 例结直肠癌组织标本中高表达36 例,低表达67 例;在50 例癌旁正常结肠组织中高表达6 例,低表达44 例;组间差异有统计学意义。TBX15 表达与神经侵犯和脉管浸润有关。与其他临床病理特征无明显关联。这表明,TBX15 蛋白的表达与结直肠癌的发生与发展存在密切关系。结合K-M 曲线可知,TBX15 高表达患者的生存率更低,生存时间更短。这些结果表明,TBX15 可作为判断结直肠癌患者预后的分子标志物。TCGA 数据库为临床基础研究特别是肿瘤的研究提供了大量、充足的基因组及临床数据,为研究肿瘤的临床病理特征及肿瘤发生发展与相关基因的关系提供了大量的数据基础。在本研究中,我们通过对TCGA 数据进行分析发现,TBX15 mRNA 在同一个体结直肠癌组织中表达较正常组织高,TBX15 低表达患者的总生存期更长。
综上所述,TBX15 与多种癌症的发展和转移相关,其可成为判断结直肠癌患者预后的分子标志物,未来更可能成为治疗结直肠癌的新靶点。在此之前,我们需要更多的临床及病理数据支持,需要进行更多的临床前实验去验证。而TBX15 影响结直肠癌发生发展及预后的作用机制仍有待进一步的研究探讨。

