附子理中丸通过NF-κB途径抗炎止泻的效应和机制
罗菲,郭建宏,窦玉玉,唐汉庆,王谨莹,张旭清
(右江民族医学院,广西 百色 533000)
伊立替康是一种半合成喜树碱衍生物[1]。其活性代谢物SN-38通过肝脏中的葡萄糖醛酸化代谢为伊立替康葡萄糖醛酸化(SN-38G),然后经胆汁排泄进入小肠,但是肠道中的细菌产生β-葡萄糖醛酸酶(GUS),会将SN-38G分解回其活性形式SN-38,其对肠上皮细胞有毒[2-3]。即使是低度腹泻也会明显干扰抗癌治疗效果,严重腹泻则会导致严重脱水、电解质失衡和营养不足,这与癌症患者的早期死亡有关。目前,伊立替康引起的腹泻治疗是基于饮食调整和使用止泻药物,如洛哌丁胺、生长抑素类似物奥曲肽等。然而,这些疗法往往会恶化现有的慢性胃肠道症状或诱发其他副作用[4-5]。因此本实验主要研究的是中成药附子理中丸对于伊立替康引起腹泻的干预作用,并通过NF-κB途径探讨其分子机制。
1 材料与方法
1.1动物 SPF级8周龄Wistar雄性大鼠56只,体质量(180±20) g,购自长沙市天勤生物技术有限公司[实验动物许可证号:SCXK(湘)2019-0013]。大鼠饲养于右江民族医学院SPF级动物实验中心,本实验的开展得到了右江民族医学院伦理委员会的认可。
1.2药物与试剂 伊立替康(CPT-11)(MedChemExpress,批号:#106771,#120150);附子理中丸(河南省济源市济世药业有限公司,批号:国药准字 Z41020010);小檗碱(北京索莱宝科技有限公司,批号:No.924L022);IKK-β抑制剂(MedChemExpress,批号:#24441);HE染色试剂盒(北京索莱宝科技有限公司,批号:No.20201215);TNF-α ELISA试剂盒(Elabscience,批号:AK05PD281092);TGF-β1 ELISA试剂盒(Elabscience,批号:AK02R28F7339);IL-4 ELISA试剂盒(Elabscience,批号:AK064FLN1874);IL-10 ELISA试剂盒(Elabscience,批号:AK042LPD0309);超纯RNA提取试剂盒(爱思进生物技术有限公司,批号:06421KD1);cDNA第一链合成试剂盒(碧云天生物技术有限公司,批号:No.072522220912);实时荧光定量PCR检测试剂盒(翊圣生物科技有限公司,批号:H9001120);p65、p50和IKK-β引物(上海捷瑞生物工程有限公司);兔抗鼠GAPDH多克隆抗体(武汉三鹰生物技术有限公司,批号:00092829);兔抗鼠p65多克隆抗体(武汉三鹰生物技术有限公司,批号:23002238);兔抗鼠p50多克隆抗体(武汉三鹰生物技术有限公司,批号:00117644);兔抗鼠IKK-β多克隆抗体(武汉三鹰生物技术有限公司,批号:00072558)。
1.3仪器 CK41-32PH型显微镜(日本Olympus公司);TGEM Plus型微量紫外分光光度仪(北京天根生化科技有限公司公司);ME204E型电子天平(奥豪斯电子仪器有限公司);5424R小型台式高速冷冻离心机(上海艾本德国际贸易有限公司);酶标仪(河北慧采科技有限公司);Tanon-5200 multi型全自动化学发光图像分析仪;LightCycler96型实时荧光定量聚合酶链式反应系统(上海罗氏制药有限公司)。
1.4动物分组、造模与给药 将56只Wistar雄性大鼠按体质量随机分为对照组、模型组、小檗碱组、IKK-β抑制剂组,附子理中丸低剂量组、附子理中丸中剂量组、附子理中丸高剂量组,每组8只大鼠。除对照组外,其余大鼠按照 125 mg/kg体质量给予腹腔注射伊立替康溶液,连续5 d,对照组大鼠则腹腔注射等容量生理盐水。其间每日观察记录大鼠腹泻情况2次。在给药结束48 h内,除对照组外,其余组大鼠均发生不同程度的腹泻。造模成功后,阳性药物组给予10∶1水溶液灌胃,给药量为50 mg/kg;IKK-β抑制剂组给予1∶1水溶液灌胃,给药量为2 mg/kg;将附子理中丸研磨成细粉状后,加入1倍蒸馏水煮20 min,配制成 0.3 g/mL的混悬液,附子理中丸低剂量组、附子理中丸中剂量组、附子理中丸高剂量组分别给予10 g/kg、20 g/kg、40 g/kg附子理中丸混悬液灌胃[6];其余组则是给予等容量的蒸馏水灌胃;连续灌胃30 d。随后取材检测相关指标。
1.5HE染色 将大鼠结肠组织石蜡切片依次放入二甲苯Ⅰ、二甲苯Ⅱ各20 min,然后依次放入无水乙醇Ⅰ、无水乙醇Ⅱ各15 min,之后放入75%的乙醇5 min,然后用自来水冲洗,再放入苏木素染液中浸染5 min,用分化液分化和返蓝液返蓝后将切片放入梯度酒精中各5 min,然后将切片稍晾干后用中性树胶封固,最后用显微镜观察并进行图像采集分析。
1.6透射电子显微镜 将组织固定后漂洗、脱水、浸透、包埋、修块、切片及染色后,用透射电子显微镜观察并进行图像采集分析。
1.7ELISA法 使用相对应的ELISA试剂盒检测,具体操作严格按照说明书进行。检测结肠组织中炎性因子TNF-α、TGF-β1、IL-4及IL-10的含量。
1.8实时荧光定量聚合酶链式反应法检测大鼠结肠组织中p65、p50以及IKK-β mRNA的表达情况 首先按照试剂盒说明书提取总RNA,检测RNA浓度以及纯度OD260/OD280比值在1.8~2.1范围内的RNA样本可逆转录。然后用逆转录试剂盒将总RNA逆转录为cDNA,其条件为42 ℃孵育60 min,80 ℃孵育10 min。最后将cDNA进一步扩增,目的基因扩增所需的条件是95 ℃预变性5 min,95 ℃变性10 s,60 ℃退火/延伸30 s,整个过程40个循环。目的基因引物均由上海捷瑞生物工程有限公司合成,以GAPDH为内参,各目的mRNA用2-△△Ct计算其相对表达量。引物序列见表1。
1.9蛋白免疫印迹法检测大鼠结肠组织中p65、p50以及IKK-β蛋白的表达情况 将大鼠结肠组织蛋白质提取完成后收集管内上清液;按BCA蛋白浓度测定试剂盒说明书测定总蛋白浓度,加入5×蛋白上样缓冲液,放入100 ℃水浴变性10 min。对变性好的总蛋白进行凝胶电泳、转膜、封闭、一抗孵育、二抗孵育,应用自动化学发光图像分析仪显影,最后将p65、p50以及IKK-β蛋白的条带灰度值与内参条带灰度值的比值作为目的蛋白相对表达水平。
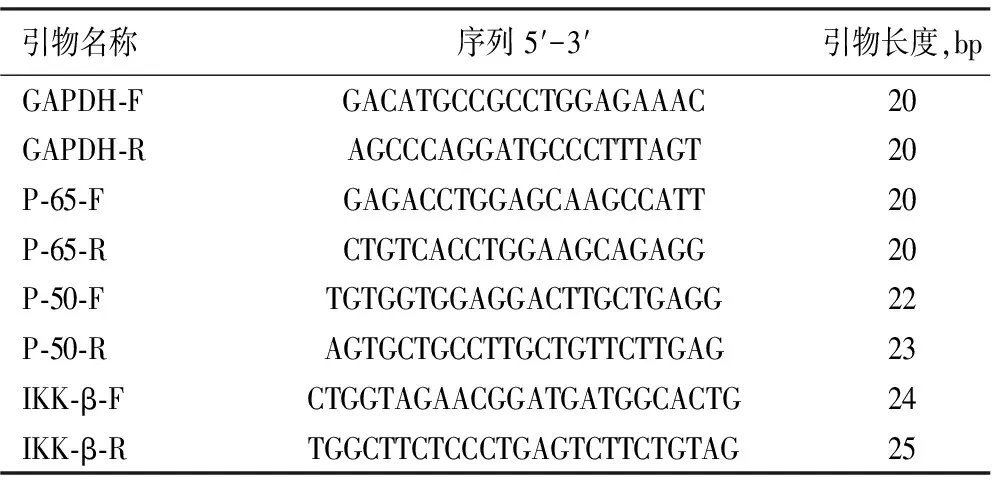
表1 qRT-PCR引物序列
2 结果
2.1大鼠结肠组织形态学的变化 与对照组相比,模型组大鼠肠黏膜杯状细胞缺失,隐窝减少或缺失,腺体组织紊乱,黏膜和黏膜下层被炎性细胞浸润,上皮细胞间间隙明显扩大;与模型组相比,小檗碱组与IKK-β抑制剂组、附子理中丸低剂量组、附子理中丸中剂量组、附子理中丸高剂量组结肠黏膜相对光滑,杯状细胞形态正常,隐窝表面相对规则,腺体排列整齐,单层柱状上皮细胞形态正常但有些缺失,炎性细胞浸润减少;与小檗碱组相比,IKK-β抑制剂组,附子理中丸低剂量组、附子理中丸中剂量组、附子理中丸高剂量组肠黏膜变化不太明显。见图1。
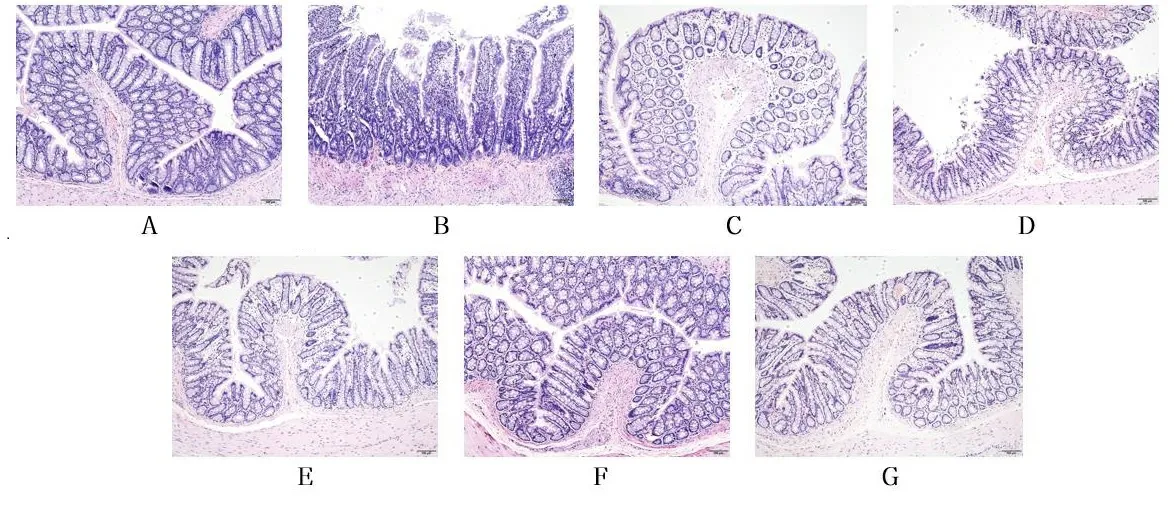
注:A.对照组;B.模型组;C.小檗碱组;D.IKK-β抑制剂组;E.附子理中丸低剂量组;F.附子理中丸中剂量组;G.附子理中丸高剂量组。
2.2大鼠结肠组织超微结构的变化 与对照组相比,模型组肠黏膜上皮细胞损伤相对明显,细胞膜局部破损,细胞器明显肿胀,微绒毛(Mv)大面积退化,细胞间隙局部明显增宽(箭头),线粒体(M)数量丰富,大多明显肿胀、变大,基质变淡,嵴断裂、减少;与模型组相比,小檗碱组与IKK-β抑制剂组、附子理中丸低剂量组、附子理中丸中剂量组、附子理中丸高剂量组肠黏膜上皮细胞轻微水肿,细胞膜完整,个别细胞器轻微肿胀,微绒毛(MV)个别细胞退化,线粒体(M)数量丰富,膜完整,嵴存在,部分局部基质变淡;与小檗碱组相比,IKK-β抑制剂组、附子理中丸低剂量组、附子理中丸中剂量组、附子理中丸高剂量组肠黏膜超微结构变化不太明显。见图2。
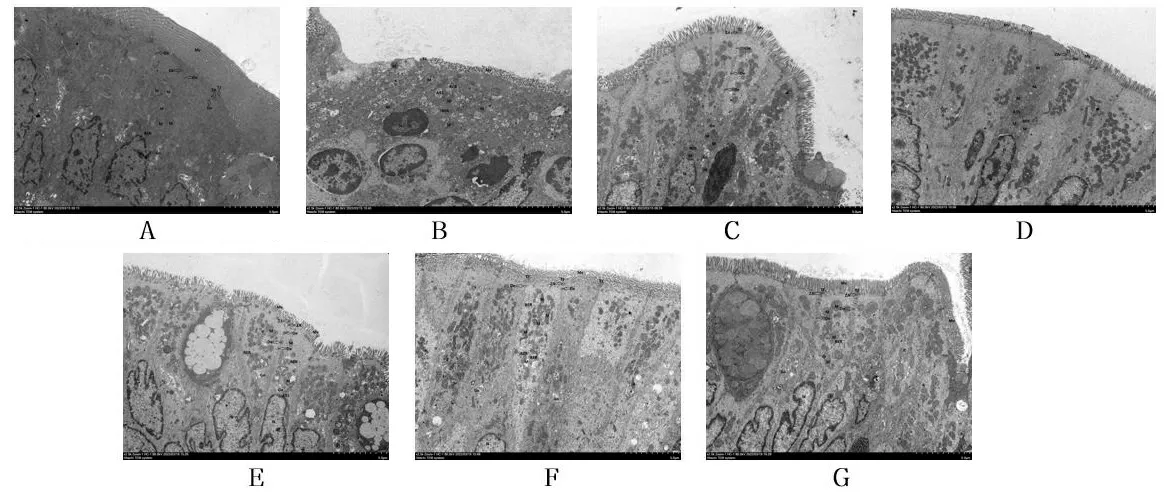
注:A.对照组;B.模型组;C.小檗碱组;D.IKK-β抑制剂组;E.附子理中丸低剂量组;F.附子理中丸中剂量组;G.附子理中丸高剂量组。
2.3ELISA法检测TNF-α、TGF-β1、IL-4及IL-10的含量 与对照组相比,模型组大鼠结肠组织TNF-α、TGF-β1含量明显升高,差异具有统计学意义(P<0.01);与模型组相比,小檗碱组、IKK-β抑制剂组、附子理中丸各剂量组的TNF-α、TGF-β1含量降低,炎症有缓减的趋势,差异有统计学意义(P<0.01);与小檗碱组相比,IKK-β抑制剂组、附子理中丸各剂量组的TNF-α、TGF-β1含量升高或降低,差异有统计学意义(P<0.01)。与对照组相比,模型组大鼠结肠组织IL-4、IL-10含量明显降低,差异具有统计学意义(P<0.01);与模型组相比,小檗碱组、IKK-β抑制剂组、附子理中丸各剂量组的IL-4、IL-10含量升高,差异有统计学意义(P<0.01);与小檗碱组相比,IKK-β抑制剂组、附子理中丸各剂量组的IL-4、IL-10含量升高或降低,差异有统计学意义(P<0.01)。见表2、表3。
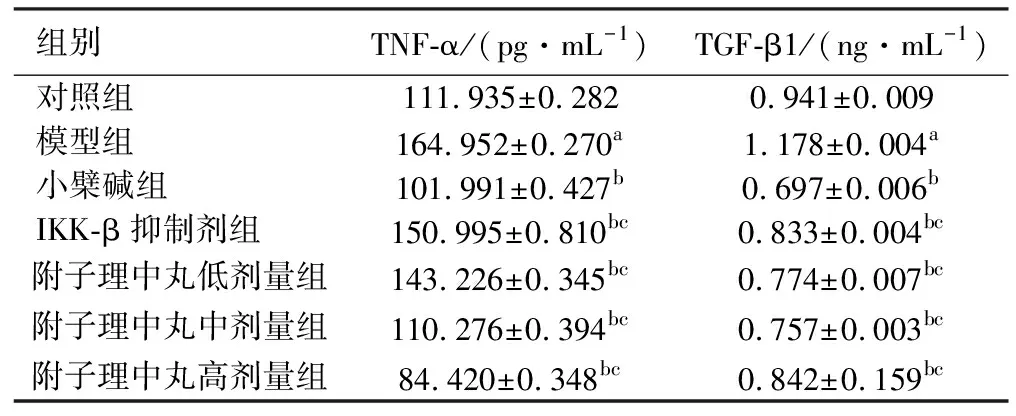
表2 各组大鼠结肠组织TNF-α、TGF-β1的含量 (n=5)
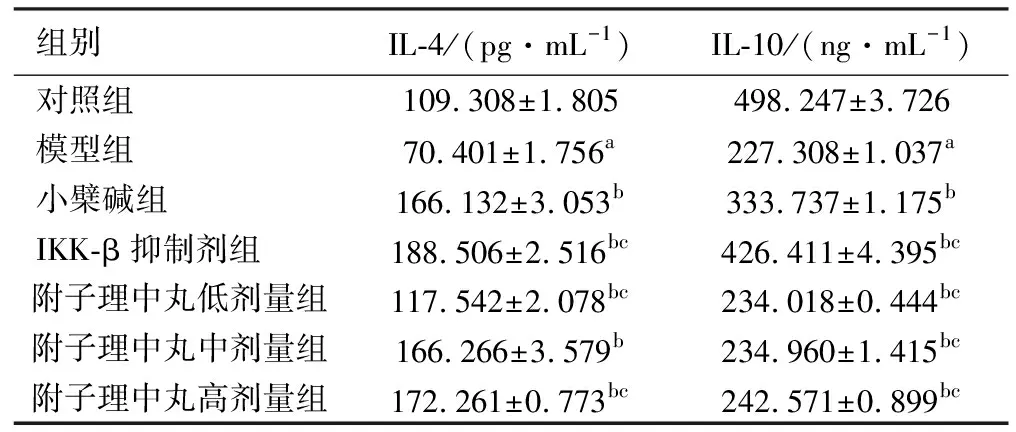
表3 各组大鼠结肠组织IL-4、IL-10的含量 (n=5)
2.4实时荧光定量聚合酶链式反应法检测p65、p50以及IKK-β mRNA的相对表达量 与对照组相比,模型组大鼠结肠组织p65、p50以及IKK-β mRNA相对表达量明显升高,差异有统计学意义(P<0.01);与模型组相比,小檗碱组、IKK-β抑制剂组、附子理中丸各剂量组的p65、p50以及IKK-β mRNA相对表达量降低,差异有统计学意义(P<0.05或P<0.01);与小檗碱组相比,IKK-β抑制剂组、附子理中丸各剂量组的p65、p50以及IKK-β mRNA相对表达量升高或降低,部分组别差异有统计学意义(P<0.05或P<0.01)。见图3。
2.5蛋白免疫印迹法检测p65、p50以及IKK-β蛋白的表达水平 与对照组相比,模型组大鼠结肠组p65、p50以及IKK-β蛋白的表达水平明显升高,差异具有统计学意义(P<0.01);与模型组相比,小檗碱组、IKK-β抑制剂组、附子理中丸各剂量组的p65、p50以及IKK-β蛋白的表达水平降低,差异有统计学意义(P<0.05或P<0.01);与小檗碱组相比,IKK-β抑制剂组、附子理中丸各剂量组的p65、p50以及IKK-β蛋白的表达水平升高或降低,部分组别差异有统计学意义(P<0.05或P<0.01)。见表4、图4。
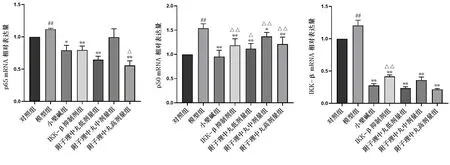
注:与对照组比较:#P<0.05,##P<0.01; 与模型组比较:*P<0.05,**P<0.01;与小檗碱组比较:△P<0.05,△△P<0.01。
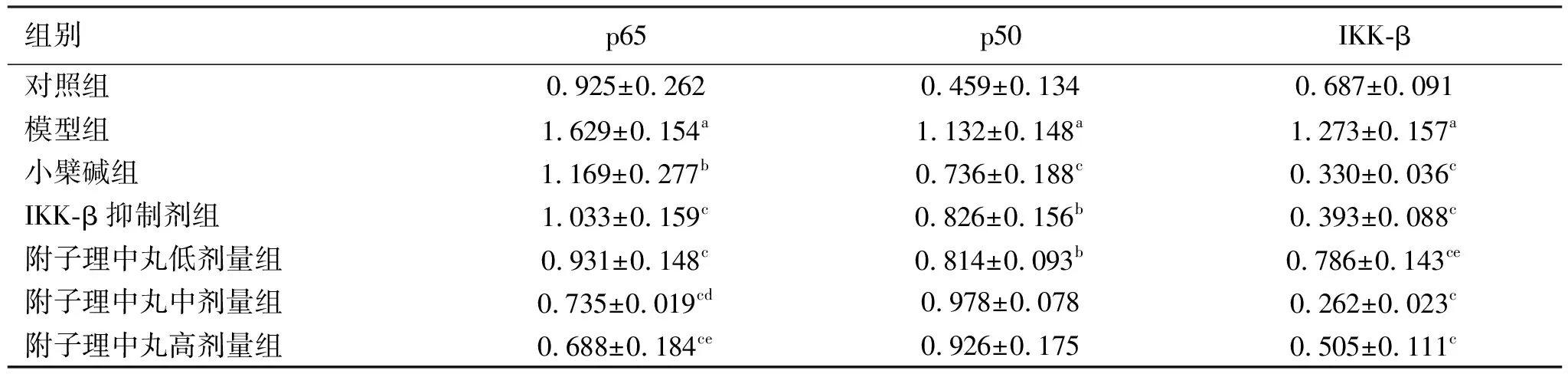
表4 各组大鼠结肠组织p65、p50、IKK-β蛋白表达水平 n=3)
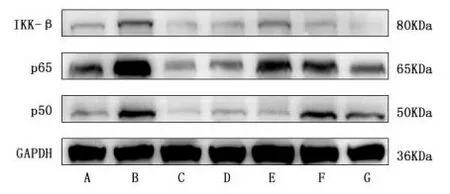
注:A.对照组;B.模型组;C.小檗碱组;D.IKK-β抑制剂组;E.附子理中丸低剂量组;F.附子理中丸中剂量组;G.附子理中丸高剂量组。
3 讨论
附子理中丸是由张仲景《伤寒论》中名方理中丸加附子组方而成,2020年版《中华人民共和国药典》记载附子理中丸的功效为温中健脾,可用于脾胃虚寒,脘腹冷痛,呕吐泄泻以及手足不温[7-8]。目前附子理中丸具有抗炎镇痛、调节免疫以及抗肿瘤等作用,但其主要还是作用在消化系统疾病方面[9]。另有研究表明附子理中丸可以通过降低NF-κB1(p50)、RelA (p65)、TNF-α因子,来减轻炎症反应[10]。
伊立替康是一种常用的化疗药物,据报道[11-12],伊立替康作为二线疗法可以提高晚期癌症患者的总体生存率,其在1996年被食品和药物管理局批准用于治疗晚期结直肠癌。已有研究表明[13-14],伊立替康会导致严重的肠屏障破坏,而屏障功能障碍与腹泻之间存在关联,但目前屏障功能障碍导致腹泻的机制尚不清楚。
本实验通过建立伊立替康诱导大鼠腹泻模型,用中成药附子理中丸去干预,旨在探讨附子理中丸通过NF-κB途径的抗炎止泻作用。腹泻以及炎症反应都会破坏肠黏膜屏障,因此通过HE染色以及透射电子显微镜两种实验观察肠黏膜的结构变化,以及超微结构细胞器的改变。结果表明,附子理中丸对于肠黏膜有一定的改善作用。大多数情况下,促炎细胞因子和抗炎细胞因子同时释放,并同样作用于有效的免疫应答[15]。肿瘤坏死因子TNF超家族通常是膜结合蛋白,都能激活细胞内的信号转导途径。转化生长因子(TGF)超家族可以参与炎症和修复反应的调节,IL-4与IL-10通常被认为是一种抗炎细胞因子,具有多种作用[16]。通过对TNF-α、TGF-β1、IL-4及IL-10炎性因子的检测,可以表明伊立替康诱导了肠道发生炎症反应,并且附子理中丸对于该反应有一定的调节作用。NF-κB是一个转录因子家族,包括哺乳动物中的NF-κB1(p50/p105)、NF-κB2(p52/p100)、RelA(p65)、RelB和c-Rel[17-18]。内源性炎症刺激(如细胞因子TNF-α、IL-1β)或病原体衍生物质通过“经典”或“非经典”NF-κB途径激活普遍存在的p65和p50同源/异源二聚体,其在胞质中与抑制蛋白ⅠκB结合形成了三聚体复合物而处于失活状态[19]。通过对NF-κB途径相关因子p65、p50、IKK-β mRNA以及蛋白水平的检测,表明附子理中丸可能是通过调节NF-κB途径来减轻肠道的炎症反应,并且改善其免疫功能。
综上所述,本实验研究结果表明附子理中丸具有抗炎止泻的作用。其机制可能是附子理中丸通过调节NF-κB途径的上游以及下游因子,来改善肠道损伤。具体机制是降低促炎因子和升高抗炎因子来调节炎症反应,并且通过抑制p65、p50和IKK-β因子来干预NF-κB途径,进一步减轻肠道腹泻与炎症。

