miR-9-5p通过SIRT1/NF-κB通路促进胰腺癌细胞凋亡的实验研究
李雪颀,周青宏,潘春风,王语阳,苏拾香,岑兰英,潘路娟,覃月秋
(1. 右江民族医学院附属医院,广西 百色 533000;2. 右江民族医学院研究生学院,广西 百色 533000)
胰腺癌是一种死亡率极高的恶性肿瘤,因其早期诊断率低,确诊常常已延误最佳治疗时机、预后不良[1]。最常见的胰腺癌类型是胰导管腺癌(pancreatic ductal adenocarcinoma,PDAC),其往往由胰腺上皮内瘤变(PanINs)和导管内乳头状黏液性肿瘤(IPMN)的增生性病变等癌前病变演化而来[2]。近年来,全世界胰腺癌的发病率和死亡率都在逐年增加,尽管诊断和治疗手段都有了新的发展,但确诊后五年生存率却仅为5%,约80%的患者无法接受外科治疗。即便进行了早期手术切除,术后五年生存率也仅为15%~25%[3]。胰腺癌的预后情况差,一方面与早期诊断率低有关,另一方面,胰腺癌细胞对凋亡刺激的反应差,因此放疗、化疗及免疫疗法等常规治疗方案效果均不理想[4]。
沉默调节蛋白1(sirtuin 1,SIRT1)是一种烟酰胺腺嘌呤二核苷酸依赖性脱乙酰酶,是sirtuins蛋白家族中的一员,大小约为80 kDa左右,作为一种核酶,SIRT1广泛存在于身体各器官的细胞中,因其对老化、自噬 、凋亡、炎症等调节的作用突出而受到学术界广泛关注,亦被称为“长寿蛋白”[5]。SIRT1抑制凋亡的作用可以导致半胱氨酸蛋白酶-3(Caspase-3)的分裂[6]。在关于胰腺癌相关的研究中,SIRT1通常被认为可以通过调节癌细胞的凋亡等方式影响其耐药性[7]。
miR-9-5p在癌细胞相关的研究中被报道,可以通过调控NF-κB通路表达来调节细胞的生理活动[8],在巨噬细胞中,miR-9-5p通过抑制SIRT1来调节NF-κB通路[9]。然而,miR-9-5p通过SIRT1/NF-κB通路调节细胞凋亡的过程在胰腺癌中的作用机制少见报道。本研究探讨miR-9-5p调控SIRT1通过NF-κB通路对PDAC细胞系PANC-1细胞凋亡的影响,这将为胰腺癌的诊断及治疗提供新的思路。
1 材料和方法
1.1材料
1.1.1细胞株 人胰腺癌PANC-1细胞购于中国科学院典型培养物保藏委员会细胞库。
1.1.2主要试剂 DMEM培养基购自武汉普诺赛生命科技有限公司;胎牛血清、DMEM高糖培养基购自Gibco公司;青-链霉素、胰蛋白酶购自北京索莱宝科技有限公司;上海吉凯基因医学科技股份有限公司,构建miR-9-5p过表达慢病毒载体,并完成包装、滴度的测定(载体类型:GV慢病毒载体系列,荧光标记:EGFP);质粒、嘌呤霉素均购于上海吉凯基因医学科技股份有限公司;qRT-PCR引物、miRNA第一链cDNA合成(茎环法)均购于生工生物工程(上海)股份有限公司;X-tremegene HP购于上海罗氏制药公司;SYBR Master Mix扩增试剂盒购自上海翊圣生物科技有限公司;opti-MEM、Trizol、mRNA第一链cDNA试剂盒均购自美国赛默飞世尔科技公司;ELISA试剂盒购于武汉伊莱瑞特生物科技股份有限公司;双荧光素酶报告基因试剂盒购于普洛麦格(北京)生物技术有限公司;蛋白酶抑制剂混合物、一抗稀释液、二抗稀释液、电泳缓冲液、转膜缓冲液、20×TBST、封闭液、彩虹Marker均购自上海碧云天生物技术有限公司;PAGE凝胶快速制备试剂盒、Omni-EasyTM速溶型蛋白上样缓冲液(变性,还原型,5×)、超敏ECL化学发光试剂盒均购自上海雅酶生物医药科技有限公司;SIRT1抗体、NF-κB p65抗体、p-NF-κB p65抗体、Caspase-3抗体、β-actin抗体购自英国Abcam;兔抗鼠IgG HRP购自Affinity;PVDF膜购自美国Millpore公司。
1.2方法
1.2.1细胞培养、转染及分组 PANC-1细胞在37 ℃、5%CO2条件下培养,使用10%胎牛血清的DMEM高糖培养基。将PANC-1细胞接种于6孔板,当细胞生长至50%~60%融合度时,将慢病毒加入孔板中进行转染。分组如下:mimic组,转染miR-9-5p过表达慢病毒;NC组,转染空载体慢病毒;空白组,不转染慢病毒。转染12 h更换新鲜培养基,24 h后开始表达绿色荧光,72 h荧光表达最强,在荧光显微镜下观察慢病毒转染效率,最后用嘌呤霉素进行稳定转染细胞株的筛选。
1.2.2qRT- PCR 转染24 h后用Trizol提取各组细胞RNA,紫外分光光度计检测RNA浓度和纯度。使用赛默飞逆转录试剂盒合成cDNA,以β-actin作为miR-9-5p、SIRT1和NF-κB p65的内参,qRT-PCR反应条件为:预变性95 ℃ 300 s,变性95 ℃ 10 s,退火/延伸60 ℃ 30 s,40个循环。结果使用2-△△Ct法来分析。实验重复3次,引物见表1。
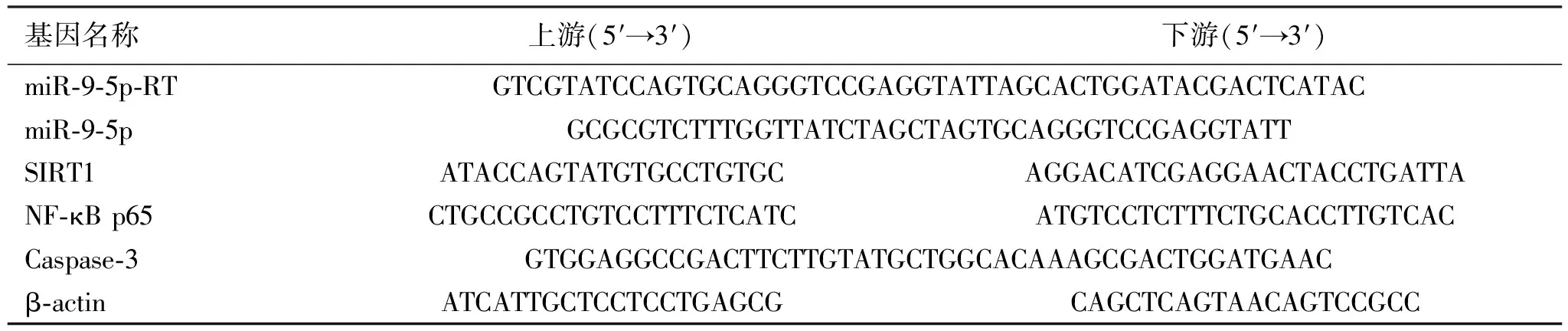
表1 RT-qPCR实验各基因引物序列
1.2.3Western Blot 在各组细胞中加入含有1%蛋白酶抑制剂PMSF的RIPA裂解液冰上裂解35 min,在4 ℃条件下,12 000 r/min离心15 min, 取上清置于EP管中, 通过BCA试剂盒测定各组样品蛋白的浓度,加入5×蛋白上样缓冲液, 沸水煮沸15 min,以30 μg蛋白浓度进行PAGE凝胶电泳,常规湿法转膜后,5%牛血清白蛋白封闭2 h,分别用1∶1 000的鼠抗兔单克隆抗体GAPDH、1∶20 000的鼠抗兔单克隆抗体SIRT1、 1∶1 000鼠抗兔的单克隆抗体Caspase-3的一抗4 ℃摇床孵育过夜,TBST洗涤3次, 每次10 min,IgG-HRP标记的鼠抗兔二抗4 ℃摇床孵育2 h,TBST洗涤3次, 每次10 min,后增强化学发光(ECL)显影。利用ImageJ软件进行灰度值分析,用SIRT1、NF-κB p65、p-NF-κB p65、Caspase-3蛋白条带与GAPDH灰度值的比值计算各自的相对表达量,计算p-NF-κB p65与NF-κB p65相对表达量的比值。
1.2.4ELISA 将各组细胞在T25中培养至大约70%融合度时,用胰酶裂解后,离心收集细胞,PBS洗涤3次后超声裂解细胞,随后反复冻融使细胞涨破,随后4 ℃ 1500×g 离心10 min,收集上清,用ELISA法分别测量后进行分析,操作按试剂盒说明进行。
1.2.5双荧光素酶报告基因实验 将构建的SIRT1 3′UTR-WT(含SIRT1 3′UTR片段)和SIRT1 3′UTR-MUT(含SIRT1′UTR片段突变体)的荧光素酶报告载体,采用X-tremegene HP分别将SIRT1 3′UTR-WT和SIRT1 3′UTR-MUT与miR-9-5p mimic、miR-NC共转染,转染后培养48 h,按双荧光素酶报告基因检测试剂盒技术手册操作,记录萤火虫荧光素酶和海肾荧光素酶激发值,以两者的比值评价SIRT1基因的激活程度。
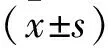
2 结果
2.1慢病毒转染情况 培养PANC-1细胞至融合度为50%左右,开始慢病毒转染,转染条件为MOI=10时,转染24 h后,绿色荧光开始表达,72 h绿色荧光表达最强,荧光显微镜下拍照,细胞表达较强的绿色荧光,细胞生长情况良好,如图1所示。
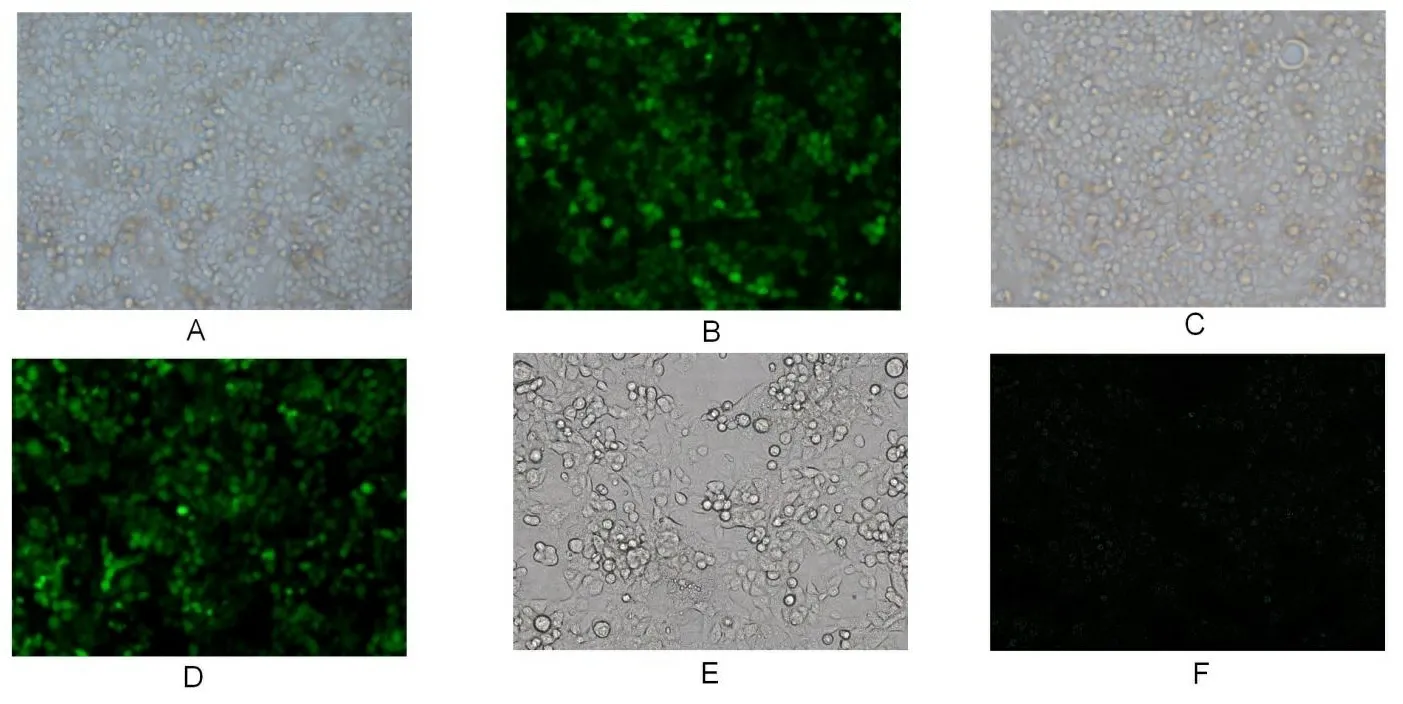
注:A、C、E分别为白光下mimic组、NC组和空白组的细胞形态;
2.2各组细胞miR-9-5p、SIRT1、Caspase-3 mRNA表达 qRT-PCR检测结果显示(见图2A~图2C),与空白组及NC组相比,mimic组miR-9-5p表达水平上调(P<0.01),SIRT1的表达水平下调(P<0.01),Caspase-3表达水平上调(P<0.01)。
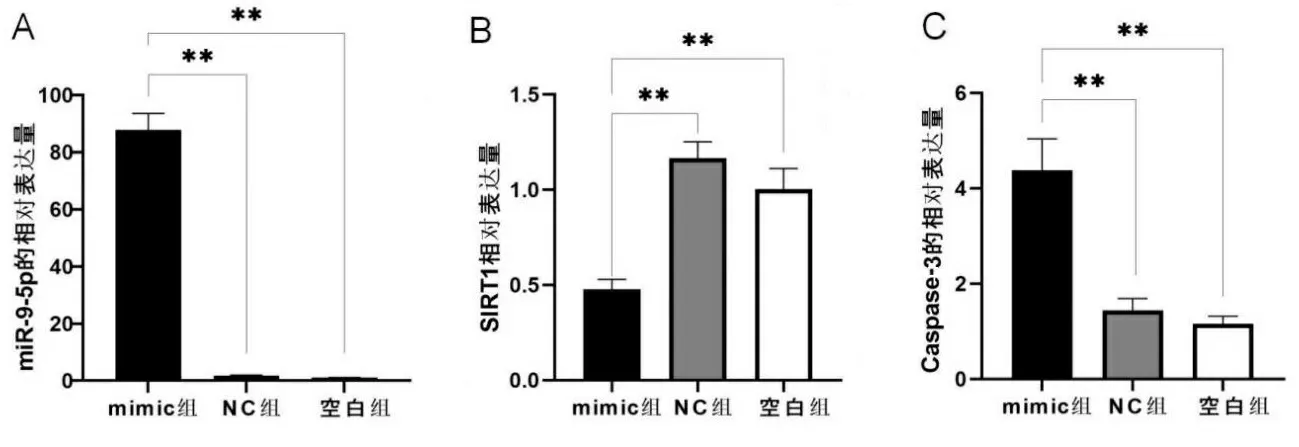
注:A.各组细胞miR-9-5p相对表达量;B.各组细胞SIRT1相对表达量;
2.3Western Blot法检测SIRT1、NF-κB通路相关蛋白、Caspase-3蛋白的表达 Western Blot 实验结果显示(见图3A~图3C),与空白组及NC组相比,mimic组SIRT1的蛋白表达量显著下调(P<0.01),p-NF-κB p65与NF-κB p65蛋白表达比值显著上调(P<0.01),Caspase-3蛋白表达量显著上调(P<0.01)。
2.4ELISA法检测各组细胞裂解液中SIRT1与Caspase-3蛋白的表达量 ELISA法检测细胞裂解液结果显示(见图4A、图4B),与空白组及NC组相比,mimic组SIRT1的蛋白表达量显著下调(P<0.05),Caspase-3蛋白表达量显著上调(P<0.01)。
2.5miR-9-5p、SIRT1、Caspase-3 mRNA表达水平相关性分析 使用Pearson相关分析对miR-9-5p、SIRT1、Caspase-3的mRNA表达水平进行相关性分析发现(见图5),miR-9-5p与SIRT1的表达水平呈负相关(r=-0.849,P<0.05);miR-9-5p与Caspase-3的表达水平呈正相关(r=0.796,P<0.05)。
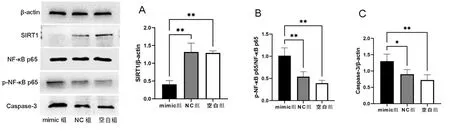
注:A.各组细胞SIRT1蛋白表达量;B.各组细胞p-NF-κB p65与NF-κB p65蛋白表达量
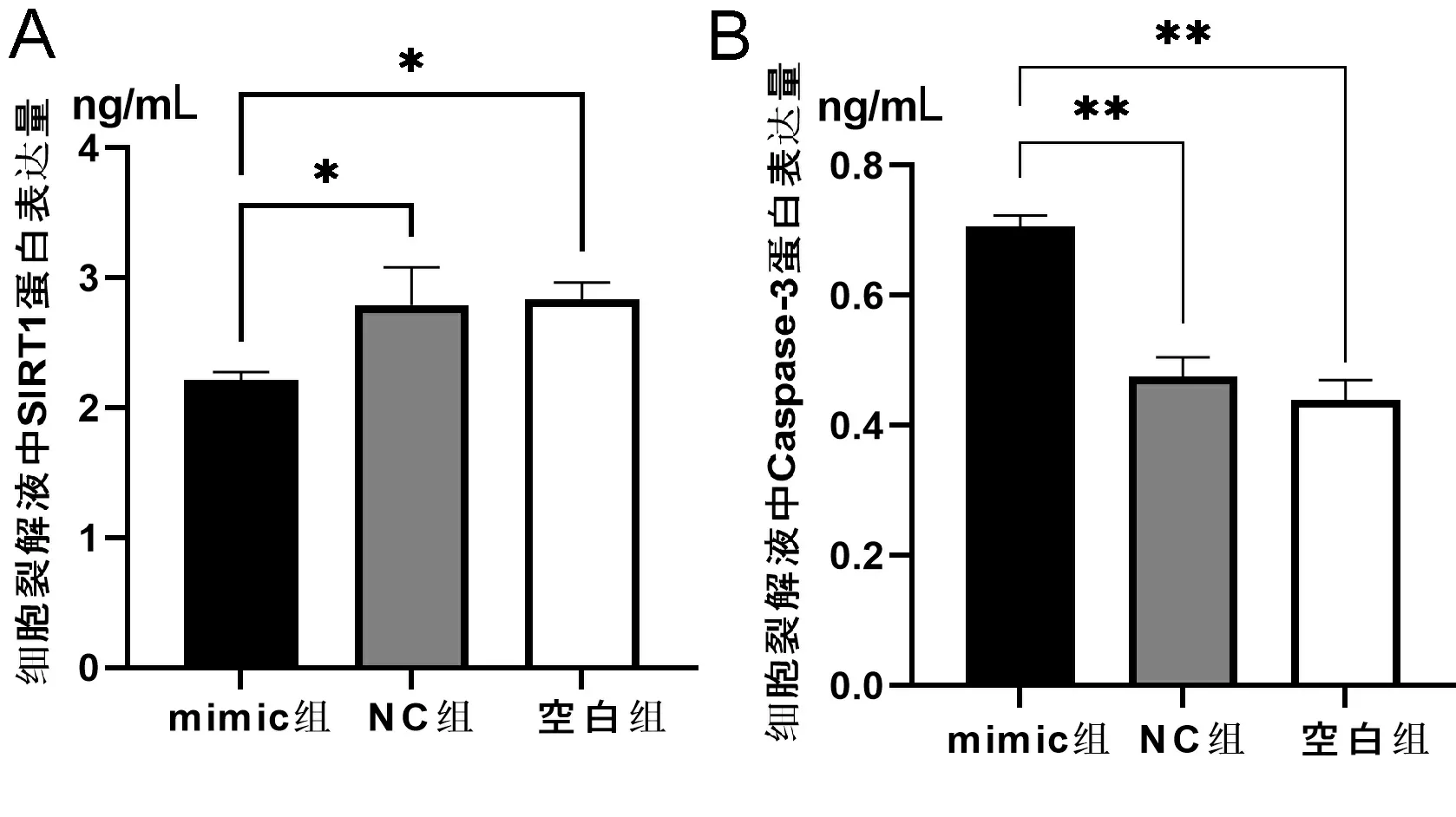
注:A.各组细胞裂解液中SIRT1蛋白表达量;
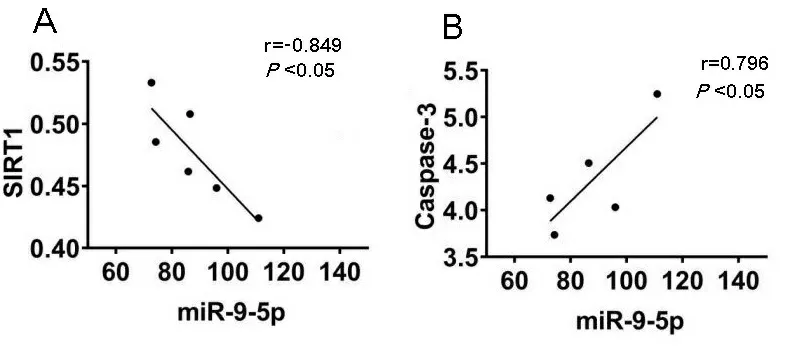
图5 miR-9-5p、SIRT1、Caspase-3
2.6miR-9-5p靶向SIRT1 在Target Scan Human数据库预测 miR-9-5p与SIRT1存在结合位点(见图6A),荧光素酶报告基因检测实验结果(见图6B)显示转染野生型SIRT1基因表达载体WT-SIRT1后,相较于miR-NC对照组, SIRT1过表达组AR42J细胞的荧光素酶活性显著降低(P<0.01);而转染突变型SIRT1基因表达载体MUT-SIRT1后,相较于miR-NC对照组,miR-9-5p过表达组AR42J细胞的荧光素酶活性差异不显著。可见,miR-9-5p可靶向调控SIRT1的表达。

注:A.SIRT1的3’UTR中含有与miR-9-5p互补的核
3 讨论
胰腺癌因早期诊断难度大,预后不良,成为近年来死亡率极高的恶性肿瘤之一。目前,有关于胰腺癌的相关机制仍然没有完全阐明。近年来许多研究发现,细胞凋亡机制在胰腺癌的发生发展及预后方面都具有非常重要的作用。研究表明,细胞凋亡过程在胰腺癌进程中被抑制[10],这是由于胰腺癌细胞的凋亡必须经过线粒体的增强作用,但调节线粒体内信号的Bcl-2蛋白失衡,使得信号转导偏向抗凋亡的方向。因此,如何诱导细胞凋亡成为一种新的胰腺癌治疗方向,并逐渐受到重视[11]。
凋亡是一种细胞内在的自杀程序,可能由内源性和外源性刺激触发。Caspase是在其活性中心含有半胱氨酸的蛋白酶,并且能够切割蛋白质,其中Caspase-3,6和7属于下游效应物,可以切割底物。基于Caspase在细胞死亡的执行阶段扮演重要的角色,将其称为细胞凋亡介质[4]。许多关于胰腺癌细胞凋亡机制的研究都以Caspase-3作为凋亡标志物,在凋亡增加的情况下其表达上调[12-14]。在本研究中,Caspase-3表达水平上调,与前人的研究一致。
SIRT1是一种NAD+依赖心脱乙酰酶,是sirtuins蛋白家族中的一员,作为一种核酶,SIRT1广泛存在于身体各器官的细胞中,因其对老化、自噬 、凋亡、炎症等调节的作用突出而受到学术界广泛关注,亦被称为“长寿蛋白”。SIRT1可以调控多种信号通路,如NF-κB、PGC1α、FoxOs等,而这些信号通路通常出现在与衰老相关的机制研究当中[5]。SIRT1抑制凋亡的作用可以导致Caspase-3的分裂[6],ZHAO G等[15]通过对比胰腺癌细胞与癌旁细胞标本发现SIRT1在癌细胞中过表达,敲低SIRT1后,细胞凋亡增加。同样的,在ZHAO G等[16]的研究中,过表达SIRT1可以逆转多个胰腺癌细胞系的细胞衰老与凋亡趋势。上述研究说明SIRT1有抑制细胞凋亡的作用。在本研究中,mimic组的SIRT1表达降低,同时Caspase-3表达上升,说明下调SIRT1表达可能使凋亡增加,这与前人的研究结果一致。
miRNA-9(miR-9)是一类广泛存在于生物体内的非编码RNA。现有的对miR-9的研究认为,miR-9在多种细胞中均可发挥多重功能。在肾上腺细胞中,重金属污染物诱导miR-9-5p上调,将会通过PI3K/AKP途径引起肾上腺细胞凋亡继而导致组织损伤[17]。miR-9对癌症发生发展的作用因其组织细胞的来源而异。在大部分癌症细胞中,miR-9均呈低表达,并呈现一定的抑癌作用[18-19]。CHEN X R等[20]通过体内和体外实验证实,在神经胶质瘤细胞中,miR-9-5p可以通过促进癌症细胞凋亡,增加其对抗癌药物替莫唑胺的敏感性。在胰腺癌中,miR-9-5p低表达并被证实可以靶向GOT1抑制胰腺癌细胞的侵袭、增殖和谷氨酰胺代谢[21]。在本研究中,与空白组相比,mimic组在miR-9-5p上调的情况下,表现出细胞凋亡相关基因Caspase-3表达增加,这表示miR-9-5p诱导细胞凋亡的作用可能在胰腺癌细胞中发生。
在胰腺癌细胞凋亡的过程中,NF-κB通路发挥了十分重要的作用。NF-κB通路的激活通常分为两种通路:规范通路也称为经典通路,反应迅速且可逆,IκB被磷酸化从而失活,p50/p65二聚体与IκBα分离,穿过核膜进入细胞核,并与DNA结合[22]。另一种途径称为非规范通路或替代通路,其依赖于IKKα二聚体激活p52与RelB,与经典通路相比激活缓慢,且持续时间较长[23]。在大多数胰腺癌患者中,组成NF-κB的RalA被激活,可以调控癌细胞的侵袭、生长、增殖、化学抗性等[5,24-25],而SIRT1作为一种去乙酰酶,可以靶向作用于NF-κB蛋白,从而抑制其下游通路活性,诱发细胞凋亡[26]。在本研究中,与空白组及NC组相比,mimic组的p-NF-κB p65蛋白与NF-κB p65蛋白比值明显升高,提示通路被激活,同时凋亡相关基因Caspase-3表达增加,这与前人的研究一致。
目前,关于胰腺癌细胞凋亡的具体调控机制尚不清楚,miR-9-5p是否靶向SIRT1,调控NF-κB通路影响胰腺癌细胞凋亡,少见相关文献报道。本研究通过生物信息分析发现miR-9-5p与SIRT1之间存在靶向结合位点,并通过文献查阅发现,miR-9-5p通过靶向SIRT1诱导细胞凋亡的过程在帕金森病中已经被证实[27],SIRT1靶向NF-κB通路引发细胞凋亡的过程亦在大鼠神经细胞里得到了佐证[28]。本研究通过进一步荧光素酶报告实验发现,miR-9-5p与SIRT1确实存在靶向关系。由此,本研究推断在胰腺癌细胞中,miR-9-5p靶向SIRT1/NF-κB这一通路可以调控Caspase-3的表达。为证实这一推测,本研究通过慢病毒转染建立miR-9-5p过表达PANC-1细胞,探讨这几项指标之间的相互关系。结果证实,mimic组miR-9-5p过表达的同时,SIRT1 mRNA及蛋白低表达,p-NF-κB p65蛋白与NF-κB p65蛋白比值明显升高,Caspase-3 mRNA及蛋白升高,提示这几者之间存在潜在关系。为明确miR-9-5p与SIRT1及凋亡相关基因Caspase-3表达的相互关系,我们进一步进行了Pearson相关分析,结果显示miR-9-5p与SIRT1表达呈负相关;miR-9-5p与Caspase-3表达呈正相关。
综上,胰腺癌的发生发展过程与癌细胞的凋亡有关,SIRT1作为去乙酰酶参与调控了胰腺癌细胞凋亡过程,且受到miR-9-5p的负调控。过表达miR-9-5p可能靶向SIRT1/NF-κB通路, 促进凋亡标志物Caspase-3的表达,这将为胰腺癌的诊断与治疗提供新的思路。

