注意缺陷多动障碍儿童外周血NOS1、NO表达水平及临床意义
王菊红,黎鹏
1.宝鸡市妇幼保健院儿童免疫内分泌科,陕西 宝鸡 721000;2.宝鸡市中医医院儿科,陕西 宝鸡 721000
注意缺陷多动障碍(attention deficit hyperactivity disorder,ADHD)是学龄期儿童表现为注意力不集中、多动和行为冲动的一种精神和神经发育障碍性疾病[1]。ADHD 的发病原因较为复杂,主要影响因素是环境、遗传等[2]。据报道,ADHD 在美国儿童中的发病率为3%~5%,在日本儿童中约占4%[3];据李世明等[4]统计ADHD 位居中国儿童精神科和儿童保健科门诊病例前三位,发病率为5.6%。ADHD在学龄期儿童中会造成上课学习不专心、运动不稳定、易怒冲动,青少年期直至成年主要表现为注意力不集中,其他症状随着年龄增长而逐渐减弱[5]。目前,临床上对ADHD 患儿主要使用哌甲酯等药物治疗,但伴随着烦躁、食欲下降等不良反应发生,对患儿生活产生影响[6]。因此,寻找新的治疗靶点对ADHD具有重要的意义。一氧化氮合酶1(nitric oxide synthase 1,NOS1)又称为神经型一氧化氮合酶,是一氧化氮合酶(nitric oxide synthase,NOS)的一种亚型,其主要分布在神经元和内皮细胞中,并催化产生一氧化氮,具有调控神经递质传递、突触形成等作用[7]。一氧化氮(nitric oxide,NO)是一种存在于人体细胞的小分子物质,主要产生于脑细胞、肌肉细胞、内皮细胞,具有调节免疫反应、增强血小板聚合、血管扩张等功能[8]。研究发现,NOS1 异常活化会导致NO 过量产生,从而造成下游细胞凋亡信号被激活,导致脑部神经元及部分功能受损[9]。因此,本研究通过检测ADHD患儿外周血NOS1、NO水平,分析两者与疾病发生发展的相关性,以期为临床防治ADHD提供参考依据。
1 资料与方法
1.1 一般资料 选取2019 年4 月至2021 年4 月宝鸡市妇幼保健院和宝鸡市中医医院确诊为ADHD患儿93 例为研究组。纳入标准:(1)均按照《美国精神障碍诊断手册》(第5 版)中ADHD诊断标准[10];(2)初次诊断为ADHD,并未接受治疗;(3)患儿临床资料完整,且家属知情并自愿参加本研究。排除标准:(1)合并智力、精神障碍者;(2)合并营养性或消化道、呼吸道疾病者;(3)年龄小于6岁或大于18岁。同期选取在本院体检的健康儿童122例为对照组。本研究获得两家医院的伦理委员会批准。
1.2 研究方法
1.2.1 一般资料收集 收集两组受检儿童的年龄、性别、体质量指数(BMI)、胎儿宫内窘迫、产程延长、儿童孤独及父母经常吵架等情况。
1.2.2 样本采集及保存 采集ADHD 患儿入院后24 h内清晨空腹肘静脉血5 mL,对照组于体检当天清晨采集空腹肘静脉血5 mL,收集于EDTA 抗凝管内,分离血浆,保存备用。
1.2.3 外周血NOS1、NO水平检测 采用酶标分析仪(HBS-1096C,南京德铁实验设备有限公司)检测NOS1、NO水平,实验操作均按说明书由专业技术人员严格进行。人NOS1 酶联免疫吸附法(enzyme-linked immunosorbent assay,ELISA)试剂盒购于上海泽叶生物科技有限公司,货号:H-EL-NOS1/nNOS;人NO ELISA 试剂盒购于上海广锐生物科技有限公司,货号:20191215。
1.3 分组标准 93 例ADHD 患儿根据临床反应情况分为注意力缺陷为主型(predominantly inattentive type,PIT)组34 例,多动-冲动为主型(predominantly hyperactivity-impulse type,HIT)组19 例,混合型(combined type,CT)组40例。
1.4 观察指标 比较对照组和研究组受检者的一般资料及外周血NOS1、NO 水平;比较三种分型ADHD患儿外周血NOS1、NO水平;分析外周血NOS1与NO水平的相关性。
1.5 统计学方法 应用SPSS25.0统计学软件分析全文数据。计量资料均呈正态分布且方差齐,以均数±标准差(±s)表示,两组间比较采用独立样本t检验;三组数据比较采用单因素方差分析,进一步两两比较采用LSD-t 检验;计数资料两组间比较采用χ2检验;采用Pearson 相关性分析ADHD 患儿外周血NOS1 水平与NO水平的相关性;采用多因素Logistic回归分析ADHD发生的影响因素。以P<0.05为差异有统计学意义。
2 结果
2.1 研究组和对照组受检者的一般资料比较 研究组患儿的胎儿宫内窘迫、产程延长、儿童孤独、父母经常吵架比例明显高于对照组,差异均有统计学意义(P<0.05);而两组受检者的年龄、男/女比例、BMI 比较差异均无统计学意义(P>0.05),见表1。
表1 研究组和对照组受检者的一般资料比较[±s,例(%)]Table 1 Comparison on the general data of subjects between the study group and the control group[±s,n(%)]

表1 研究组和对照组受检者的一般资料比较[±s,例(%)]Table 1 Comparison on the general data of subjects between the study group and the control group[±s,n(%)]
临床指标年龄(岁)男/女BMI(kg/m2)胎儿宫内窘迫(是/否)产程延长(是/否)儿童孤独(是/否)父母经常吵架(是/否)对照组(n=122)8.95±2.72 67(54.92)/55(45.08)19.12±3.67 10(8.20)/112(91.80)8(6.56)/114(93.44)5(4.10)/117(95.90)12(9.84)/110(90.16)研究组(n=93)9.04±2.94 50(53.76)/43(46.24)18.93±3.81 44(47.31)/49(52.69)30(32.26)/63(67.74)24(25.81)/69(74.19)20(21.51)/73(78.49)t/χ2值0.232 0.028 0.370 42.929 23.956 21.311 5.672 P值0.817 0.866 0.712 0.000 0.000 0.000 0.017
2.2 研究组和对照组受检者的外周血NOS1、NO水平比较 研究组患儿的外周血NOS1、NO水平明显高于对照组,差异均有统计学意义(P<0.05),见表2。
表2 研究组和对照组受检者的外周血NOS1、NO水平比较(±s)Table 2 Comparison on the peripheral blood NOS1 and NO levels of subjects between the control group and the study group(±s)
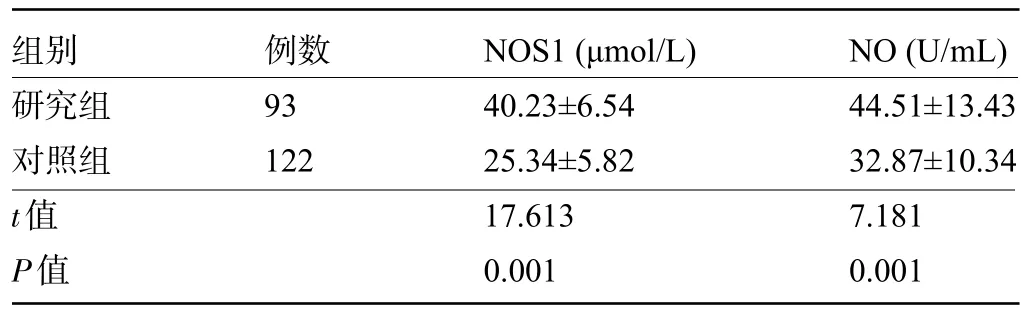
表2 研究组和对照组受检者的外周血NOS1、NO水平比较(±s)Table 2 Comparison on the peripheral blood NOS1 and NO levels of subjects between the control group and the study group(±s)
组别研究组对照组t值P值例数93 122 NOS1(μmol/L)40.23±6.54 25.34±5.82 17.613 0.001 NO(U/mL)44.51±13.43 32.87±10.34 7.181 0.001
2.3 三种分型ADHD 患儿外周血NOS1、NO 水平比较 CT 组和HIT 组ADHD患儿的外周血NOS1、NO 水平明显高于PIT 组,CT 组ADHD 患儿的外周血NOS1、NO 水平明显高于HIT 组,差异均有统计学意义(P<0.05),见表3。
表3 三种分型ADHD患儿外周血NOS1、NO水平比较(±s)Table 3 Comparison on NOS1 and NO levels in peripheral blood among children with ADHD of three types(±s)

表3 三种分型ADHD患儿外周血NOS1、NO水平比较(±s)Table 3 Comparison on NOS1 and NO levels in peripheral blood among children with ADHD of three types(±s)
注:与PIT组比较,aP<0.05;与HIT组比较,bP<0.05。Note: Compared with PIT group,aP<0.05; Compared with HIT group,bP<0.05.
组别PIT组HIT组CT组F值P值例数34 19 40 NOS1(μmol/L)30.23±6.12 36.42±6.52a 44.19±7.03ab 41.344 0.001 NO(U/mL)35.48±10.96 42.31±12.04a 49.84±12.39ab 13.625 0.001
2.4 ADHD患儿外周血NOS1与NO水平的相关性 经Pearson相关性分析结果显示,ADHD患儿外周血NOS1水平与NO水平呈正相关(r=0.399,P=0.000),见图1。

图1 ADHD患儿外周血NOS1与NO水平相关性分析的散点图Figure 1 Scatter chart of correlation analysis of NOS1 and NO levels in peripheral blood of children with ADHD
2.5 影响ADHD 发生的危险因素 以是否发生ADHD为因变量(未发生=0、发生=1),将赋值后的自变量胎儿宫内窘迫、产程延长、儿童孤独、父母经常吵架、NOS1、NO 纳入多因素Logistic 回归分析模型,结果显示胎儿宫内窘迫、产程延长、儿童孤独、父母经常吵架、NOS1、NO 是影响ADHD 发生的危险因素(P<0.05),见表4。

表4 影响ADHD发生的多因素Logistic回归分析Table 4 Multivariate Logistic regression analysis of the factors affecting the occurrence of ADHD
3 讨论
ADHD 又称脑功能轻微失调综合征或儿童多动症,主要特征表现为多动、注意缺陷、冲动等[11]。近年来,ADHD的患病率逐年增加。目前对于ADHD的具体发病机制尚不太明确,一般研究认为其与心理、社会、生物等多种因素密切相关[12]。据影像学技术显示,ADHD患儿的小脑体积和前额皮层呈现缩小状态,且活动能力明显减弱。研究发现,ADHD患儿去甲肾上腺素和多巴胺等一些神经递质表达异常,基因也会影响ADHD的发生率[13]。据报道,全球ADHD的儿童患病率为8%~12%,半数以上的ADHD患儿疾病症状会持续到成年[14]。该病不仅影响学龄期儿童的智力发展,而且对成年甚至终身的社会生活活动产生严重的影响。因此,对ADHD进行早期诊断和及时治疗对儿童有关键性的影响。
ADHD的致病病理主要是脑功能障碍或神经发育异常,NOS1 和NO 分布于神经元及脑细胞中,因此对中枢神经系统发育过程具有重要调控作用。NOS在体内主要分为三种亚型,NOS1、诱导型一氧化氮合酶和内皮型一氧化氮合酶,其中NOS1广泛存在于大脑的海马、前额叶、皮质、下丘脑等部位[15]。王淑静等[16]在动物试验中发现,NOS1在患有局灶性脑缺血的大鼠体内含量升高,原因在于局灶性脑缺血造成大鼠前额叶皮质区神经元损伤,导致机体应激水平提高。本研究中,研究组患儿外周血NOS1水平明显高于对照组,其中CT组和HIT组患儿外周血NOS1水平明显高于PIT组,CT组患儿外周血NOS1水平明显高于HIT组,提示NOS1可能与ADHD疾病的发生发展有相关性,推测,高水平NOS1 可能通过触发有关信号通路,进而继发机体应激水平,从而在ADHD 发病过程中发挥促进作用,但其具体机制有待进一步研究证实。
NO 在神经元中担任信使和递质样的角色,具有调节脑血流量、保护神经元、扩张血管、抑制血小板聚集的功能[17]。研究发现,可通过NOS 间接反映NO 在组织细胞中的分布。然而,当NO 表达过量时,会导致大量羟基及二氧化氮自由基被激活,进而引发蛋白质、核酸等受损,同时对神经元产生毒性[18]。李浩源等[19]研究得出,血清NO 水平表达异常可对动脉血压产生影响,继而增加脑出血的风险。张彦博等[20]在轻度胃肠炎伴婴幼儿良性惊厥患儿中发现,导致患儿发生惊厥的原因可能在于血清NO水平及NOS活力的升高。何桂媛等[21]论述miR-146在支气管哮喘过程中的作用得出,miR-146 基因可调控诱导型NOS1,导致其表达下调,NO产量随之下降。本研究显示,研究组患儿外周血NO水平明显高于对照组,CT 组和HIT组患儿外周血NO 水平明显高于PIT 组,CT 组患儿外周血NO 水平明显高于HIT 组,提示外周血NO 可能与ADHD的发生发展有关,究其原因,NO水平升高可能通过影响神经系统进而参与ADHD病情发展过程,但有待进一步证实NO以何种形式发挥作用。
本研究中ADHD 患儿外周血NOS1 与NO 水平呈正相关,提示NOS1 可能与NO相互作用,进而共同影响ADHD 病理过程,但相互作用机制有待深入探讨。本研究发现,胎儿宫内窘迫、产程延长、儿童孤独、父母经常吵架、NOS1、NO 是影响ADHD 发生的危险因素,提示胎儿宫内窘迫、产程延长、儿童孤独、父母经常吵架的发生,外周血NOS1、NO 水平升高均可能会增加ADHD 的发生风险。张平等[22]在对ADHD 相关危险因素探讨中发现,胎儿宫内窘迫、产程延长、父母管教环境及家庭关系是否和睦是影响ADHD 发生的危险因素。本研究中ADHD 发生的影响因素与张平等[22]研究结果部分一致。因此,及时关注产妇状况、注重儿童生长环境,并监控外周血NOS1、NO 水平有利于判定是否发生ADHD。
综上所述,ADHD 患儿外周血NOS1、NO 水平表达上调,两者可能相互影响,从而协同影响ADHD 发生及病情发展过程,检测外周血NOS1、NO 水平有助于临床及时预测发生ADHD的儿童,以便采取措施干预。但NOS1、NO影响ADHD患儿的具体机制尚未探究清楚,后期将增加样本量进行多方面探讨。

