Penicilazaphilone C抑制NETosis诱导哮喘炎症的机制研究
黄俊敏,王才春
海南医学院第一附属医院呼吸内科,海南 海口 571199
哮喘是一类常见的慢性呼吸道疾病,全球约有3.34 亿哮喘患者[1]。中性粒细胞胞外诱捕网(neutrophil extracellular traps,NETs)是中性粒细胞衍生的胞外支架,由颗粒蛋白装饰的解聚染色质组成。NETs不仅有抗感染的作用,而且对非感染性疾病也有重要影响[2]。Toussaint 等[3]发现NETs 释放的DNA 促进鼻病毒诱导的过敏性哮喘的恶化。Pham等[4]指出NETs通过损伤气道的上皮细胞,从而导致多种细胞(包括中性粒细胞、肥大细胞等)参与炎症的发生,加快哮喘的进展。多数研究表明NETs与哮喘的炎症进程相关。但针对NETosis 诱发哮喘的详细机制及治疗研究较少。Penicilazaphilone C 是从中国海南省海口市海岸的腐烂树叶中生长的真菌Penicillium sclerotiorum分离并进行结构鉴定为新的嗜氮酮类化合物。由于该类化合物的基本结构和文献报道的Penicilazaphilone A 和B相 同[5-6],故 将 其 命 名 为Penicilazaphilone C (PAC)。PAC 对金黄色葡萄球菌、铜绿假单胞菌、肺炎克雷伯菌等细菌有较强的抑制作用[7]。PAC具有很多生物活性,包括抗细菌、抗真菌、抗病毒、抗炎、抗氧化、细胞毒作用等[8]。在目前的国内外文献中,针对PAC 的研究为数不多。本研究在PAC 抗氧化及抗炎作用的基础上推测PAC 通过抑制中性粒细胞胞外诱捕网形成(NETosis)的产生来达到其预防或治疗哮喘的作用。
1 材料与方法
1.1 材料 Penicilazaphilone C 由本课题研究团队提供,化学结构见图1。BCA蛋白定量检测试剂盒、脂多糖、DNase Ⅰ均购自Servicebio (货号分别为:G2026-200T、G5032-10MG、G3342-200U)。ELISA试剂盒、Triton X-100、DAPI均购自Sigma(货号分别为:RAB0263-1KT、T8787-50ML、D9542-1MG)。
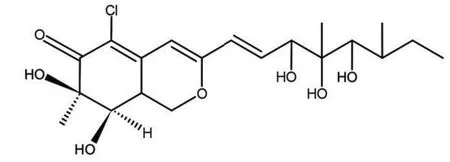
图1 Penicilazaphilone C的化学结构Figure 1 Chemical structure of Penicilazaphilone C
1.2 实验方法
1.2.1 小鼠体外诱导NETs 所有实验均严格按照申请内容进行。实验所用的30 只6~8 周龄健康雄性BALB/c 小鼠从广州市赛柏诺生物科技公司购买,提前送到海南医学院实验室进行饲养。取健康小鼠新鲜外周血,用10 nmol/L 的PMA 刺激中性粒细胞。4%甲醛固定细胞,0.1% Triton X-100 通透,再用5%BSA 阻断1 h,细胞与抗髓过氧化物酶(Myeloperoxidase,MPO)抗体孵育,接着与Alexa Fluor 488 标记的山羊抗兔抗体孵育。对中性粒细胞培养上清液中的双链DNA(dsDNA)的水平进行定量,用酶标仪来测定dsDNA 的荧光强度。PAC 由本课题研究团队提供。设置四组PAC 的不同剂量组(0.3 mg/mL、0.6 mg/mL、0.9 mg/mL、1.2 mg/mL),了解抑制效果,最终确定最佳有效剂量,以便进行下一步的体内实验。
1.2.2 哮喘小鼠模型的建立 小鼠适应性喂养1 周后,根据相关研究方案[9-10]建立LPS诱导的小鼠哮喘模型(图2),采用LPS腹腔注射和雾化吸入的方法建立小鼠哮喘模型。把30只雄性小鼠依照数字表随机分成五组,每组6只,即对照组、哮喘组、地塞米松组、DNase I组及PAC 组。用1 mg/mL 的LPS 与氢氧化铝[Al(OH)3]凝胶制成混合溶液。除对照组外其他4 组在第1 天、第7 天用其腹腔注射致敏小鼠。第14~21 天,持续7 d以1 mg/mL 的LPS 气雾剂雾化激发哮喘,30 min/d。对照组在致敏及激发阶段用0.9%NaCl 溶液雾化。对于DNase Ⅰ组,雾化激发暴露前和雾化后8 h 分别雾化吸入DNase Ⅰ溶液(120 U DNase I 溶于5 mL 0.9%NaCl溶液)30 min。第21~48天,对照组和哮喘组的小鼠只接受腹腔注射0.9%NaCl溶液。在致敏及致激后,地塞米松组小鼠在第21~48 天连续4 周予2 mg/kg 地塞米松灌胃。PAC 组小鼠按照PAC 的有效剂量进行灌胃。造模结束24 h后统一处理小鼠。

图2 LPS诱导小鼠哮喘模型实验流程图Figure 2 Flow chart of mouse asthma model induced by LPS
1.2.3 Western blotting 肺组织块用磷酸盐缓冲液(PBS)冲洗,清洗后将肺组织分成小块进行匀浆。裂解后收集上清。取蛋白溶液,用BCA 蛋白浓度测定试剂盒测蛋白浓度,上样、电泳。用SDS-PAGE 分离细胞总蛋白提取物,并转移到PVDF膜上,加上脱脂牛奶封闭30 min,加入配置好的一抗,4℃孵育摇床过夜。回收一抗,洗膜后加入TBST 快速洗脱,将二抗用TBST 按照1∶5 000 的比例进行稀释,室温下孵育30 min 后洗脱。依照说明书对CitH3 及组蛋白进行化学修饰,并使用修饰的抗CitH3抗体和抗组蛋白抗体进行检测。
1.2.4 组织学 肺组织用10%甲醛溶液固定,石蜡包埋切片,进行HE染色、PAS染色及免疫荧光。HE和PAS染色在显微镜下观察上皮细胞、炎性细胞的浸润及黏液分泌等,并使用先前研究描述的方法对支气管以及血管周围的病变程度进行评分[10]。观察到的每个支气管评分从0 到4 分,总共评分10 个区域。评分标准:0分,没有细胞浸润;1分,有少许细胞浸润;2分,有1 层细胞浸润;3 分,有2至4 层细胞浸润;4 分,有大量细胞(超过4 层细胞)浸润。肺组织的整体炎症表现以支气管周围和血管周围炎症评分的平均数来表示。肺组织切片同时进行MPO 和瓜氨酸化组蛋白H3(citrullination of histone H3,CitH3)等NETs 标志物染色。进行抗原修复及封闭。玻片上依次放入一抗及二抗,室温孵育50 min。加DAB 显色液,苏木素复染细胞核。使用共聚焦显微镜从每个切片中随机选择5个区域,使用荧光显微镜进行成像。
1.2.5 支气管肺泡灌洗液 对BALF当中的相关炎性细胞及细胞因子进行检测。麻醉小鼠后,气管插管后用PBS 冲洗肺组织3 次来获取BALF。BALF 在4℃下离心,上清液分离,在-80℃下保存。采用ELISA 检测白细胞介素-4 (IL-4)、白细胞介素-6(IL-6)、白细胞介素-17 (IL-17)和肿瘤坏死因子-α(TNF-α)。将BALF 离心沉淀,重悬于PBS 中,细胞计数器测定总细胞数。对于细胞比例测量,细胞悬液移至薄片机的收集孔中,并通过离心将细胞移到玻片上进行Wright/Giemsa染色。根据细胞大小、形态和细胞核形态鉴定各类细胞,计算嗜酸性粒细胞、巨噬细胞、中性粒细胞在BALF中的数量。
1.2.6 NETs 各组小鼠腹主动脉采血,细胞悬液加入24 孔板中,并刺激3 h 以鉴定NETs 结构。4%多聚甲醛固定,0.5% TritonX-100 通透,室温下在5%BSA内封闭。加入一抗混合物(小鼠抗MPO抗体),加入二抗混合物(兔抗CitH3 抗体),在室温下孵育。DNA 用DAPI 染色。用Fisher Science 的抗褪色荧光贴装介质清洗并贴装玻片。用荧光显微镜观察图像。为了检测肺组织中产生的NETs,使用抗MPO 和抗组蛋白H3抗体开展免疫荧光染色。组织放置在含有甲醛的PBS 中,石蜡包埋。将切片进行脱蜡和再水化。进行抗原修复及封闭。切片依次与兔抗MPO抗体和小鼠抗组蛋白H3 抗体一同孵育。洗涤后将样品与可识别CitH3 (驴抗小鼠IgG)和MPO 的二抗一同孵育(驴抗兔IgG)。切片及DAPI 溶液在室温下孵育20 min,拿抗荧光衰减封片试剂来封片。用载玻片扫描仪获得免疫荧光图像。
1.2.7 NETs 的定量 在体外实验中,PMA 刺激中性粒细胞4 h后,收集底层离心,收集富含dsDNA的上清液。将上清液离心,丢弃上清液,再用PBS 重悬颗粒。用SYTOX 绿板阅读器分析NETosis。NETs 的重要成分是释放到细胞外空间的dsDNA。PicoGreen试剂盒可以特异性地测量细胞外dsDNA,以准确反映NETs的生成。从BALF上清液中提取的dsDNA进行定量。将细胞悬液移入96 孔板中并孵育,加入QuantiT Picogreen试剂。用荧光分光光度计检测dsDNA的荧光强度(激发波长:480 nm,发射波长:520 nm),得到标准曲线,y=0.1 578x-0.5676,R2=0.9 987(y是DNA浓度,单位为ng/mL,x是荧光值)。将荧光值放入公式中,得到样品的DNA浓度,从而对NETs进行定量。
1.3 统计学方法 应用GraphPad Prism 8.0 软件对实验数据进行分析。计量资料呈正态分布,以均数±标准差(±s)表示,组间两两比较采用独立样本t检验,多组间比较采用单因素方差分析。以P<0.05为差异有统计学意义。
2 结果
2.1 PAC体外抑制NETosis 为了研究PAC是否在体外抑制PMA刺激的NETosis的形成,通过测定健康小鼠外周血中分离的中性粒细胞外DNA含量来实现(图3A)。数据结果显示,对照组所测得的dsDNA相对荧光单位为(1.43±0.47)RFU,随着PAC剂量的增加,抑制作用也在加强。在0.3 mg/mL、0.6 mg/mL、0.9 mg/mL、1.2 mg/mL 的剂量下dsDNA 相对荧光单位分别为(0.72±0.17) RFU、(0.35±0.09) RFU、(0.16±0.02) RFU、(0.11±0.03) RFU,差异具有统计学意义(P<0.05)。在1.2 mg/mL 的PAC 处理之后dsDNA显著降低,表明在体外一定浓度下PAC可以有效抑制NETosis。
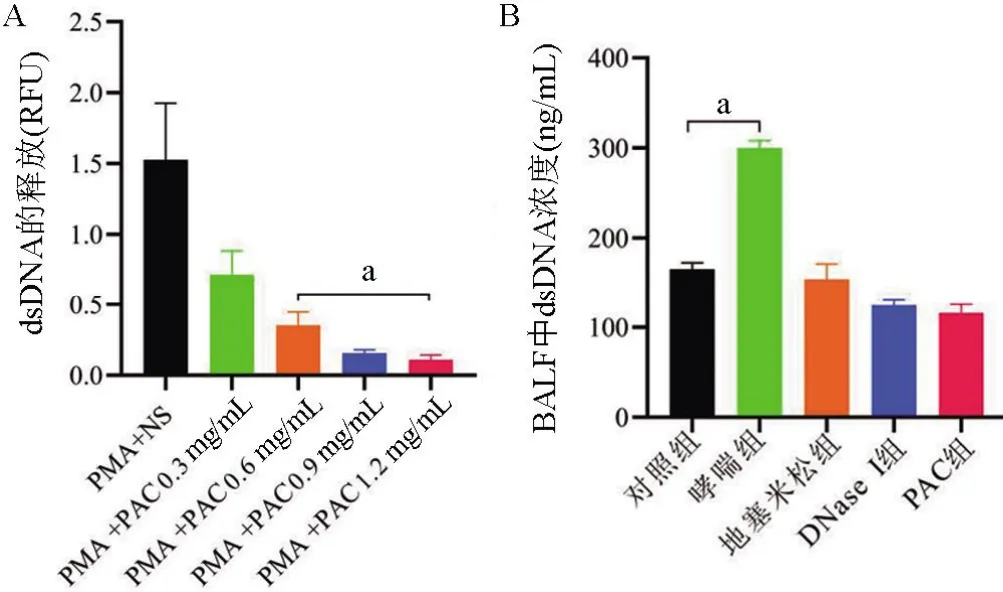
图3 小鼠体内和体外dsDNA的变化情况Figure 3 The changes of dsDNA in vivo and in vitro in mice
2.2 哮喘小鼠体内存在NETs 为了确认本次实验建立的哮喘小鼠模型中的NETs 的形成,主要通过检测NETs 及其标志物(CitH3、MPO 和dsDNA)来实现。首先检测BALF 中的dsDNA (图3B),哮喘组dsDNA水平为(300.00±8.27)ng/mL,对照组为(165.40±6.99) ng/mL,差异有统计学意义(P<0.05)。哮喘组dsDNA 水平较对照组明显增高。CitH3 是NETosis 的重要标志物之一,Western blotting检测肺组织CitH3的表达(图4A)。与对照组相比,哮喘组的CitH3 呈高表达状态。在PAC 或DNaseI 处理后CitH3 表达明显减弱。图4B 中,与对照组相比,哮喘组小鼠肺组织中CitH3、MPO 及其共定位明显。DNase Ⅰ组和PAC 组小鼠肺组织中的共定位较哮喘组减少。
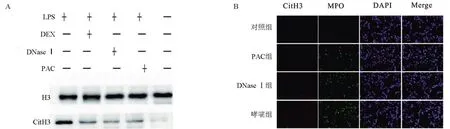
图4 小鼠肺组织变化情况Figure 4 Changes of lung tissue in mice
2.3 各组小鼠BALF 中的炎症反应 为了研究哮喘小鼠炎症浸润情况,对各组小鼠BALF 中的炎症细胞和细胞因子进行了检测(图5、图6)。哮喘组小鼠BALF 中有大量炎症细胞浸润,其中中性粒细胞所占比例大(约62%)。哮喘组小鼠BALF 中IL-4、IL-6、IL-17和TNF-α水平分别为(18.91±2.79)pg/mL、(57.09±1.70) pg/mL、(79.93±1.99) pg/mL、(31.43±3.11) pg/mL,其中IL-17显著增加,差异有统计学意义(P<0.05)。
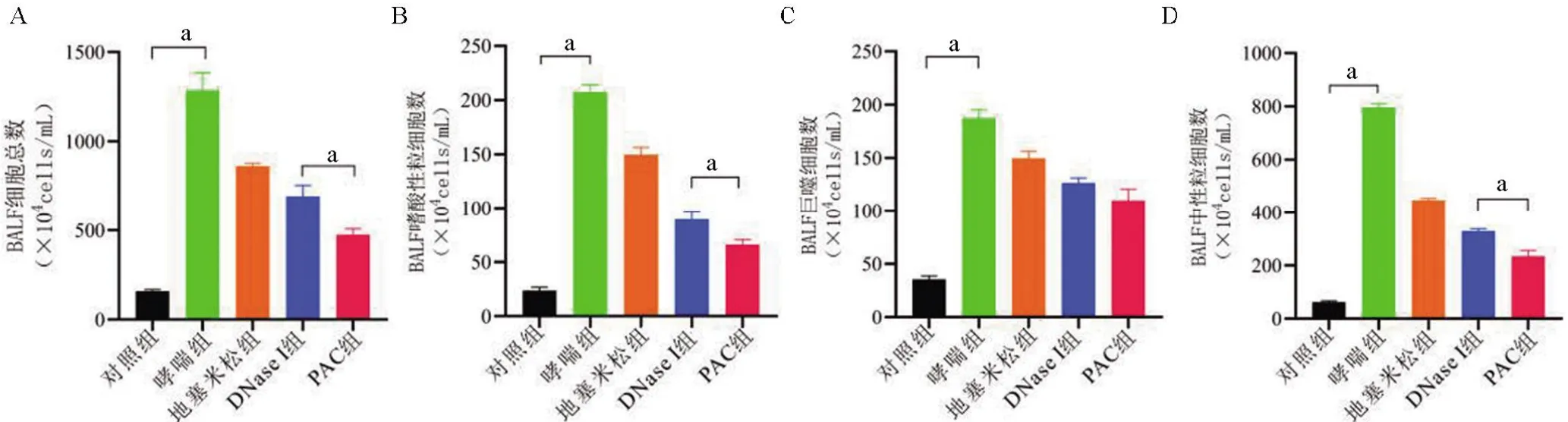
图5 细胞计数器检测各组小鼠BALF中各类细胞的数量Figure 5 The number of each type of cellin BALF of each group was detected by cell counter
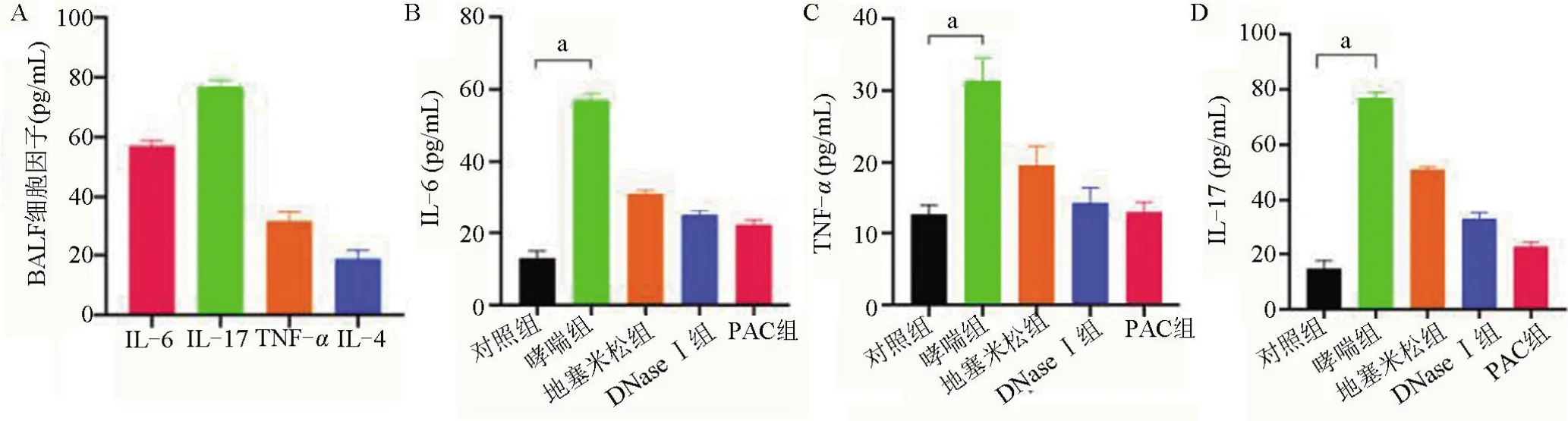
图6 小鼠体内细胞因子变化情况Figure 6 Changes of cytokines in mice
2.4 各组小鼠肺组织的改变 为了评估NETosis诱导的哮喘小鼠肺组织损伤程度,采用HE 染色和组织学评分(图7A、7C)评价肺组织气管和血管周围病变情况。哮喘组肺组织可见显著的白细胞浸润,炎症评分(3.17±0.75)分,提示存在多层炎性细胞浸润,上皮细胞严重受损脱落。与哮喘组小鼠相比,DNase Ⅰ组和PAC 组的肺炎症程度弱。PAC 组比DNase I组治疗效果更显著。PAS 染色观察哮喘组肺组织大量黏液渗出,还发现了增多的杯状细胞及胶原沉积(图7B)。PAC 组肺组织显示支气管周围的胶原沉积及杯状细胞显著减少。
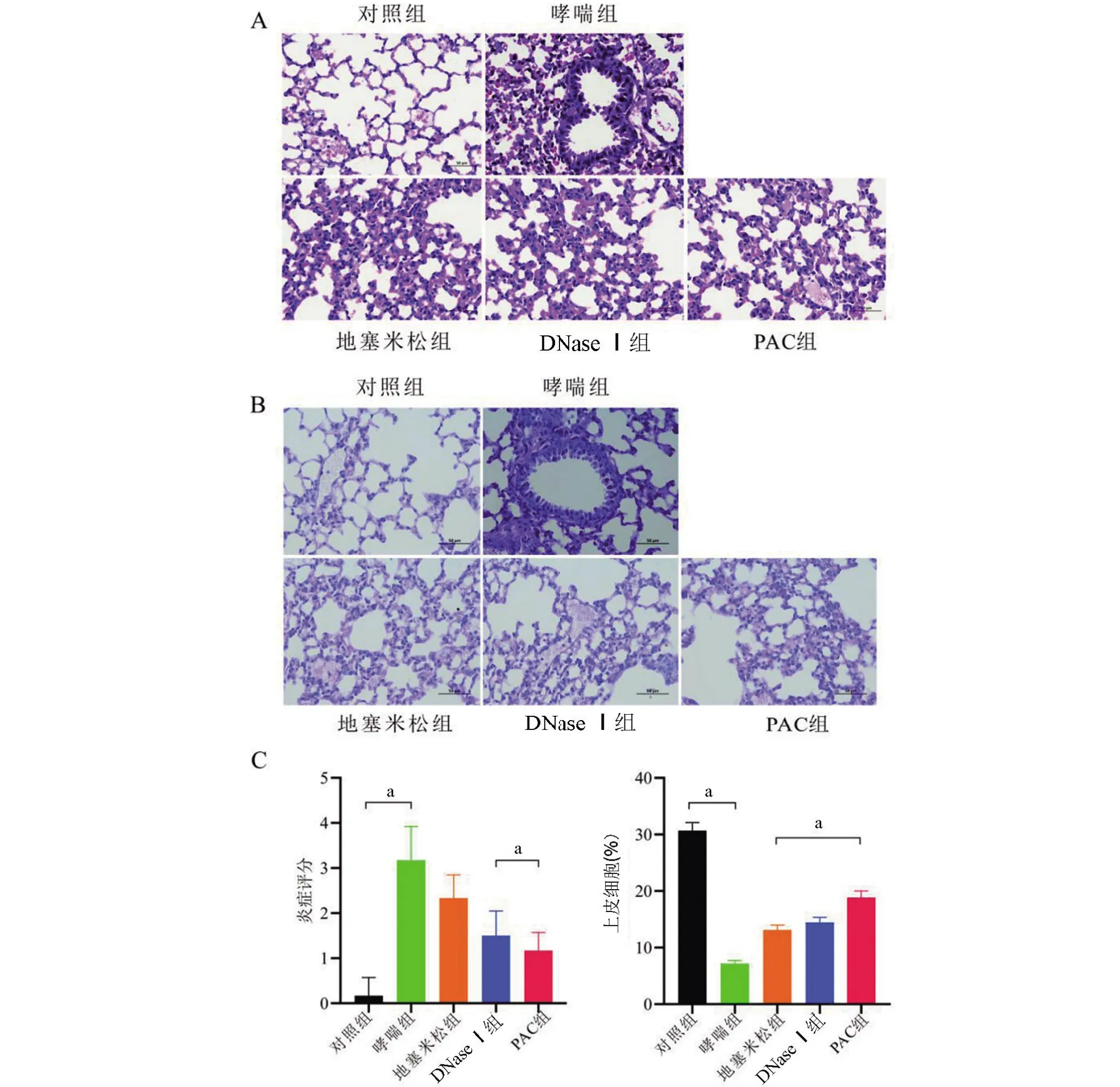
图7 小鼠肺组织损伤情况Figure 7 Lung tissue injury in mice
2.5 PAC体内抑制NETosis 体外细胞实验证实了一定浓度PAC 对NETosis 有抑制作用。为了检测PAC在体内抑制NETosis的能力,对NETs的特异性标志物MPO及CitH3进行共定位鉴定。与对照组比较,在哮喘组小鼠肺组织中,发现了大量的CitH3及MPO的空间分布。但在PAC 或DNase I 处理后,只发现了少量的共定位。与DNase I 组比,PAC 的抑制程度更显著。再结合各组小鼠BALF的dsDNA浓度对比,以上数据表明在LPS诱导的哮喘小鼠模型中,PAC可以有效地减少NETosis的形成。
3 讨论
PAC 是从海洋来源的真菌菌株分离出来的嗜氮酮类化合物,PAC 具有多种生物活性。大部分研究表明,PAC 有抗炎及抗氧化作用[7,11-13]。NETs 是由组蛋白、中性粒细胞自身DNA 及颗粒蛋白组成的网状结构。NETs 在疾病预防中起着关键作用,但过量的NETs 在一定程度上会加快某些疾病的进程。PAC是否能减轻NETosis 诱导的哮喘炎症机制尚不明确。对NETosis 相关机制进行研究具有重要意义。因此本实验对NETosis 诱导哮喘的过程进行探究,并建立了哮喘小鼠模型,以评价PAC 在体内的平喘作用。
哮喘是一种以慢性气道炎症为特点的高度异质性疾病,其重要机制有气道高反应性及气道重塑[14]。研究表明在大多数哮喘患者中,糖皮质激素能够减轻气道炎症,但是糖皮质激素会产生很多副作用,有骨质疏松、胃肠道刺激、出血倾向和免疫抑制等。根据气道炎性细胞浸润情况,哮喘被分成4种类型,即嗜酸性粒细胞型、中性粒细胞型、混合粒细胞型和少粒细胞型。将诱导痰中性粒细胞百分率>60%的哮喘定义为中性粒细胞型哮喘。有调查表明约50%的哮喘患者属于中性粒细胞型,中性粒细胞与重度哮喘和激素不敏感型哮喘密切相关[15]。中性粒细胞诱导相关细胞因子并延续炎症周期,中性粒细胞和中性粒细胞衍生介质可作为慢性气道疾病炎症和组织损伤长期存在的原因之一。
哮喘炎症与多种免疫驱动机制有关。目前将哮喘分为T2 型和非T2 型。Th2 介导的途径被认为是过敏性哮喘的驱动力,即T2型哮喘[16]。T2型哮喘与嗜酸性粒细胞、IgE、IL-4 和IL-5 有关。非T2 型哮喘通常涉及中性粒细胞、IL-6、IL-17 和TNF-α[17-18]。本研究中构建的哮喘模型主要涉及IL-6、IL-17和TNF-α,其中IL-17 占绝对优势。以Th17 细胞为主介导的哮喘称为Th-17型哮喘或中性粒细胞型哮喘。LPS增加促炎细胞因子的释放[19],有研究提出LPS 能够通过促进CD4+细胞分化为Th17 细胞,从而导致哮喘表型从嗜酸性细胞型转变为中性粒细胞型[20]。这种转变会造成皮质类固醇耐药、哮喘控制不佳和病情加重。本研究对BALF 中的3 类细胞进行检测,哮喘组嗜酸性粒细胞约占16%,中性粒细胞约占62%,证明该实验建立的是中性粒细胞型哮喘模型。PAC 可以通过抑制NETosis的形成来减轻中性粒细胞型哮喘炎症。糖皮质激素对NETosis 抑制作用弱,这也是部分哮喘患者对糖皮质激素的治疗反应不佳的原因。
在2004 年,Brinkmann 等[21]首 次 描 述 了NETs。NETs是处在细胞外的网状结构,是由染色质纤维所构成,上面装饰着蛋白质和多肽,通常存在于中性粒细胞的颗粒和细胞质中。在这些蛋白中有MPO、组蛋白、中性粒细胞弹性蛋白酶、钙卫蛋白及溶菌酶等[22-23]。NETosis是中性粒细胞爆炸性释放出NETs的过程,该过程是一种特殊类型的程序性细胞死亡。
多种物质可以刺激NETosis 的发生,包括PMA、LPS、IL-8 及钙离子载体等[24]。本研究的实验模型使用LPS诱导小鼠哮喘的发生,PMA成功刺激体外中性粒细胞产生NETs。PMA是一种植物来源的天然有机化合物,通常被用作有效的NETs 诱导剂[25]。PMA 诱导自杀性NETosis的发生,该模式以蛋白激酶C激活、细胞内钙释放、Raf-MEK-ERK 通路激活、NADPH 氧化酶组装和ROS的产生为起点。过氧化氢触发NE和MPO的激活,随后它们从嗜天青颗粒中动员起来并移位到细胞核,促进染色质解聚[26]。同时细胞内钙水平的增加导致PAD4的激活,PAD4参与组蛋白的瓜氨酸化,染色质解聚。随后是核膜的解体,核质和胞质集聚,紧接着细胞膜破裂,中性粒细胞的内容物以网状结构扩散到细胞外空间[27]。细胞外dsDNA 作为NETosis的标志物之一,生理上NETs可被血清DNA酶降解。核酸酶具有多种功能,例如控制生物膜形成或扩散、帮助某些病原体通过组织损伤侵入宿主和调节宿主免疫反应[28]。有研究评估了重组人脱氧核糖核酸酶对NETosis 的影响,结果显示NETosis 被抑制,同时中性粒细胞的浸润减少及炎症减轻[29-30]。DNase Ⅰ是一种主要存在于血浆中的核酸内切酶,它作用于单链DNA、dsDNA 和染色质,优先以非序列特异性的方式切割DNA[29]。DNaseⅠ除了被用作分子生物学工具外,还被批准用来治疗囊性纤维化。患者痰中存在NETs,会导致痰液黏度增加[30]。DNaseⅠ可以减少染色质解聚,并在一定程度上改变NETs 相关蛋白的溶解活性[31]。但由于DNaseⅠ在血清中的稳定性低,一定程度上限制了机体利用DNaseⅠ来抑制NETs[32]。本实验用DNaseⅠ来处理哮喘小鼠,与PAC 组相比,多项数据表明PAC 的治疗结局更好,对于NETosis,PAC具有比DNaseⅠ更好的抑制效果。
综上所述,本研究表明NETosis 与哮喘的发病机制密切相关,同时对糖皮质激素治疗中性粒细胞型哮喘缺乏有效性做出了解释。PAC 基于其抗炎和抗氧化作用来抑制NETosis,上述结果为PAC 对哮喘的保护作用提供了新的信息。通过PAC 来抑制NETosis 的形成可能会成为减轻哮喘炎症的一个新的治疗靶点。

