绵羊GRM1基因多态性及其与肉质性状的相关性
聂 玮,孟 科,荣 轩,强 浩,郭晨浩,陶毛孩,冯登侦
(宁夏大学 农学院,宁夏 银川 750021)
滩羊是宁夏中部地区有名的裘皮用绵羊品种,滩羊肉膻味较轻且脂肪分布均匀、肉质细嫩、风味独特、营养均衡[1];但其具有生长缓慢、繁殖力低的缺点,所以引进其他绵羊品种进行杂交,对于提高其生产力具有重要意义。杜泊羊是国内引进较早的肉用绵羊,与地方品种杂交利用的效果较好,可以明显改善后代的产肉性能[2]。小尾寒羊具有繁殖能力强、遗传性能稳定等特点[3]。故宁夏地区引进杜泊羊和小尾寒羊,与滩羊进行三元杂交,它们的后代能够继承生长发育快、产肉性能高、繁殖力强且肉质鲜美的优点[4]。
遗传标记是指可以用来区分生物个体或群体及其特定基因型的物质标记,分子遗传标记是以核苷酸序列变异为基础的遗传标记,可以准确地评估和预测动物的育种和生产质量,理想的分子标记相比传统的遗传标记具有信息量大、分布广、稳定性好的优势。代谢型谷氨酸受体1(GRM1)是代谢型谷氨酸受体(medium glutamate receptors,mGluRs)家族成员之一,代谢型谷氨酸受体和离子型谷氨酸受体(ionotropic glutamate receptors,iGluRs)的激活可以直接引起兴奋性神经毒性,这一过程参与脑外伤、中风、帕金森等多种神经系统疾病的病理过程[5]。目前已经发现8种mGluRs,分别命名为GRM1~GRM8,GRM1受到众多学者的关注。GRM1基因位于绵羊8号染色体上,其在大脑中分布广泛[6-7]。研究表明,mGluRs受体的过激活会产生大量的活性氧(ROS)[8],进而导致细胞毒性,GRM1基因表达量的不同可产生不同的生理学效应[9]。GRM1作为神经元信号调节器时可以刺激神经元的兴奋性,GRM1基因在神经元膜突触前和突触后特异性表达G蛋白偶联受体,该受体可以激活细胞内的Ca+,并通过一系列信号通路调节神经细胞的兴奋性[10-13]。GRM1能激活磷脂酶C,主要机理是刺激和激活更多的谷氨酸从突触前细胞释放。当GRM1激活磷脂酶C时,可以产生三磷酸肌醇和1,2-二酰基甘油,三磷酸肌醇和1,2-二酰基甘油对动植物早期发育和分化过程中的细胞增殖起着重要作用[14]。GRM1的活化能够激活PI3K-AKT通路,PI3K-AKT信号通路参与肌肉生长发育、代谢调控和稳态维持等重要生物学过程的调控。其中,PI3K家族成员可以促进脂质代谢、细胞增殖和细胞迁移;AKT家族成员在动物不同器官中均有不同程度的表达[15],AKT1、AKT2和AKT3的协同作用具有调控细胞大小、发育和新陈代谢的功能[16]。GRM1通过激活PI3K-AKT等信号通路,促进对动物细胞增殖、生长、脂肪生成、肌肉生长发育等的调控。Zhang等[17]研究发现,GRM1与绵羊断奶后日增重显著相关,并参与骨骼和肌肉的发育。GRM1基因目前已被证实与绵羊的肌间脂肪有关[18],肌间脂肪含量与肉质的嫩度、适口性和多汁性有关[19]。
本研究以滩羊(T)、杜泊羊(D)和小尾寒羊(XH)3个绵羊群体为研究对象,利用液相捕获测序技术对D、T、XH绵羊群体GRM1基因的遗传变异位点进行检测,筛选出具有多态性且品种间差异显著的位点进行多态性分析。采用Sequenom MassARRAY®SNP技术对筛选到的2个位点与绵羊的肉质性状进行关联分析,挖掘绵羊肉质性状相关的候选位点,以期为宁夏地区肉羊新品种(系)选育提供有效的分子标记手段,为肉羊的品种选育和杂交改良提供理论依据。
1 材料与方法
1.1 试验材料
试验动物均来自于石嘴山市平罗县威震肉羊繁育场。随机选择健康无病、饲养管理一致的杜泊羊(D,n=30)、滩羊(T,n=30)和小尾寒羊(XH,n=31),共计91只绵羊,均为母羊。采用EDTA抗凝采血管颈静脉采血5 mL,-20 ℃保存,用于DNA提取和液相捕获测序分析。
随机选取8月龄杜滩寒杂交羊(DTH)和滩羊(各8只,公母各半)、杜泊羊和小尾寒羊(各7只,3公4母),共30只绵羊,取耳组织放于75%乙醇中,-20 ℃保存,用于DNA提取和飞行质谱检测。
1.2 试验方法
1.2.1 DNA提取
绵羊血液样本DNA提取采用动物血液DNA提取试剂盒(北京天根科技有限公司)。使用0.8%琼脂凝胶电泳检测DNA质量,并利用Nanodrop 2000超微量分光光度计和0.8%琼脂糖凝胶电泳检测3个绵羊群体血液DNA浓度、纯度和完整性。
1.2.2 液相捕获测序
通过查阅国内外文献和NCBI数据库,确定GRM1基因序列ID号。然后将91个绵羊群体DNA样本交由北京康普森农业科技有限公司利用液相捕获测序技术进行测序,所得测序结果与现有绵羊参考基因组(Oar_rambouillet_v1.0)进行比对分析。
1.2.3 飞行质谱检测
采用Sequenom MassARRAY®SNP技术对30只绵羊GRM1基因的2个位点进行基因检测,待检样品为DNA。由北京康普森农业科技有限公司进行飞行质谱检测。实验步骤包括引物设计(利用Ensemble数据库中公开的绵羊GRM1基因SNPs位点信息,使用Assay Design 3.1软件设计待测SNP位点的PCR引物和单碱基延伸引物)、DNA质检、PCR扩增、单碱基延伸反应、样本脱盐、芯片点样、上机检测,引物序列见表1。

表1 SNP位点引物信息Table 1 Primer information for SNP loci
1.3 肉质性状测定
1.3.1 屠宰
将用于DNA检测和飞行质谱检测的30只绵羊进行屠宰,宰前24 h禁食,8 h禁水,称量后按照常规方式进行屠宰,放血后去除皮、头、蹄、尾、内脏和生殖器。
1.3.2 屠宰性能测定
测定指标包括宰前活重、胴体重、背膘厚、净肉重、屠宰率、净肉率和胴体脂肪含量(GR值)。称取心、肝、脾、肺、肾、全骨的质量。
1.3.3 肉品质测定
取第3肋骨到第12肋骨之间的背最长肌肉样品,使用嫩度仪测定剪切力,用压力法测定失水率,用石蜡切片法测定肌纤维直径、肌纤维密度,用普及型pH计测定pH值。
1.3.4 肌肉营养成分测定
肌肉中氨基酸含量依据GB 5009.124—2016《食品安全国家标准 食品中氨基酸的测定》测定,肌肉中肌苷酸和肌苷含量用HPLC法测定,脂肪含量依据GB 5009.6—2016《食品安全国家标准 食品中脂肪的测定》测定,蛋白质依据GB 5009.5—2016《食品安全国家标准 食品中蛋白质的测定》测定,胆固醇依据GB 5009. 128—2016《食品安全国家标准 食品中胆固醇的测定》测定,铜、锌、钙、铁、镁、硒元素含量分别依据GB 5009.13—2017、GB 5009.14—2017、GB 5009.92—2016、GB 5009.90—2016、GB 5009.241—2017、GB 5009.93—2017推荐的原子吸收分光光度法测定。
1.4 数据分析
采用Microsoft Excel 2019软件计算3个绵羊群体rs415006419和rs403075278位点的等位基因频率、基因型频率,利用卡方独立性检验判断其显著性;统计计算多态信息含量(PIC)、观测杂合度(He)、期望杂合度(Ho)和有效等位基因数(Ne),并进行卡方适合性检验,分析其是否处于哈代-温伯格平衡状态。利用SPSS 25.0软件对绵羊群体各基因型与肉质性状进行关联分析,数据以“平均值±标准差”表示,以P<0.05为差异显著性判断标准。
所采用的分析模型为一般线性模型:Y=μ+G+m+e。式中,Y代表性状测定值,μ代表群体均值,G代表基因型效应,m代表性别效应,e代表随机残差。
2 结果与分析
2.1 DNA检测结果
Nanodrop 2000检测结果显示,所有样品基因组DNA的D260/D280均合格。琼脂糖凝胶电泳显示所有DNA均保持完好明亮,未发生降解(图1),可用于下一步实验。
M,DL2000 DNA marker;1~8,部分绵羊基因组DNA。M, DL2000 DNA marker; 1-8, Genomic DNA of some sheep.图1 试验羊群基因组DNA电泳图Fig.1 DNA electrophoresis diagram of experimental sheep
2.2 GRM1基因多态性
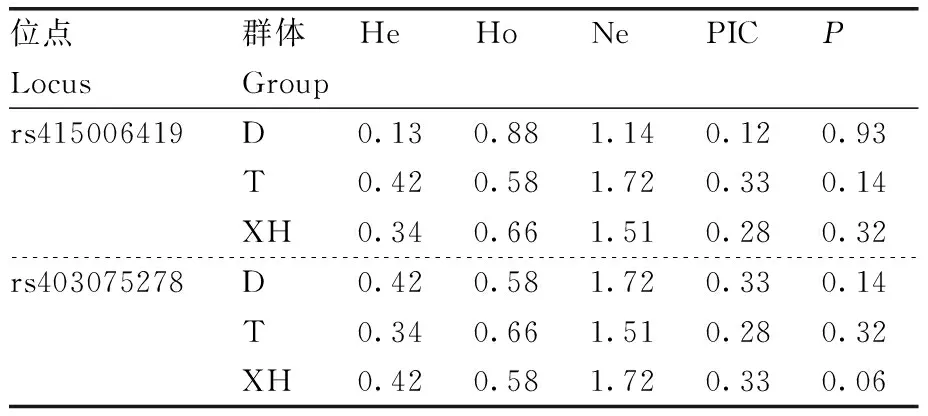
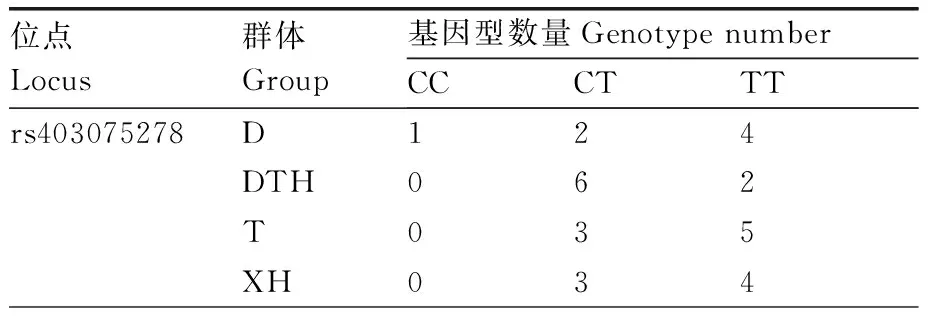
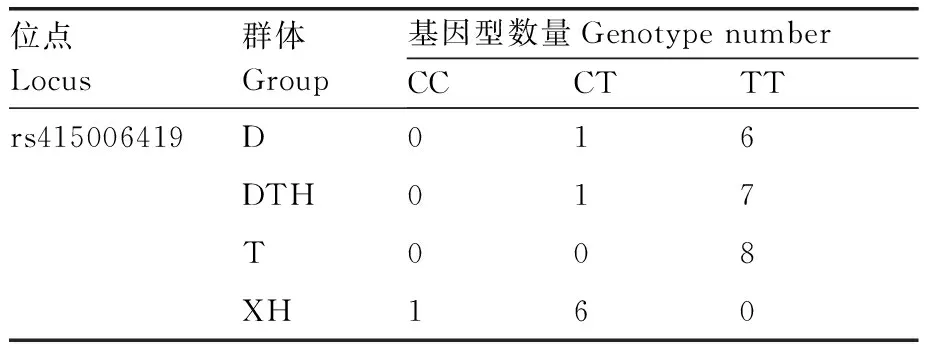
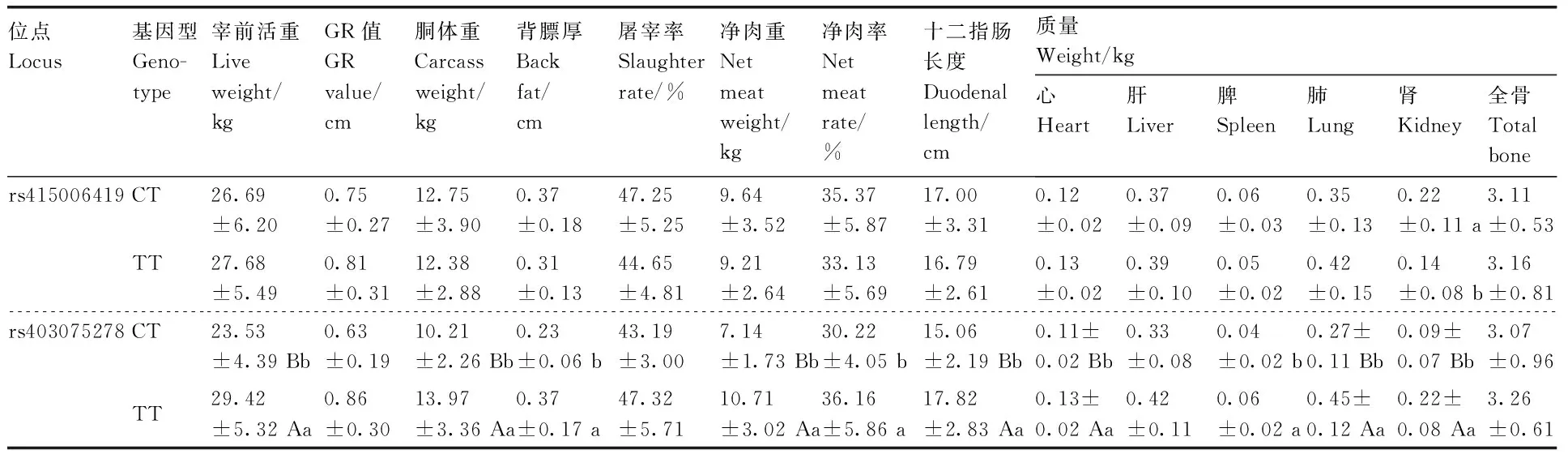
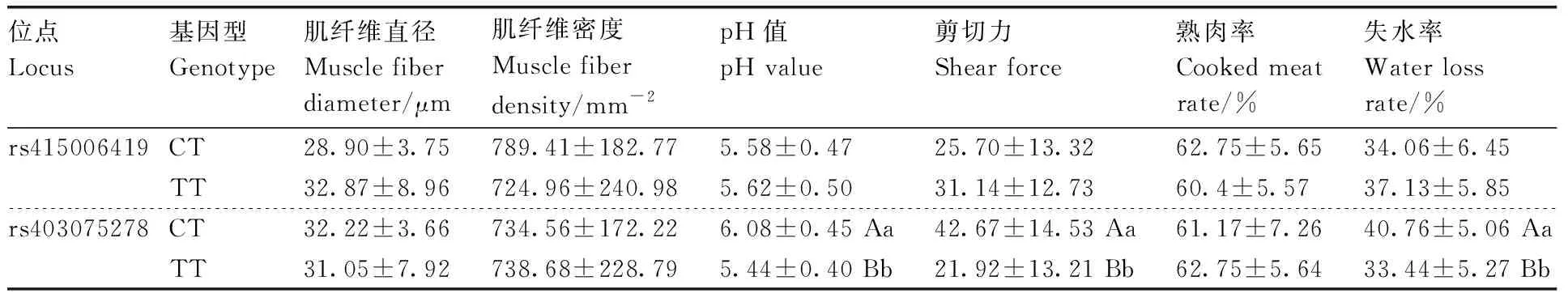
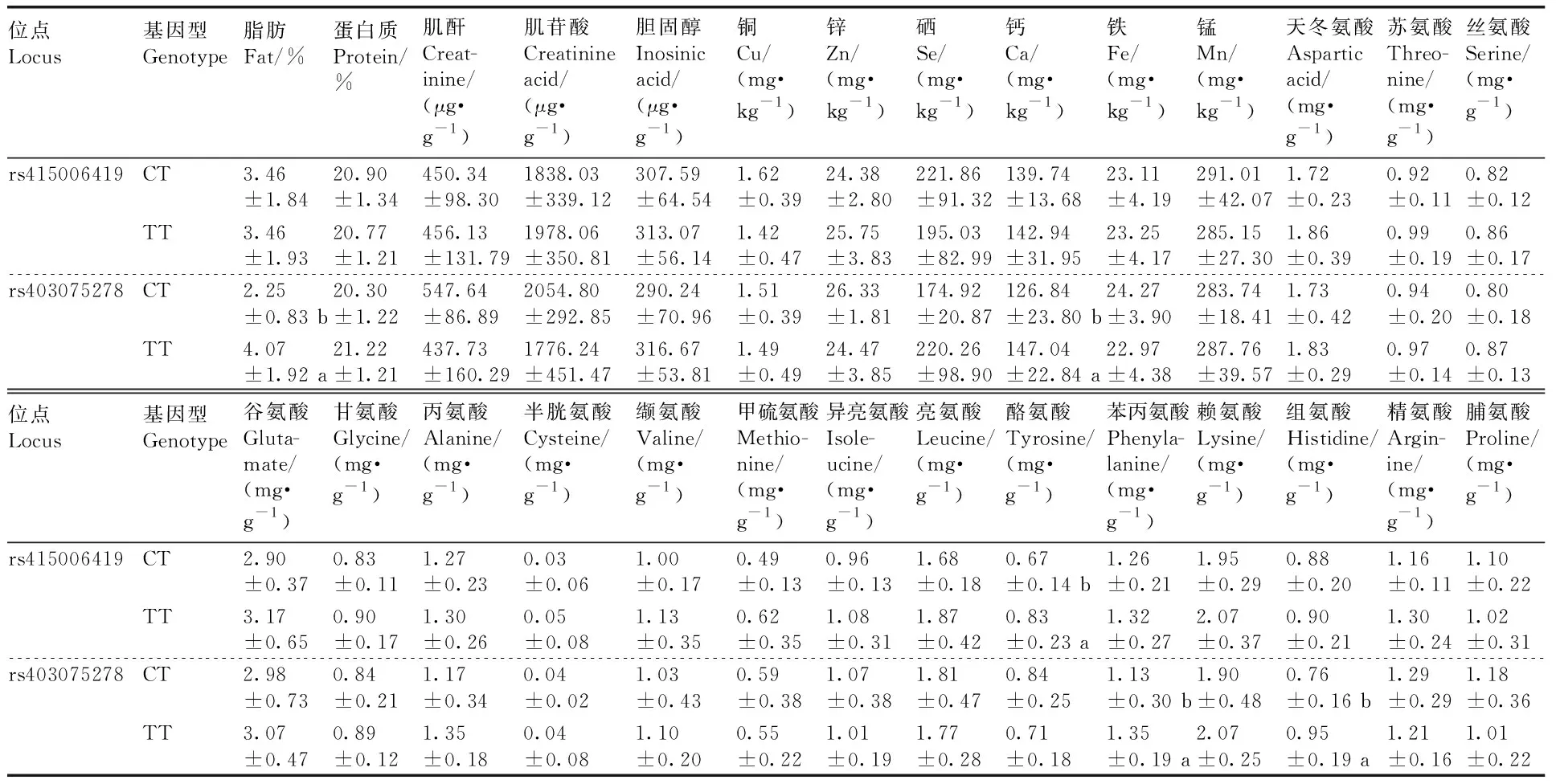
在91只羊的GRM1基因中共检测到共有28个突变位点,均为外显子突变,在rs415006419和rs403075278位点存在多态性,这2个位点均为同义突变,突变碱基均为C>T(表2),其余位点无多态性。卡方独立性检验显示,在3个绵羊群体中GRM1基因的rs415006419、rs403075278位点基因型频率存在显著性差异,2个位点在3个绵羊群体中均处于哈代-温伯格平衡状态(P>0.05)。由表3可知,rs415006419位点在D绵羊群体中均表现为低度多态(PIC<0.25),在T和XH绵羊群体中均表现为高纯合度与中度多态(0.25 表2 GRM1基因2个位点在3个群体中的基因频率和基因型频率Table 2 Gene frequencies and genotype frequencies of two loci of GRM1 gene in three populations 表3 GRM1基因SNP位点群体遗传学分析Table 3 Population genetic analysis of SNP locus of GRM1 gene 由图2与表4可见:GRM1基因rs403075278位点在D、DTH、T、XH 4个绵羊群体中有CC、TT和CT 3种基因型,TT基因型个体最多(15),CC基因型个体最少(1);rs415006419位点在D、DTH、T、XH 4个绵羊群体中存在CC、TT和CT 3种基因型,TT基因型个体最多(21),CC基因型个体最少(1)。 表4 GRM1基因rs403075278位点和rs415006419位点的群体分型结果Table 4 Population typing results for rs403075278 locus and rs415006419 locus of GRM1 gene 续表4 Continued Table 4 图2 GRM1基因rs403075278位点和rs415006419位点的分型结果Fig.2 Typing results for the rs403075278 locus and rs415006419 locus of GRM1 gene 2.4.1 不同基因型绵羊的屠宰性能 淘汰群体数量低于5%的基因型(CC基因型),然后对CT和TT基因型进行分析,结果见表5。rs415006419位点CT基因型绵羊肾的质量显著(P<0.05)大于TT基因型,不同基因型间其他屠宰性能均无显著差异(P>0.05)。rs403075278位点TT基因型的宰前活重、胴体重、净肉重、十二指肠长度,以及心、肺和肾的质量均极显著(P<0.01)大于CT基因型,TT基因型的背膘厚、净肉率和脾的质量显著(P<0.05)大于CT基因型,TT和CT基因型的GR值、屠宰率、肝的质量和全骨的质量无显著差异(P>0.05)。 表5 绵羊GRM1基因不同位点各基因型的屠宰性能Table 5 Slaughter performance of each genotype at different loci of GRM1 gene in sheep 2.4.2 不同基因型绵羊的肉品质 淘汰群体数量低于5%的基因型(CC基因型),然后对CT和TT基因型进行分析,结果见表6。rs415006419位点CT和TT基因型绵羊的肉品质均无显著差异(P>0.05);rs403075278位点CT基因型绵羊的pH值、剪切力和失水率极显著(P<0.01)大于TT基因型,2个基因型绵羊的肌纤维直径、肌纤维密度和熟肉率无显著差异(P>0.05)。 表6 绵羊GRM1基因不同位点各基因型的肉品质Table 6 Meat quality of each genotype at different loci of GRM1 gene in sheep 2.4.3 不同基因型绵羊的肌肉营养成分 淘汰群体数量低于5%的基因型(CC基因型)后,对CT和TT基因型进行分析,结果见表7。rs415006419位点TT基因型绵羊肌肉的酪氨酸含量显著(P<0.05)高于CT基因型,2个基因型的他营养成分含量均无显著差异(P>0.05)。rs403075278位点TT基因型绵羊肌肉的脂肪、钙含量、苯丙氨酸和组氨酸含量显著(P<0.05)高于CT基因型,2个基因型绵羊的其他营养成分含量均无显著差异(P>0.05)。 表7 绵羊GRM1基因不同位点各基因型的肌肉营养成分Table 7 Nutrient composition in sheep muscle of each genotype at different loci of GRM1 gene 群体遗传变异程度的大小反映了群体遗传多样性,通常使用PIC表示,PIC数值越大,群体的遗传多样性越高[20],表明该群体存在一定的遗传变异潜力[21]。PIC取决于检测等位基因的数量和频率分布[22]。GRM1基因rs403075278位点在3个绵羊群体中均表现为中度多态(0.25 屠宰性能是评价肉用性能和经济效益的重要指标,肉品质是衡量肉质性状的关键[23]。胴体重是影响肉类品质和价值的重要因素,直接影响着肉制品的加工与消费。屠宰率和净肉率是测定畜禽产肉性能和生长发育的重要依据[24]。Zhang等[17]对绵羊体重性状全基因组关联分析发现,GRM1是影响绵羊体增重的重要候选基因。彭珍等[25]通过对恩施黑猪胴体与肉质性状间相关分析发现,背膘厚与胴体重有极显著相关性,背膘厚的增加可以引起胴体重的增加,从而影响活体重。本研究中GRM1基因rs403075278位点不同基因型绵羊的背膘厚、胴体重、活体重均有显著差异,表明GRM1可以影响到绵羊的体增重,与前人研究结果一致。殷雨洋等[26]研究表明,湖羊心质量的显著提高可能与湖羊体重的提高有关。随着体重的增加,机体需要营养物质增多,代谢废物增加,使得心质量增加以满足这种不平衡。闵凡贵等[27]研究表明,脏器质量明显受到体重的影响。GRM1基因的rs403075278位点不同基因型间绵羊的十二指肠长度与心、肺、肾、脾的质量均有显著差异,rs415006419位点不同基因型间绵羊的肾重有显著差异,说明体重的增加影响了绵羊的脏器质量。王国森等[28]研究表明,CLPC基因CT型绵羊体重、体尺指标均高于CC型的绵羊,表明C→T转换可以促进绵羊的生长发育。同样,在本研究中TT基因型绵羊的宰前活重、胴体重、净肉重、十二指肠长度,以及心、肺、肾的质量均高于CT型绵羊,说明C→T转换促进了绵羊的生长发育。 肉品质是评价肉质特性的主要依据,pH值、剪切力是衡量肌肉品质重要感官指标之一[29-30]。肌肉中营养物质的含量与肉品质直接相关,营养价值、感官特征与理化特性是影响肉品质的重要因素[31]。研究表明,GRM1的活化能够激活PI3K-AKT通路,PI3K-AKT可以参与脂肪生成和肌肉生长发育等重要生物学调控。GRM1基因与谷氨酸代谢通路相关,李武峰等[32]研究表明,谷氨酸代谢通路可能与广灵驴的肉质嫩度有关。在本研究中GRM1基因rs403075278位点不同基因型的绵羊脂肪含量、失水率、剪切力、pH值等有显著差异,可能是由于GRM1基因活化激活PI3K-AKT通路,从而影响了肌间脂肪的生成,肌间脂肪可以改善绵羊肉质的嫩度和适口性。肌肉中的氨基酸含量不但对羊肉的营养价值有重要影响,而且会对羊肉的风味产生一定的影响,必需氨基酸的组成和含量是蛋白质食品中的一项重要指标。GRM1基因与谷氨酸代谢通路相关,谷氨酸是各种氨基酸代谢和转化的枢纽和中间环节,通过谷氨酸代谢的变化,可以影响其他多种氨基酸的代谢。Rowe等[33]研究表明,体内氧化可以抑制蛋白酶活化,激活钙蛋白酶抑制酶活性,组氨酸可以参与体内氧化还原反应,通过调节钙蛋白酶活性调节肌肉嫩度。翟彪[34]研究表明,饲料中添加适量的组氨酸可以提高肌肉中粗蛋白和粗脂肪的含量,同时可以提高肌肉的剪切力。李文[35]研究发现,添加适宜水平的苯丙氨酸可以提高肌肉中蛋白和脂肪的含量,同时可以提高肌肉的相对剪切力和持水能力。曹艳芳等[36]研究表明,酪氨酸可以在一定程度上提高淅川乌骨鸡的肉品质。GRM1基因rs403075278位点不同基因型的苯丙氨酸和组氨酸含量有显著差异,rs415006419位点不同基因型的酪氨酸含量有显著差异,苯丙氨酸和组氨酸均可以提高肌肉中蛋白和脂肪的含量,酪氨酸可以提升肌肉品质,提升肉质营养价值,与上述研究结果基本一致。GRM1基因rs403075278位点不同基因型的钙含量差异显著,可能与GRM1基因可以在神经元膜中表达G蛋白从而激活细胞内的钙离子[10-13]有关。GRM1基因的rs403075278位点和rs415006419位点突变可以影响绵羊肉品质和肌肉营养成分,说明GRM1基因可以调控绵羊的肉品质,可作为绵羊肉质性状的重要候选基因。 GRM1基因的rs403075278位点和rs415006419位点在D、T、XH和DTH群体具有多态性,不同基因型绵羊的肉质性状存在显著差异。TT基因型绵羊的屠宰性能和肌肉营养成分高于CT基因型,CT基因型绵羊的肉品质高于TT基因型。GRM1基因可以作为绵羊肉质性状的候选基因,该基因的2个位点适用于绵羊的肉质性状选育,可作为绵羊肉质性状选育的潜在候选遗传标记。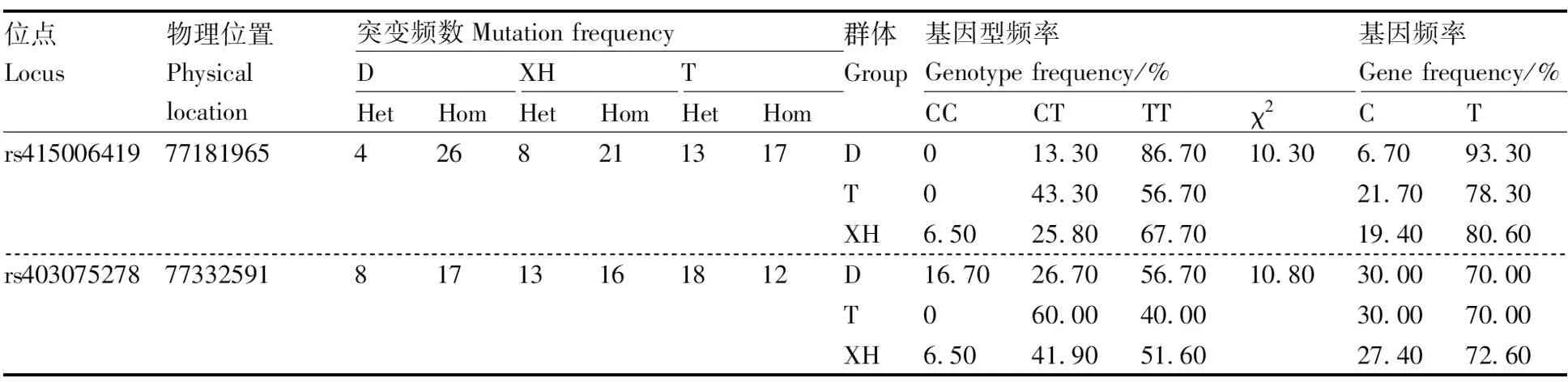
2.3 GRM1基因分型结果
2.4 rs415006419和rs403075278位点与绵羊肉质性状的关联性
3 讨论
3.1 三个绵羊群体GRM1基因的多态性
3.2 GRM1基因与屠宰性能的关联性
3.3 GRM1基因与肉品质、营养成分的关联性
4 结论

