抑制OsPUT5基因表达降低水稻低温抗性
张 斌, 冯晓庆, 郑 芊, 陈 稳, 滕 杰
(湖南科技学院 湖南省银杏工程技术研究中心,湖南 永州 425199)
多胺(polyamines,PA)是一类具有生物活性的低分子量脂肪族含氮碱,广泛存在于所有生物体中;它与RNA形成复合物可以增强mRNA的翻译,调节蛋白质合成,在细胞活性和增殖中起重要作用[1-2]。此外,PA还可以通过清除自由基来保护DNA免受活性氧(ROS)的伤害[3],作为细胞信号与激素相互作用[4];PA代谢与DNA甲基化之间存在密切关系[5]。PA参与植物器官和胚胎发生、花和果实发育,以及叶片衰老等过程[6],参与植物非生物和生物胁迫的响应[7-9,4]。在植物生长发育和应激条件下PA含量发生变化,为了实现体内PA稳态,植物会微调PA合成和降解[10-11]。研究表明,缺乏合成能力的细菌可以从培养基中吸收PA[12],在植物中也存在PA转运现象,并发现亚精胺、精胺和腐胺可以抑制拟南芥(Arabidopsisthaliana)吸收百草枯(paraquat,PQ)[13-14]。
L型氨基酸转运蛋白(L-type amino acid transporter,LAT)家族在介导氨基酸、PA和PQ的运输过程中发挥作用。5个拟南芥LAT成员(LAT3/AtPUT1、LAT4/AtPUT2、LAT1/AtPUT3、LAT2/AtPUT4和LAT5/AtPUT5)具有PA和PQ转运的功能[15],属于氨基酸多胺胆碱家族[16],随后,被重新归类为多胺-质子共转运体(polyamine H+-symporters,PHS)家族[17]。AtPUT2介导PQ在叶绿体中积累,在特定生理条件下,还具有调控亮氨酸转运活性的功能[18],并在氧化应激反应和脱落酸(abscisic acid,ABA)信号转导中发挥作用[19]。AtPUT3定位在质膜上,具有介导PQ和尸胺转运的功能[13,20],还介导韧皮部维生素B的长距离运输[21],热应激条件下具有稳定mRNA的功能[22]。AtPUT3和SOS1与蛋白激酶SOS2形成复合物响应应激反应,并通过蛋白互作和磷酸化作用调节转运活性[14],参与胞外精胺激活磷脂酶D(phospholipase D,PLD)和离子通量从而触发细胞内磷脂酸快速反应的过程[4]。AtPUT5基因突变后拟南芥提前开花,叶片中亚精胺和亚精胺结合物的含量显著降低[23]。
关于OsPUT方面的研究报道并不多。OsPUT1定位于内质网,而OsPUT3则定位于叶绿体;拟南芥中导入OsPUT1或者OsPUT3基因,其莲座叶、茎和开花时间出现变化[23]。Li等[24]认为,水稻抗百草枯蛋白1(Oryzasativaparaquat resistant1, OsPAR1, Os03g0576900)定位高尔基体,介导PQ进入叶绿体。但是,关于OsPUT在水稻抗低温胁迫过程中的作用目前尚未见相关报道。本研究对OsPUT5基因进行了分析,利用水稻OsPUT5基因的超表达(OE)株系、日本晴(Nip)株系和RNAi株系初步研究了OsPUT5基因在水稻生长发育和抗低温胁迫过程中的作用,为进一步认识水稻对低温的抗性提供参考,为后续水稻抗胁迫的遗传改良提供候选基因。
1 材料与方法
1.1 材料
根癌农杆菌GV3101、质粒pFGC5941、大肠埃希菌DH5α、RNAi株系、OE株系和Nip株系种子由湖南省银杏工程技术研究中心提供;质粒提取试剂盒、胶回收试剂盒、T载体pMD-19和草铵膦购自OMEGA公司;潮霉素购自Calbiochem公司;RNAiso Plus购自TaKaRa公司;DL5000 DNA Marker和RNA反转录试剂盒购自上海Thermo Scientific公司;2×TaqPCR Master Mix、丙二醛和脯氨酸测定试剂盒购自北京索莱宝科技有限公司;引物由北京擎科生物科技有限公司合成。
1.2 方法
1.2.1 PUT蛋白亲缘关系和结构分析
在Ensembl数据库下载拟南芥、水稻和高粱的基因组数据,用拟南芥AtPUT家族成员蛋白质序列(表1)进行BLASTP搜索,去掉不完整结构域的蛋白质序列。在MEGA 7.0软件中打开Clustal X,对所有蛋白质序列对进行多重比较,用邻接法(neighbor-joining method,NJ)绘制系统进化树,Bootstrap设置为1 000,其他均使用默认参数。利用TMHMM v.2.0软件和TMRPres2D软件分别进行跨膜结构域预测和可视化;用NCBI-CDD搜索蛋白质家族结构域。
表1 基因信息Table 1 Gene information
1.2.2OsPUT5转基因苗和纯系植株鉴定
构建超表达载体pCAM1390-OsPUT5和RNAi载体pFGC5941-OsPUT5-RNAi,借助农杆菌对Nip株系进行遗传转化并获得OE株系和RNAi株系[25-26]。RNAi株系和OE株系种子去壳后用次氯酸钠消毒40 min,冲洗干净,分别点播在含草铵膦(5 mg·L-1)或潮霉素(25 mg·L-1)的1/2 MS培养基上发芽,置于人工气候箱培养,培养条件为光照强度800 lx、湿度70%、14 h黑暗(25 ℃)、10 h光照(30 ℃)。采用SDS法提取叶片DNA进行PCR鉴定(OE株系在1390载体序列上设计引物:GCCTCGCTCCAGTCAATGAC,ATTCCGGAAGTGCTTGACAT;RNAi株系在pFGC5941载体序列上设计引物:CACTCCAAAGAAAGAGAAACTGACA,CTCAGGTTTTTTACAACGTGCACAA),PCR产物用l.5%琼脂糖凝胶电泳检测。收获T1代种子后,将T1代种子点播在含草铵膦(5 mg·L-1)和潮霉素(25 mg·L-1)的1/2 MS培养基上筛选,置于人工气候箱培养,移栽后获得T2种子。T2代种子继续在含草铵膦(5 mg·L-1)或潮霉素(25 mg·L-1)的1/2 MS培养基上进行筛选,鉴定纯株系。
1.2.3 幼苗温度耐性和生理生化指标测定
OE株系、Nip株系和RNAi株系各取3个不同植株,种子去壳后用次氯酸钠消毒40 min,无菌水冲洗干净,接种于1/2 MS培养基上,置于人工气候箱培养。发芽2周后,选取生长一致的幼苗于4 ℃处理30 h,观察三者的表型差异,测定处理前后生理生化指标,3次重复。
幼苗洗净吸干水分后用万分之一电子天平测量鲜重,120 ℃烘干至质量不变,称量干重。
取0.5 g幼苗叶片,用ddH2O冲洗干净,剪碎,置于20 mL ddH2O中,在室温下浸泡30 min,检测电导率(C1);然后沸水浴15 min,马上冷却摇匀,检测电导率(C2),3次生物学重复。叶片相对电导率Ec=C1/C2×100%[27]。
幼苗根系洗净后,用滤纸擦干,取0.5 g根系用液氮速冻并研磨成粉状,按照脯氨酸和丙二醛检测试剂盒(北京索莱宝科技有限公司)提供的方法分别测定脯氨酸和丙二醛含量。
1.2.4OsPUT5基因相对表达量和农艺性状测定
OE株系、Nip株系和RNAi株系种子发芽后移栽到直径30 cm的盆中,每个株系4株,常规盆栽管理。移栽后21 d,用Trizol法提取叶片RNA,按照RNA反转录试剂盒(Thermo Scientific公司,上海)的方法将RNA反转录成cDNA,以ACTIN基因作为内参(引物AGCTATCGTCCACAGGAA,ACCGGAGCTAATCAGAGT),通过qRT-PCR比较OsPUT5在RNAi株系、OE株系和Nip株系中的表达量(引物AAGTACAGCAGTGTCAATGAGGGCG,TGACACTATCCTCAATCCCAAACGG)。Nip株系生长至开花期,分别取水稻根、茎、叶片和颖花的总RNA,通过qRT-PCR测定OsPUT5基因的表达模式。qRT-PCR在美国伯乐CFX Connect上进行,反应体系为10 μL,分别包括1 μL cDNA,引物各0.4 μL,SYBRgreen Mix 5 μL,ddH2O 3.2 μL;反应参数为94 ℃预变性1 min,95 ℃变性15 s,55 ℃退火20 s,72 ℃延伸30 s,45个循环。每次实验设置3次重复,采用2-△△CT法计算基因的相对表达量。
成熟期测定水稻的主要农艺性状。株高:抽穗后测量土面至最高穗顶的平均高度;分蘖数:蜡熟期记录总茎蘖数与有效穗数;每穗粒数:包括每穗总粒数和每穗实粒数,白穗和半枯穗不计在内;结实率=每穗实粒数/每穗总粒数×100%;千粒重为1 000粒晒干的饱满谷粒的质量。
1.3 数据分析
试验数据采用Excel软件(2019版)进行统计分析,用t检验法进行差异显著性检验。
2 结果与分析
2.1 PUT蛋白亲缘关系和结构
根据系统发育结果将拟南芥、水稻和高粱多胺转运蛋白分为3大类:第Ⅰ类蛋白最多,包含4个拟南芥多胺转运蛋白和2个水稻多胺转运蛋白,分别为AtPUT1、AtPUT2、AtPUT3、AtPUT5、OsPUT1和OsPUT5;第Ⅱ类只有3个蛋白,水稻中有OsPUT6;第Ⅲ类中含有3个水稻多胺转运蛋白OsPUT2、OsPUT3和OsPUT4(图1-A)。OsPUT5是一种C端和N端都位于细胞膜外且含有10个跨膜结构域的膜蛋白(图1-B),具有腐胺-鸟氨酸逆向转运蛋白PotE结构域和氨基酸通透酶AA_permease_2结构域(图1-C)。
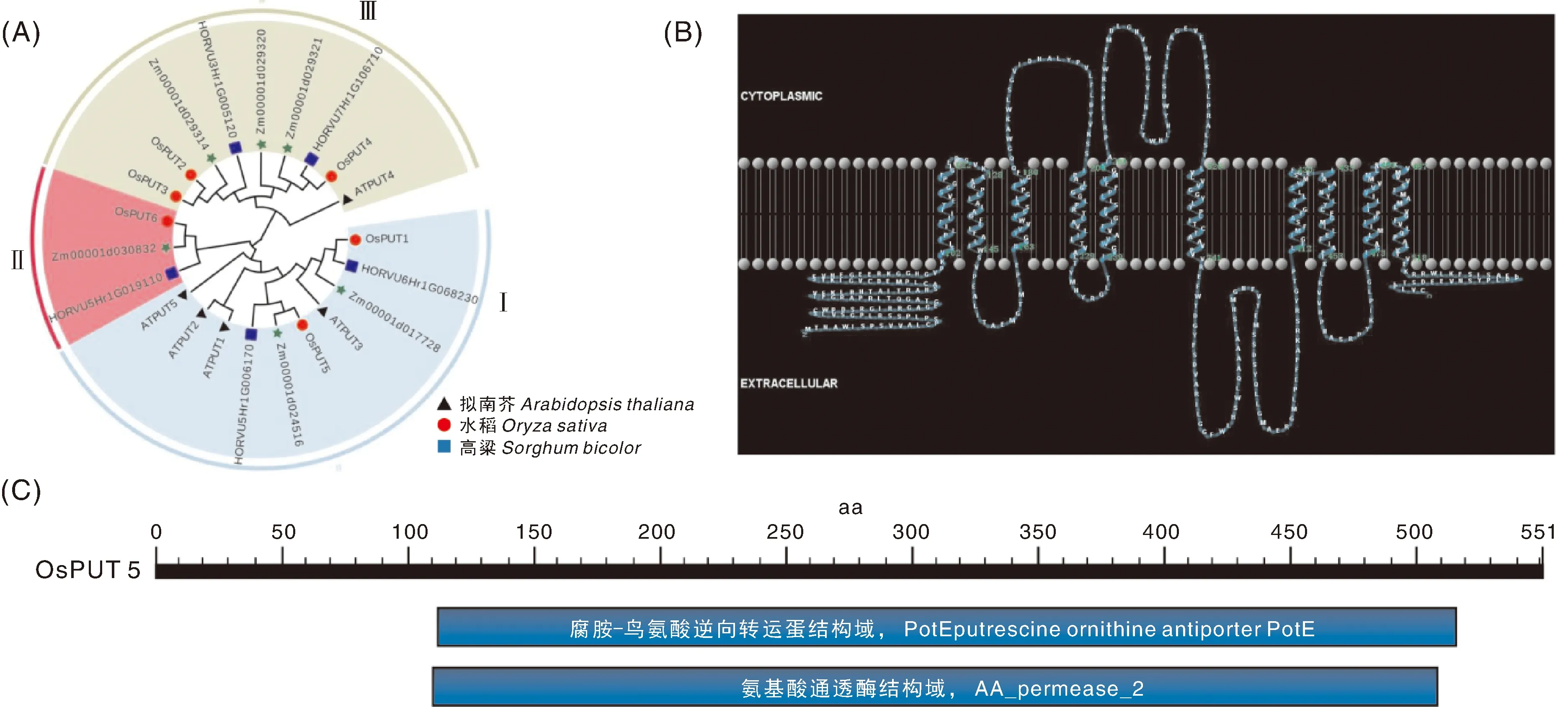
A,水稻和其他物种PUT家族蛋白系统进化树;B,OsPUT5蛋白含10个跨膜结构域且N端和C端均位于细胞质侧;C,OsPUT5蛋白保守的结构域,黑条显示氨基酸序列的长度。A, Phylogenetic tree of PUT family protein in rice and other plants; B, A cartoon representation showing the 10 transmembrane domains in the OsPUT5 protein with both C-and N-termini in the cytoplasmic side; C, Domains conserved in the OsPUT5 protein. The black bar shows the length of the amino acid sequence.图1 OsPUT5蛋白的生物信息学分析Fig.1 Bioinformatics analysis of OsPUT5 protein
2.2 OsPUT5基因表达模式、转基因苗鉴定和基因表达水平
用特异性引物分别对RNAi株系和OE株系的DNA进行PCR扩增,产物经琼脂糖凝胶电泳后分别在500~600 bp(550 bp)和400~500 bp (440 bp)有特异条带(图2-A和图2-B),表明目的基因已经整合进相应水稻染色体上。RNAi株系和OE株系分别在含草铵膦或潮霉素的培养基上经过两代筛选,获得转基因纯合株系。qRT-PCR结果显示:RNAi株系中OsPUT5基因表达水平显著低于Nip株系,在OE株系中,OsPUT5基因表达水平显著高于Nip株系(图2-C)。qRT-PCR结果显示,OsPUT5基因在Nip株系的根、茎和花中的表达量差异不显著,叶片中OsPUT5表达量显著高于根、茎和花(图2-D)。
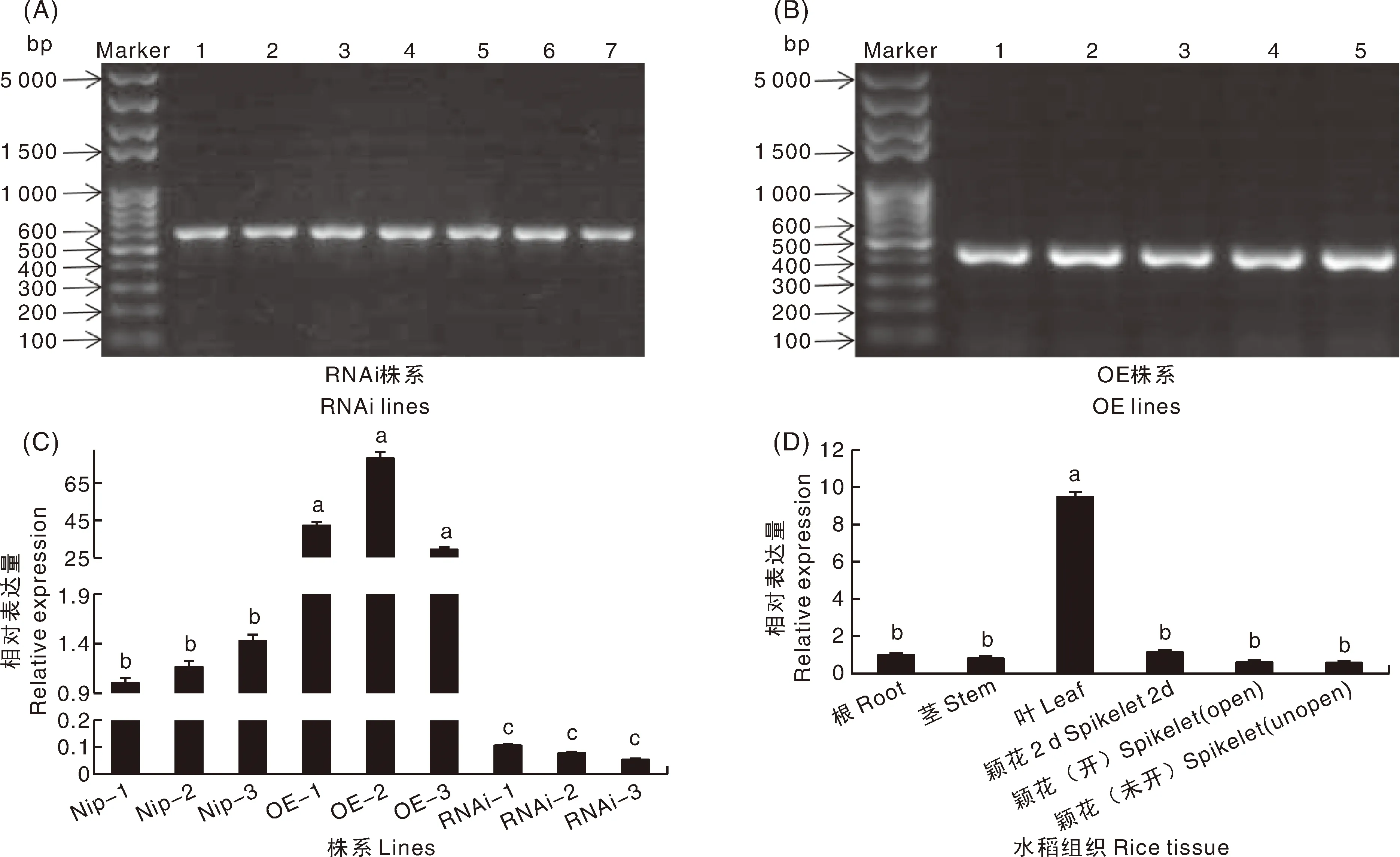
A,RNAi株系DNA水平检测,1~6为抗性苗,7为pFGC5941-OsPUT5-RNAi质粒;B,OE株系DNA水平检测,1~4为抗性苗,5为pCAM1390-OsPUT5质粒;C,OE株系和RNAi株系RNA水平检测;D,OsPUT5基因表达模式。柱上无相同字母代表差异显著(P<0.05),误差线代表标准差,下同。A, DNA level detection of RNAi lines, 1-6 were resistant plantlets, 7 was pFGC5941-OsPUT5-RNAi plasmid; B, DNA level detection of OE lines, 1-4 were resistant plantlets, 5 was pCAM1390-OsPUT5 plasmid; C, RNA level detection in OE lines and RNAi lines; D, OsPUT5 expression pattern. Different lowercase letters indicated significant difference at P <0.05, the error bars represented the standard deviation. The same as below.图2 转基因苗鉴定和基因相对表达水平检测Fig.2 Identification of transgenic seedlings and detection of gene expression level
2.3 OsPUT5基因抑制表达降低了水稻对低温胁迫的抗性
低温胁迫处理前,OE株系、Nip株系和RNAi株系幼苗表型差异不明显(图3-A)。4 ℃处理30 h后,OE株系与Nip株系的第一片叶片表现出一定程度的枯萎,但区别不大,RNAi株系整株枯萎,第1片叶、第2片叶、第3片叶和第4片叶失水严重(图3-B)。RNAi株系鲜重显著低于OE株系和Nip株系,OE株系和Nip株系鲜重无显著差异,而3个株系的干重无显著差异(图3-C)。低温处理前,OE株系、Nip株系和RNAi株系脯氨酸含量、相对电导率和丙二醛含量无明显差异;低温处理后,3个株系脯氨酸含量、相对电导率和丙二醛含量与处理前相比均显著升高,RNAi株系的脯氨酸含量显著低于OE株系和Nip株系,而相对电导率和丙二醛含量则显著高于OE和Nip株系(图3-D、图3-E和图3-F)。4 ℃处理30 h后,继续正常温度培养10 d,3个株系均表现出叶片发黄和叶尖枯萎的情况(图3-G),但是,RNAi株系存活率显著低于OE株系和Nip株系(图3-H)。
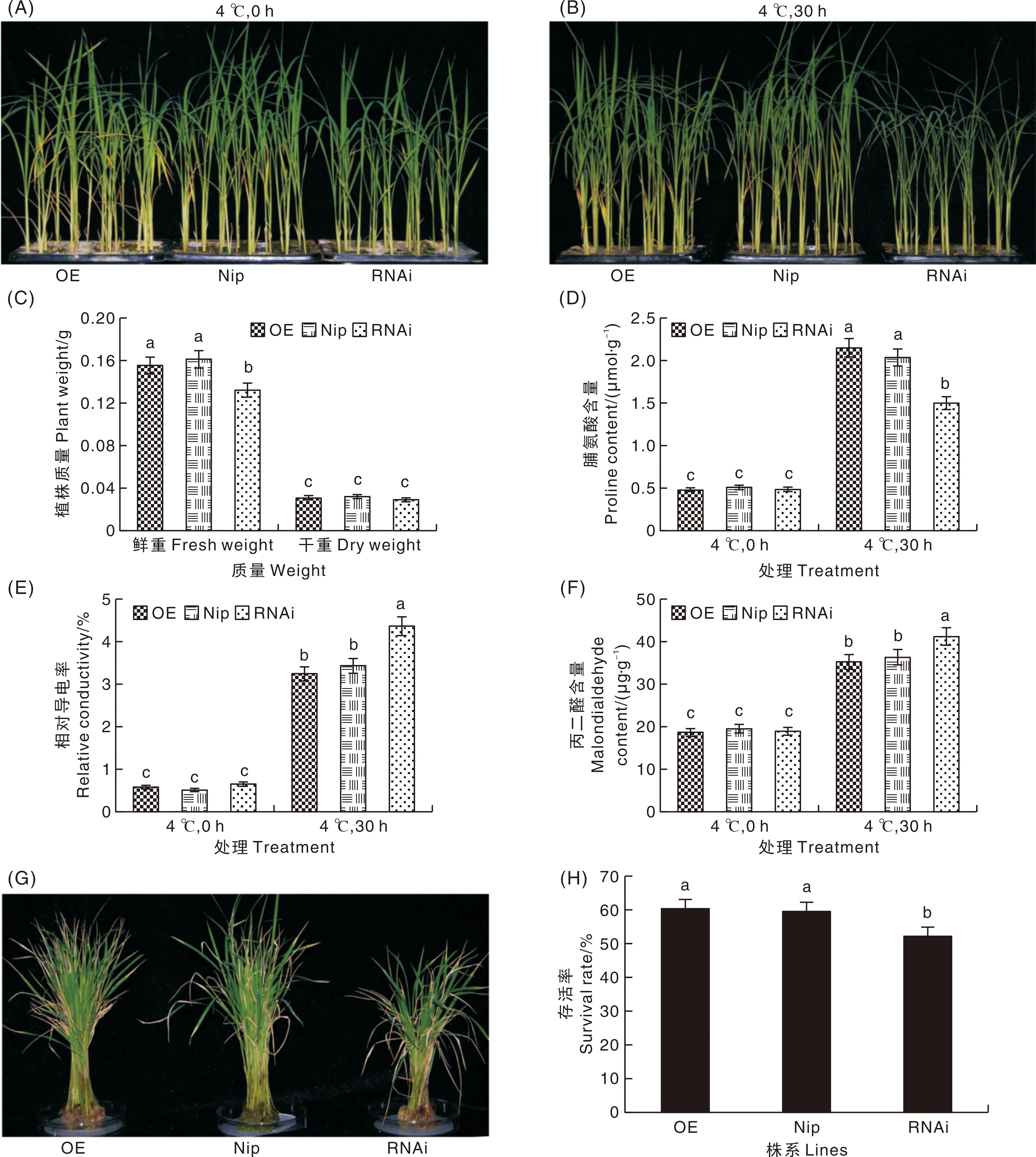
G,植株低温处理后继续正常培养10 d后的表型;H,植株低温处理后继续正常培养10 d后的存活率。G, Phenotype of plant after 10 days of normal culture after low temperature treatment; H, The survival rate of plants after 10 days of normal culture after low temperature treatment.图3 OE株系、Nip株系和RNAi株系幼苗耐低温性比较Fig.3 Comparison of cold tolerance of seedlings of OE lines, Nip lines and RNAi lines
2.4 OsPUT5基因的表达水平不影响水稻成熟期相关农艺性状
我们跟踪了3种株系的完整生命周期,在田间生长条件下没有观察到明显的差异表型。在水稻成熟期,OE株系、Nip株系和RNAi株系植株的株高、穗长、每穗粒数、初级枝梗数、每穗实粒数、千粒重和结实率等指标均无显著差异(表2),说明OsPUT5基因的表达水平不影响水稻成熟期相关农艺性状。

表2 OE株系、Nip株系和RNAi株系主要农艺性状的比较Table 2 Comparison of main agronomic characters of OE lines, Nip lines and RNAi lines
3 讨论
本研究从水稻基因组中鉴定出6个OsPUT基因。拟南芥、水稻和高粱PUT蛋白分为3大类,其中AtPUT1、AtPUT2、AtPUT3、AtPUT5、OsPUT1和OsPUT5归为同一类,说明OsPUT5与这些蛋白具有一定的同源性,可能具有类似PA转运的功能。突变体atput3对0.1 μmol·L-1PQ具有一定的抗性,而OsPUT1基因在突变体atput3中异源表达后恢复了对PQ的敏感性[28]。AtPUT3基因沉默导致拟南芥韧皮部分泌物中维生素B和PA的缺失,破坏了这些化合物在器官中的稳态,从而影响拟南芥生长发育[21]。Li等[24]的研究表明,水稻OsPAR1定位在高尔基体,参与叶绿体中PQ的运输,基因超表达导致水稻对PQ敏感性增加,抑制表达提高水稻对PQ的抗性。Zhao等[29]将OsPUT5蛋白归为氨基酸转运体PHS亚族,自然生长条件下30日龄、60日龄Nip株系中OsPUT5基因只在穗中特异性表达,根、叶、茎中不表达;而本研究中该基因在Nip株系开花时叶片中表达量最高,根、茎和花中无显著差异,这种差异可能是取材方式、部位和时间不一致导致的。
OsPUT5是一种含有10个跨膜结构且N端和C端都位于胞质侧的膜蛋白,同时还含有腐胺-鸟氨酸逆向转运蛋白PotE特有结构域。PotE由12个跨膜片段组成且N末端和C末端位于细胞质中,在中性pH下负责吸收腐胺;酸性pH下负责排出;鸟氨酸可诱导PotE的表达,对细胞生长非常重要[30]。5个AtPUT都具有PotE非常保守的结构域[18],在拟南芥氨基酸、PA和硫胺的运输中发挥作用[17-18]。
AtPUT5基因突变后导致拟南芥提早开花,叶片中亚精胺和亚精胺结合物含量显著降低,Ahmed等[23]认为,PA转运在调控细胞PA浓度中发挥关键作用。在田间生长条件下,OsPUT5转基因株系在完整生命周期内没有观察到明显的表型差异,农艺性状与Nip株系相似,表明OsPUT5基因的超表达和抑制表达对水稻的正常生长发育没有产生明显影响,这与前人的研究结果一致[24]。在亚精胺诱导拟南芥PA反应的研究中,四重突变体lat1/2/3/5和lat1/2/4/5表型与野生型类似[4]。这可能是PUT家族亚细胞定位不同、不同转运活性或者转运功能的冗余,也可能是所属PHS家族中其他成员也发挥了作用。烟草亚细胞实验表明,OsPUT3定位于叶绿体,将其基因导入拟南芥后,引起莲座叶、茎和开花时间出现一定程度的变化[23],原因可能是拟南芥和水稻的基因表达调控机制存在一定差异,而OsPUT3基因在拟南芥中属于外源表达。
甜橙(Citrussinensis)愈伤组织冷处理后CsPUT基因表达发生变化,超表达CsPUT4提高了内源性PA含量并导致愈伤组织抗寒能力增强[31]。Li等[32]研究表明,ABA和PA相互调节生物合成,可触发抗氧化系统信号,提高甜瓜(CucumismeloL.)抗寒性。OE株系抗低温能力没有增强的原因可能是OsPUT家族基因存在功能冗余。RNAi株系经过低温处理后,抗寒能力下降,这可能是在低温条件下,抑制OsPUT5基因表达影响水稻幼苗的PA含量,导致相关生理状态发生改变,从而导致幼苗抗寒能力下降。缺少RNAi株系和OE株系成熟期抗寒性研究、突变体基础上的功能互补研究,以及PA含量与激素之间的关系研究是本研究的不足之处。总之,本研究初步阐明了OsPUT5基因在水稻抗低温胁迫过程中的作用,为后续该基因的功能研究提供了一定的启示。

