猪牙花更新芽年生育进程及鳞茎营养物质含量的变化
刘雪莲,蒋明格,朱俊义,齐 迹
(1.通化师范学院生命科学学院,吉林通化 134002;2.吉林省长白山生物种质资源评价及应用重点实验室,吉林通化 134002;3.通化市二道江区农业农村局,吉林通化 134000)
猪牙花(Erythronium japonicumDecne)是百合科(Liliaceae)猪牙花属(Erythronium)多年生草本植物,别名车前叶山慈姑,俗名山芋头、老母猪牙、野猪牙等,生于海拔300~1 500 m 腐殖质肥沃的山地林下,林缘灌丛或沟边,主要分布在中国东北、朝鲜、日本、俄罗斯(远东地区)[1-2]。猪牙花嫩叶可食,鳞茎营养丰富,味道鲜美,淀粉含量高,在日本主要用于制作上等寿司,具有很高的保健和药用价值[2]。猪牙花是长白山地区林下早春类短命植物类群的主要组成成分,地上部生育期极短仅40~60 d,但花期相对较长,且花大,色彩艳丽,花期可填补早春时节的空白,具有很好的观赏价值,逐渐成为园林早春绿化的新宠。目前有关猪牙花的研究主要集中在生物与生态学特性[3-6]、种子生物学特性[7-11]、种球生物学特性[12-13]、花器官与繁育系统[14]、花芽分化[15]等方面。但猪牙花更新芽年生育进程及不同时期贮藏器官鳞茎的生理变化并不清楚,从而制约了栽培生产中的花期调控、种苗繁育、栽培管理等。本研究以猪牙花更新芽地上生育期和休眠期的鳞茎为研究对象,采用解剖和扫描电镜法观察更新芽形态发育进程,同时测定更新芽不同生育期鳞茎中的淀粉、可溶性总糖、可溶性蛋白含量,以明确猪牙花更新芽的年发育进程,探究不同发育阶段鳞茎碳水化合物及可溶性蛋白含量的动态变化,揭示猪牙花生长发育的生理机制,以期为猪牙花驯化、繁育、栽培管理提供参考。
1 材料与方法
1.1 材料
试验用猪牙花生长于长白山脉通化段老岭山脉和龙岗山脉之间的驮道岭(125°55'45″~59″E,41°37'55″~59″N,海拔700~750 m),于地上植株枯萎后将地下鳞茎移植至通化师范学院实践栽培基地(125°58'49.63″E,41°44'47.04″N,海拔429 m)。
1.2 方法
1.2.1 更新芽年生育期观察 在猪牙花更新芽地上生育期(4 月初萌土开花至5 月中旬地上部枯萎),每隔10 d于天然林下挖取大小一致的鳞茎10个,观察鳞茎生长发育情况。地上部枯萎死亡后,将地下鳞茎挖出800 株,移植在通化师范学院实践基地的栽培床中,用于后续的连续取样。从移植开始每隔3 d 取样1 次,观察到更新芽分化完毕后,间隔20 d取样1次,直至土壤上冻。每次取10个鳞茎,将鳞茎用FAA固定液(70%乙醇∶甲醛∶冰乙酸=90∶5∶5)固定48 h以上,解剖观察更新芽发育状态,并用扫描电子显微镜观察拍照[16]。
1.2.2 鳞茎营养物质含量的测定 将更新芽不同发育时期的鳞茎3 个用液氮速冻、-80 ℃超低温冰箱保存,用于可溶性蛋白含量的测定,另取3个鳞茎于80 ℃烘干、粉碎,用于营养物质含量的测定,各重复3次。其中淀粉含量、可溶性总糖含量采用蒽酮比色法;可溶性蛋白含量采用考马斯亮蓝G-250染色法[17]。
1.3 数据分析
采用Microsoft Excel 2013对数据进行处理;用SPSS 25.0进行方差分析及Duncan 多重比较(p<0.05时,表示差异显著),使用Graphpad prism 5.0作图,使用Adobe photoshop CS 6.0对图片进行处理。
2 结果与分析
2.1 猪牙花更新芽年生长发育进程及形态特征
由表1可知,经连续取样观察发现,4月11日-5月19日为更新芽地上生活周期,整个地上生活周期可分为5个阶段,分别为初花期、盛花期、初果期、盛果期和枯萎期。猪牙花更新芽在4月初萌土开花,此时地下鳞茎已开始更新生长,新鳞茎逐渐膨大,到盛花期时新鳞茎已撑破母鳞茎,母鳞茎由于地上器官和新鳞茎的生长,营养物质不断被消耗而变空瘪(图1a),到地上部枯萎时完全消失被新鳞茎所取代。
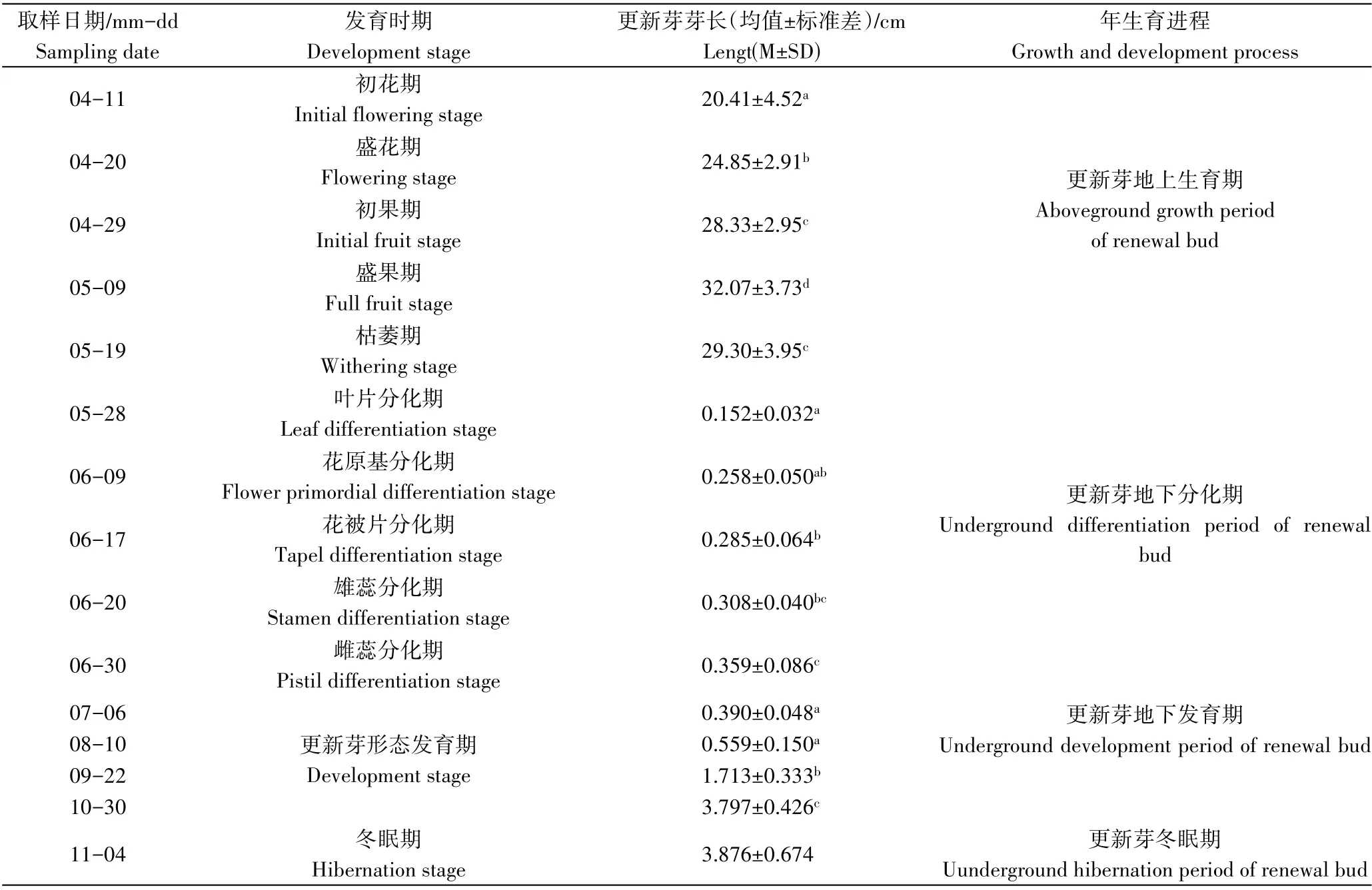
表1 猪牙花更新芽年生育进程Table 1 The growth and development process of renewal bud of E.japonicum
5 月中下旬地上部枯萎至6 月30 日为更新芽分化期,虽进入夏眠期,但地下鳞茎并没有休眠,而是进行更新芽的形态分化,经解剖观察发现,鳞茎最内层鳞叶基部的分生组织开始分化更新芽,到6 月30 日分化结束。根据分化进程和形态特征可分为叶片分化期、花原基分化期、花被分化期、雄蕊分化期、雌蕊分化期。分化过程及形态特征如图1 和图2,首先茎尖分生组织分化出更新芽的2 枚对生的叶原基(图1b、图2a),随后生长点膨大形成球形的花原基(图2b);花原基生长迅速,在原基的基部依次分化出2轮花被片,共6枚,呈三角形排列(图2c、图2d),同时两轮雄蕊原基也相继发生,外轮的3枚原基较小,内轮的3枚原基较大(图1c、图2d);雄蕊原基发生后,花原基顶端剩余部分逐渐生长并向下凹陷而呈三角形,形成雌蕊原基(图2e)。在整个形态分化期间,更新芽芽体伸长缓慢,至形态分化完成(6月30日)时,芽体长度仅为0.359 cm,芽体外观呈圆锥状(图1d),芽体基部可见明显的腋芽原基分化,此腋芽原基为翌年的鳞茎更新和更新芽的分化做准备(图1e、图2f)。

图1 猪牙花更新芽年生育进程Figure 1 Annual growth and development process of renewal bud of E.japonicum

图2 猪牙花更新芽器官分化(扫描电镜观察)Figure 2 Organ differentiation of renewal bud of E.japonicum (SEM)
7 月6 日-11 月4 日为更新芽发育期,此阶段叶片和花器各部生长发育迅速,芽体长度也快速增长,9 月22日芽体长度可达1.713 cm,11 月4 日土壤上冻时更新芽芽长可达3.876 cm,长度已接近或超出鳞茎(图1f),随后进入长达4个月的冬眠期。
2.2 猪牙花更新芽年生育进程中鳞茎淀粉含量的变化
由图3 可知,鳞茎淀粉含量在猪牙花更新芽地上生育期呈先升高后下降趋势变化,5 月9 日盛果期含量达到峰值,5 月19 日生育末期含量最低,各时期含量差异不显著。进入更新芽地下分化期时,鳞茎淀粉含量随更新芽的分化也呈先上升后下降的趋势变化,在5 月28 日叶片分化期含量最低,6 月9 日花原基分化期含量缓慢上升,于6 月17 日花被分化期快速升高,达到峰值,与叶片分化期(5 月28 日)相比,提高291.24%。而后在雄蕊分化期和雌蕊分化期持续下降,但与分化初期(叶片分化期、花原基分化期)相比仍维持在较高的含量水平。6月30日更新芽分化完成后,芽体进入地下发育阶段,此阶段鳞茎中淀粉含量呈波动变化,且变化幅度剧烈,7月6日至9月22日之间淀粉含量下降迅速,10月30日显著回升后又下降。
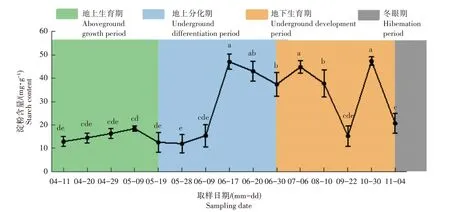
图3 猪牙花更新芽年发育进程中鳞茎淀粉含量变化Figure 3 Change in content of starch in bulb during the annual growth and development of renew bud of E.japonicum
2.3 猪牙花更新芽年生育进程中鳞茎可溶性总糖含量的变化
由图4可知,鳞茎可溶性总糖含量在整个更新芽地上生育期内呈波动变化,5月9日盛果期含量最高,生育末期(5 月19 日)次之,二者之间无显著差异,但与其他发育阶段相比差异显著(p<0.05)。随后在5 月28 日鳞茎开始分化更新芽时陡然下降,在整个更新芽分化期,鳞茎内可溶性总糖含量逐渐升高,在雌蕊分化期(6月30日)时达到该发育阶段的最高值。更新芽分化完成后鳞茎可溶性总糖含量又急剧下降,在7月6日含量最低,随后波动上升,到11月4日进入冬眠期时含量达到地下发育期的最高水平。

图4 猪牙花更新芽年发育进程中鳞茎可溶性总糖含量变化Figure 4 Change in content of total soluble sugar in bulb during the annual growth and development of renew bud of E.japonicum
2.4 猪牙花更新芽年生育进程中鳞茎可溶性蛋白含量的变化
由图5 可知,更新芽地上生育期阶段,鳞茎可溶性蛋白含量呈波动变化,于5 月9 日盛果期含量最高,5 月19 日生育末期含量显著下降(p<0.05)。在猪牙花更新芽分化阶段鳞茎可溶性蛋白含量呈先上升后下降的趋势变化,于雄蕊分化期(6 月20 日)含量达到最高,雌蕊分化期时可溶性蛋白含量较雄蕊分化期显著下降(p<0.05)。进入更新芽地下发育阶段后,鳞茎可溶性蛋白含量整体呈上升趋势,9月22日以后维持在较高的水平。

图5 猪牙花更新芽年发育进程中鳞茎可溶性蛋白含量变化Figure 5 Change in content of soluble protein in bulb during the annual growth and development of renew bud of E.japonicum
3 讨论与结论
试验结果表明,猪牙花更新芽地上生长期短暂,约为40 d,在展叶、开花、结实过程中,地下鳞茎进行更新,新鳞茎膨大,积累地上叶片光合作用产生的营养,在地上部枯萎死亡时代替母鳞茎。猪牙花更新芽的形态发生是在地上部枯萎后开始的,鳞茎不经夏眠而是直接进行更新芽的分化,约1 个半月形态分化完成,随即进行各器官的发育,到11月4日土壤上冻时,更新芽发育成熟,进入冬眠。这一结果与同为早春类短命植物的伊贝母[18-19]、新疆贝母[18]及郁金香[20-21]研究结果一致。
淀粉是猪牙花鳞茎的主要贮藏性碳水化合物,在猪牙花更新芽的分化、发育过程中起到营养物质“源”的作用。本试验研究发现猪牙花鳞茎在更新芽地上生育期阶段,淀粉含量在初花期、盛花期、初果期含量较低,增长缓慢,而盛果期时含量最高,生育末期含量又快速下降。其原因可能为:一是生育前期受环境条件、叶面积等因素影响,叶片光合同化能力不强,积累养分速度慢;二是初花期新鳞茎已开始更新生长,需要消耗淀粉,在盛果期时叶面光合能力增强,新鳞茎也已完成更新,所以鳞茎贮藏的淀粉会显著增加;而在生育末期时,叶片衰老及林冠层郁闭、光照减弱导致叶片光合能力下降,同时果实快速发育需消耗大量贮藏淀粉,所以造成生育末期鳞茎淀粉含量快速下降。在更新芽地下分化阶段,鳞茎淀粉含量在分化中后期(花被分化期、雄蕊分化期、雌蕊分化期)含量处于较高水平,这一结果与孙乃波等[22]在草莓花芽分化过程中叶片淀粉含量变化及汪晓谦等[23]在郁金香花芽分化过程中鳞茎淀粉含量的变化趋势基本一致。更新芽进入地下发育期后,鳞茎淀粉含量下降迅速,可能与更新芽快速发育消耗有关。9月22日以后鳞茎淀粉含量处于较低的水平,可能与大量淀粉分解为可溶性糖以提高细胞液的浓度来抵御低温有关。
可溶性总糖是鳞茎可以直接利用和运输的养分存在形式,是植物生理变化过程的重要代谢产物,其含量反映植物体内可利用物质和能量的供应基础[24]。本试验结果表明,在猪牙花更新芽地上生育周期中,盛果期鳞茎可溶性总糖含量明显升高,其原因可能与调节果实发育有关。在更新芽地下分化期刚开始时,鳞茎可溶性总糖含量相比于地上生育末期含量陡然下降,随分化进程的推进含量又逐渐升高,说明鳞茎在更新芽分化刚开始时代谢最旺盛,大量可溶性糖被消耗,其原因可能与鳞茎是更新芽分化所需营养的“库”有关,这一结果与张绿萍等[25]研究发现,莲雾花芽分化过程中叶片碳水化合物含量显著下降一致。更新芽分化完成后鳞茎可溶性总糖含量又急剧下降,而后波动上升,到11月4日含量达到地下发育期的最高水平,出现“低温糖化”现象,其原因可能与鳞茎通过调节可溶性总糖含量增加细胞质浓度,使冰点降低,防止细胞内结冰和冻害的发生有关[26-27]。
可溶性蛋白质作为一种结构物质,对各种物质的合成起到重要作用,是器官形态建成的物质基础。在植物花芽分化过程中常伴随蛋白质合成过程的增强[28]。本研究结果表明,在更新芽形态分化期间鳞茎可溶性蛋白质含量呈增加的趋势,说明可溶性蛋白与可溶性糖均是猪牙花更新芽分化的重要营养物质。更新芽地下发育期鳞茎可溶性蛋白含量整体呈上升趋势,9月22日以后维持在较高的含量水平,可能与植物对低温伤害的防御性生理响应有关。
综上所述,猪牙花更新芽年生育进程可分为4个时期,分别为地上生育期、地下形态分化期、地下形态发育期、冬眠期。猪牙花鳞茎营养物质含量随年生育进程的推进而不断调节,在更新芽地上生育期的盛果期时鳞茎营养物质含量大量积累,而在更新芽地下分化期营养物质消耗较大,更新芽地下发育期间,营养物质含量呈波动变化,可溶性总糖和可溶性蛋白含量在冬眠前含量处于较高的水平。

