富铁镍渣煤基氢冶金等温还原动力学研究
李 彬, 孙明轩, 王明华, 雷鹏飞, 王 晟, 杜雪岩*
(1. 兰州理工大学 材料科学与工程学院, 甘肃 兰州 730050; 2. 兰州理工大学 省部共建有色金属先进加工与再利用国家重点实验室, 甘肃 兰州 730050; 3. 酒泉钢铁(集团)有限责任公司 氢冶金研究院, 甘肃 嘉峪关 735100)
镍渣是镍冶炼过程排放的固体废弃物.硫化镍矿冶炼渣中全铁(TFe)品位高达30%~40%,同时还赋存Ni、Co、Cu、Mg等有价金属元素[1].从资源化角度来看,富铁镍渣可以视为一种极具价值的“铁矿资源”.目前我国镍渣综合利用率较低,大部分镍渣被堆存在渣场,不仅使渣中赋存的金属资源闲置浪费,还造成土地占用、环境污染等一系列社会问题[2].富铁镍渣中铁资源的高效回收是提高镍渣综合利用率的关键,也是企业和区域绿色可持续发展亟待解决的“瓶颈”难题.
熔融还原和直接还原是镍渣还原提铁常用的两种工艺手段.熔融还原主要以焦炭为还原剂,还原温度1 400~1 600 ℃,虽然其还原率高,还原时间短,但产出的铁水杂质含量较高,限制了其后继再利用.直接还原是将镍渣粉与煤粉混合制球后在1 000~1 300 ℃还原焙烧,可获得还原度较高的金属化球团,其工艺简单,还原铁粉品质较好、杂质较少,但还原时间较长,效率低,最终铁收率不稳定.因此,镍渣提铁研究目前还局限在实验室研究,并没有形成成熟、经济的可工业化技术,从镍渣中高效、经济地回收铁资源仍然是一个挑战.
相比于传统铁还原技术,煤基氢冶金工艺[9]是一种在回转窑或转底炉设备中直接还原含铁物料的新型炼铁技术,该工艺以高挥发分煤作为还原剂,将碳冶金成熟、简单的工艺过程和氢冶金高效的还原效率有机结合,非常适用于处理富铁冶金渣、贫矿和尾矿等含铁物料.在煤基氢冶金还原过程,高挥发分煤热解释放出H2和CO还原性气体,同时释放的烷、炔、烃等高分子有机气体在高温下会二次热解而再次释放出H2,从而在回转窑或转底炉等相对封闭的环境中形成H2-CO混合的还原性气氛,这种H2-CO混合还原介质有助于提升球团金属化率和还原效率[10-11].然而目前研究者对于传统碳还原的过程机理研究较多,对于H2-CO混合气基还原过程也主要关注于C还原介质的贡献[12-13],而对H2还原介质的还原作用仍不明晰,对于煤基氢还原过程的试验研究和机理探索更是鲜有报道.
本文采用煤基氢冶金工艺对镍渣进行了等温还原,研究了热装条件下不同等温还原过程掺煤镍渣球团金属化率的变化规律,并利用未反应核模型对镍渣球团的煤基氢还原动力学过程进行分析讨论,明确了还原各阶段的控速因素和机理,建立了还原动力学方程,验证了利用煤基氢冶金工艺进行镍渣还原提铁的技术可行性.
1 实验
1.1 实验原料
实验镍渣为金川集团镍冶炼厂闪速炉水淬渣,全铁(TFe)含量36.74%,渣中铁元素主要以铁橄榄石(Fe2SiO4)形式赋存.镍渣的化学成分见表1,物相分析如图1所示.还原剂采用新疆广汇煤,工业分析表明(见表2)其干燥基挥发质量分数45.34%,固定碳质量分数43.26%,是一种典型的高挥发分煤.造球剂使用实验室分析纯Na2CO3和钠基膨润土.

表2 广汇煤的工业分析
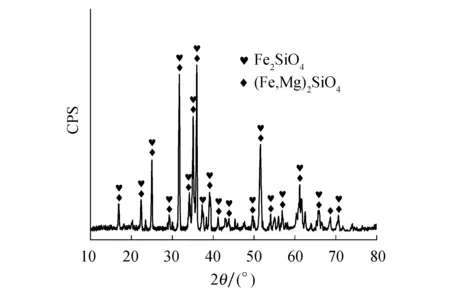
图1 镍渣的XRD图谱

表1 镍渣的化学成分
1.2 实验过程
采用击环式破碎机将镍渣和广汇煤粉碎至粒径小于74 μm.以100∶27的渣煤比混合均匀,配入适量造球剂和水,制备粒径为12~14 mm的掺煤镍渣球团.实验在竖式管式炉中进行.首先,以10 ℃/min的升温速率将电阻炉加热至设定还原温度,实验共设定5个等温还原焙烧温度,温度1 200~1 300 ℃,间隔25 ℃.当升温至1 000 ℃时,开始用流量2 L/min的氮气从管式炉底部连续吹扫炉管,达到设定还原温度后氮气流量降至0.5 L/min.在设定的还原温度下,将装有掺煤镍渣球团的石墨坩埚迅速挂入管式炉中进行等温还原焙烧,并开始计时,经过一定时间(3~60 min)等温还原后取出坩埚,在球团表面覆盖残碳,然后置于密闭空间冷却至室温,取出样品进行表征.煤基氢还原实验装置如图2所示.

图2 煤基氢还原实验装置示意图
试验前采用高温测温环(FERRO, PTCR-STH型)对电阻炉工作温度进行校正.冷态坩埚吊装后会使炉内温度降低约50 ℃,在保温4~5 min后可恢复至目标设定温度,小范围的温度波动不会对球团初始反应产生明显的影响.
1.3 表征检测
金属化率(MR)表示镍渣球团中铁组元的还原程度,可由式(1)计算:
(1)
式中:M1为球团中金属铁质量分数;M2为球团中总铁质量分数.采用重铬酸钾滴定法测定样品中总铁和金属铁的含量,采用电感耦合等离子体发射光谱法(ICP-OES,ThermoFisher ICAP-7400)测定样品其他元素含量.携带能谱仪的场发射扫描电子显微镜(SEM-EDS, JEOL JSM-6700F)用于表征样品微观形貌和微区化学成分.
2 结果与讨论
2.1 微观形貌与成分分析
图3a、b分别给出了未还原镍渣球团和1 300 ℃还原20 min后镍渣球团的内部形貌SEM图像.可以看出,在图3a中未经还原焙烧的镍渣球团由很多微小颗粒组成,这是渣粉和煤粉混合的原始形貌.而在1 300 ℃等温还原焙烧20 min后,球团中出现了很多圆形颗粒,其粒径从纳米级至5 μm,如图3b所示.经过还原焙烧,镍渣球团内部形貌发生了明显变化,对焙烧后球团内部生成的小颗粒及球团基体进行能谱(EDS)分析,其化学元素组成在表3中列出.A点为球团中生成的小颗粒,其中Fe元素质量分数为84.7%,可以确定这是镍渣还原所形成的金属小铁珠;B点为球团基体相,由化学成分判断主要为硅酸盐相和残碳.微观形貌和微区成分分析表明,经1 300 ℃还原焙烧20 min后镍渣中的铁已被还原为单质铁.

图3 镍渣球团的SEM形貌图像

表3 还原20 min镍渣球团的能谱(EDS)分析
2.2 金属化率
镍渣球团在不同温度下等温还原的金属化率随时间的变化如图4所示.由MR曲线可知,球团还原主要发生在0~30 min,此阶段MR曲线随时间增加急剧升高, 30~60 min 的MR曲线增长趋势明显趋于平缓,此时反应已处于末期.在1 300 ℃下反应20 min球团的MR值就已达到90.2%,还原60 min后的MR值为94.3%,仅比20 min时提高了4.1%.还原温度对球团金属化率影响显著,图中MR曲线随着温度增加逐渐向上移动.温度越高球团MR值越大,还原30 min时1 200 ℃下的MR值为70.93%,而1 300 ℃下MR值为91.51%,增长了20.98%,这表明升高温度有利于加速还原反应的进行.

图4 掺煤镍渣球团在不同温度还原焙烧的金属化率随时间的变化
2.3 等温还原动力学分析
通常采用粒子模型(grain model)来研究多孔球团的气固反应动力学[14-16].粒子模型适用于由细微颗粒组成、具有多孔结构的物料球团,但其忽略了细微颗粒的自身反应过程,而主要关注了气相在多孔结构孔道中的宏观扩散过程,这种扩散阻力存在于气相由外向内扩散的过程[17-18].文中的掺煤镍渣球团具有多孔球团特征,但其还原过程与常规的球团冶金过程有所差异,即还原性气体产自球团内部,还原气通过球团孔隙由内向外逸出,此时气体在多孔球团中的扩散阻力可忽略不计.因此,粒子模型已经不适用于本文所研究的还原过程.而忽略气体在球团孔隙中的扩散阻力之后,掺煤镍渣球团的还原反应过程就可以简化为组成球团的微小颗粒与还原气体之间的气固反应过程,这正好符合经典未反应核模型(unreacted core shrinking model)[14].两种模型在掺煤镍渣球团煤基氢还原过程的应用分析如图5所示.

图5 掺煤镍渣球团煤基氢还原过程的粒子模型和未反应核模型
在未反应核模型中,颗粒的外层为反应生成物,内部为未反应物,化学反应发生在二者界面上.气-固反应过程包括3个步骤[19]:气体扩散至颗粒表面(外扩散)、气体扩散至反应界面(内扩散)、气-固两相在界面发生化学反应(界面化学反应).假设固相颗粒为三维球体,反应过程中球体体积不变,通过几何推导可得出上述3个步骤还原度(α)与时间(t)的关系[20-21]:
外扩散:
(2)
内扩散:
(3)
界面化学反应:
(4)
式中:α表示还原程度,在文中即球团金属化率;t为反应时间;r0是颗粒初始半径;ρs是固相密度;b是反应平衡时的气固摩尔比;Cg是气相初始浓度;Ms是固相的摩尔质量;kg是气体传质系数;Deff是有效扩散系数;krea是化学反应速率常数.
由模型可知,掺煤镍渣球团煤基氢还原过程的外扩散阻力可以忽略不计,因此还原反应的表观过程主要受内扩散阻力和界面化学反应阻力控制,而在未反应核模型气固反应过程中,初期通常以界面化学反应控制为主,中期和末期以内扩散或化学反应-内扩散混合控制为主[22].
将kd和kr分别定义为内扩散和界面化学反应的表观反应速率常数:
则式(3,4)可变换为
内扩散:
(7)
界面化学反应:
(8)
而对于化学反应-内扩散混合控制过程,还原度(α)与时间(t)的关系可表示为[23]:
(9)
将图4中的时间-金属化率数据代入式(8)进行线性拟合发现,1-(1-α)1/3和t在还原反应初始阶段具有很好的线性相关性,线性相关系数R均在0.98以上,如图6所示.这说明在反应初期,还原过程受界面化学反应控制.从线性拟合图中还可以看出,随着还原温度的降低,反应初期受界面化学反应控制的时间周期逐渐增加,由1 300 ℃下0~9 min增加至1 200 ℃下0~20 min.线性拟合的斜率表示化学反应的表观反应速率常数(kr),可见其随还原温度的降低而减小.
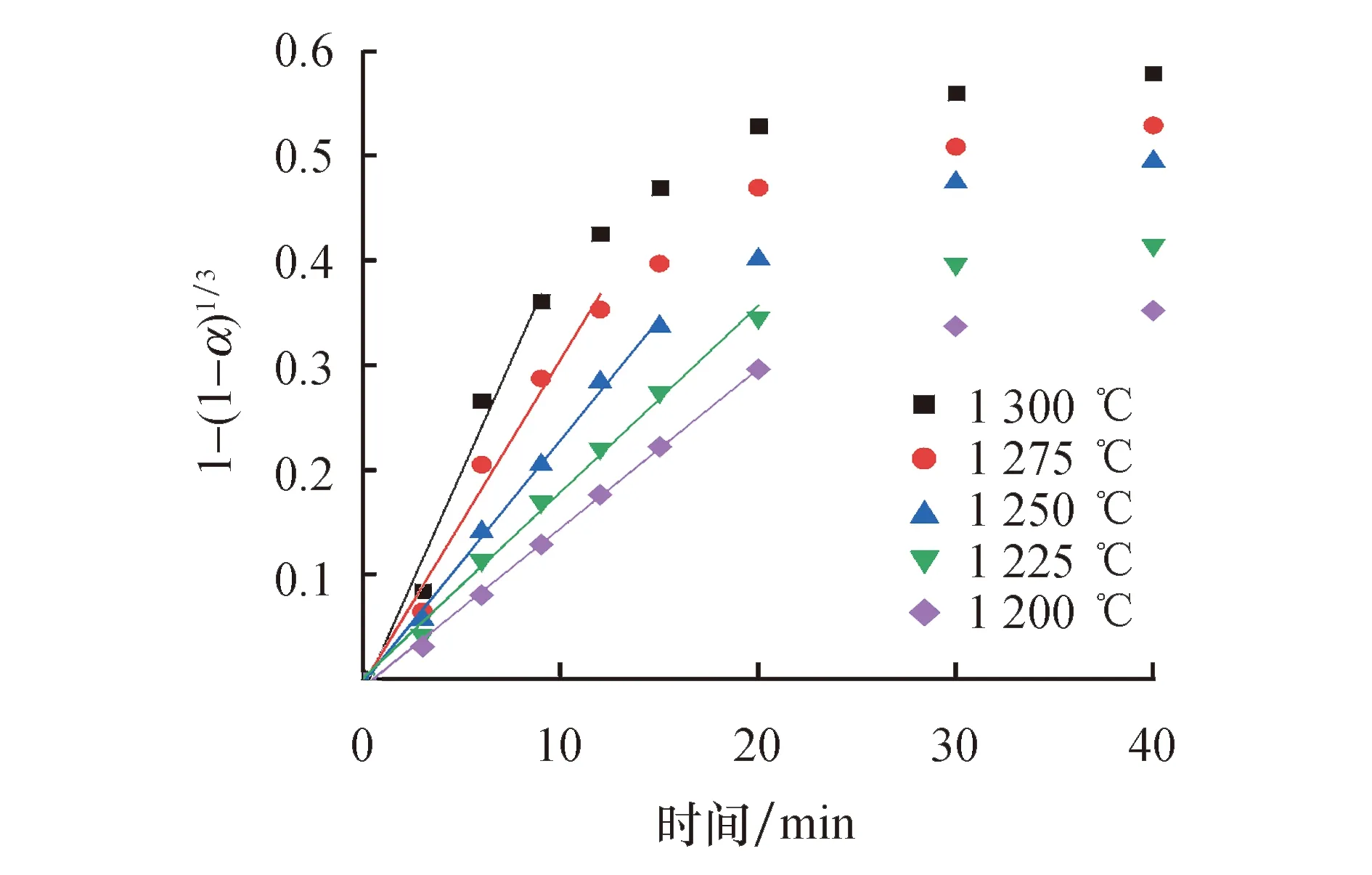
图6 不同温度下1-(1-α)1/3和t的线性拟合
将图4中的数据代入式(7)进行线性拟合,1-2α/3-(1-α)2/3和t在还原反应的末期阶段表现出良好的线性相关性,R值均高于0.98,如图7所示.这表明还原反应末期的动力学过程主要受内扩散控制.图中不同温度下线性拟合直线的斜率相差不大,表明还原温度对于内扩散控速下的表观反应速率(kd)影响并不显著.

图7 不同温度下1-2α/3-(1-α)2/3和t的线性拟合
对于反应过程由内扩散和界面化学反应混合控制的情况,将式(9)两边同时除以1-(1-α)1/3得:
(10)
将图4中的数据代入式(10)进行线性拟合发现,t/[1-(1-α)1/3]和[1-2α/3-(1-α)2/3]/[1-(1-α)1/3]在1 250~1 300 ℃条件下的9~20 min反应时间段表现出较好的线性相关性,而在1 200~1 250 ℃线性相关性较差,如图8所示.表明在1 250~1 300 ℃条件下的9~20 min反应时间段还原反应受内扩散和界面化学控速混合控制.结合图6分析,在1 200~1 250 ℃条件下,9~20 min时间段还原反应过程主要还是受界面化学控制,混合控制并不占主导作用.
定义km为混合控制步骤的表观反应速率常数.在平衡状态下,km可由式(11)表示.这样,通过求解图7中拟合直线的斜率(1/kd)和截距(1/kr)就可计算出混合控制过程的表观反应速率(km):
(11)
还原反应各阶段的表观反应速率常数(k)与热力学温度(T)满足Arrhenius方程[24-25]:
(12)
其中:A为指前因子;Ea为反应表观活化能;R为气体常数.
由图6~图8中拟合计算得到kr、kd、km值,分别将不同反应阶段对应的lnk与1/T做线性拟合,得到反应初期 (界面化学反应控制)、反应中期 (内扩散与界面化学反应混合控制)和反应末期(内扩散控制)的表观活化能Ea分别为174.01、124.15、83.14 kJ/mol,如图9所示.

图8 不同温度下t/[1-(1-α)1/3]和[1-2α/3-(1-α)2/3]/ [1-(1-α)1/3]的线性拟合

图9 不同还原阶段ln k和10 000/T的线性拟合
依据图9中的拟合直线斜率和截距求得Ea和lnA,建立了掺煤镍渣球团煤基氢冶金还原过程不同阶段的还原动力学方程.
反应初期(界面化学反应控速):
(13)
反应中期(界面化学反应和内扩散混合控速):
(14)
反应末期(内扩散控速):
(15)
3 结论
1) 煤基氢冶金工艺可对富铁镍渣进行高效还原.在1 300 ℃等温还原20 min,掺煤镍渣球团金属化率可达90.2%.
2) 采用未反应核模型对掺煤镍渣球团的煤基氢冶金还原过程进行动力学分析,整个还原过程分为反应初期、中期、末期3个阶段,各阶段动力学过程分别受界面化学反应控制、化学反应-内扩散混合控制和内扩散控制,反应表观活化能Ea分别为174.01、124.15、83.14 kJ/mol.

