黄孢原毛平革菌联合生物炭对鸡粪好氧堆肥木质素降解和腐熟度的影响
翟森茂, 毛欣宇, 陈 星, 匡 伟, 王润之, 邵孝候
(1.河海大学农业科学与工程学院,江苏南京 211000; 2.江苏省科协农村技术服务中心,江苏南京 210098;3.南京市畜牧家禽科学研究所,江苏南京 211000)
随着我国养殖业的规模化发展,每年产生的畜禽废弃物高达38亿t,其中畜禽粪便约为15亿t,约占畜禽废弃物总量的39.5%[1]。其中,鸡粪作为一种固体有机废物,由于富含有机质和氮、磷、钾等营养物质成为农业有机肥生产的重要原材料[2]。好氧堆肥技术作为固体废弃物资源化利用的主要方式之一,能将粪便中可降解的生物有机质转化为稳定、有益、可供植物利用的腐殖质[3]。在堆肥过程中,如何加速堆体腐殖化进程并提高其腐殖质含量是畜禽粪便肥料化处理中的关键科学问题,而木质素的高效降解则是解决这一问题的重要研究内容。研究表明,木质素的降解可促使酚类化合物的形成,根据酚-蛋白质理论,酚类化合物被认为是腐殖质形成的重要前体[4],是促进腐殖质形成的关键物质。因此,木质素的降解过程也是堆肥腐熟的限速步骤。
木质素由于具有复杂的芳香性结构和高度支化的聚合物网络,其降解难度大[5]。近年来,关于好氧堆肥过程中真菌对木质素降解的促进作用已有较多研究。降解木质素的真菌主要有黄孢原毛平革菌、褐腐菌和软腐菌,尤以黄孢原毛平革菌在木质素降解方面的应用最为常见。马丽婷等研究发现,在堆肥降温期接种黄孢原毛平革菌可促进鸡粪堆肥过程中木质素的深度降解[6];Khatami等研究发现,黄孢原毛平革菌可诱导木质素中的芳香环氧化,加快木质素的降解[7];You等研究发现,褐腐菌可优先降解木质素中的愈创木基,加快木质素的降解[8];Brozonova等研究发现,担子菌(basidiomycetous)可有效降解木质素[9]。
大量研究发现,添加生物炭可影响堆肥的腐殖化进程,堆肥的腐殖化进程受温度、pH值、总有机碳(TOC)含量和氨基酸含量等因素的影响。Wang等研究发现,在食物垃圾堆肥中,生物炭可延长堆肥高温期时间,加快堆肥腐殖化,缩短堆肥时间[10];李安等研究发现,生物炭可提高堆体的pH值,加快堆体的腐殖化[11];Jiang等在城市污泥堆肥中发现,生物炭可有效提高TOC的降解,加快堆体腐殖化[12];Yang等在猪粪与大豆渣的堆肥中发现,生物炭可促进堆体中碳水化合物和氨基酸的降解,提高堆体腐熟度[13]。
目前,以生物炭和真菌作为添加剂,其耦合效应对堆肥木质素降解和腐熟进程的影响还鲜有报道。因此,本试验以鸡粪和稻壳为堆肥原料,分析生物炭联合黄孢原毛平革菌对堆体基本理化性质、木质素降解和腐熟度的影响,并结合微生物群落结构演替与环境变量的相关性分析,深入解析生物炭联合黄孢原毛平革菌对木质素降解及腐殖化进程的影响,以期为进一步推动好氧堆肥技术的发展提供理论依据。
1 材料与方法
1.1 试验材料
堆肥试验于2022年5月在南京市畜牧家禽科学研究所进行,堆肥主要原料为新鲜鸡粪和稻壳。新鲜鸡粪和稻壳取自南京市畜牧家禽科学研究所,稻壳自然风干,粉碎成2~3 cm小段,备用。接种微生物为黄孢原毛平革菌属(原始编号为NDM3-2,原产地在美国),购自北京保藏生物科技有限公司。生物炭购自平顶山市炭诺环保材料有限公司,由玉米秸秆在600 ℃的缺氧条件(氮气吹扫)下热解制得。鸡粪、稻壳和生物炭基本理化性质见表1,堆肥试验在30 cm×20 cm×20 cm的泡沫箱中进行。

表1 堆肥原材料基本理化性质
1.2 试验方法
试验设置1个对照和3个处理。空白对照(CK)和各处理中鸡粪与稻壳按质量比4 ∶1均匀混合,混合物质量为20 kg。T1处理添加10%(物料干质量)的生物炭,T2处理设置接种0.3%(物料湿质量)的黄孢原毛平革菌,T3处理设置联合添加10%(物料干质量)的生物炭与0.3%(物料湿重)的黄孢原毛平革菌。采用去离子水调节各处理的初始含水率至65%左右,开展堆肥试验,采用手动翻堆通风,翻堆频率为1次/5 d。堆肥周期设置为35 d,每天16:00测量堆体中心温度,分别在0、1、4、7、14、21、28、35 d取样。在每个采样日分别从堆体的上部、中部和下部收集样品,并混合得到1个组合样品。样品一式4份,一份于采样当天测定含水率;一份于 4 ℃冰箱中冷藏,并在堆肥结束后测定腐熟度指标[腐殖质(HS)、胡敏酸(HA)、富里酸(FA)、pH值、种子发芽指数(GI)];一份自然风干14 d以上,研磨过100目筛后用于测定总碳(TC)、总氮(TN)、TOC以及木质素的含量;另一份真空包装,在 -80 ℃ 冷冻储藏,用于ITS1-rRNA测序和后续分析。CK组和处理组各设置3次重复。
1.3 测定项目
温度由电子温度计(TP101,创新,深圳)测定。用干质量法测定含水率。取堆肥新鲜样品与蒸馏水混合(固液比为1 g ∶10 mL)振荡浸提30 min,静置 30 min 后过滤,pH值的测量采用多参数分析仪(DZS-706-A,雷磁,上海)对滤液进行测定。GI的测定:取上述水浸提液10 mL放入铺有滤纸的培养皿中,均匀放入10粒白菜(BrassicacampestrisChinesis)种子,置于25 ℃的培养箱(DHP9040,苏珀,浙江)中避光培养 72 h,测定种子根长和种子发芽率。TC和TN含量的测定采用元素分析仪(FlashSmart,Sisher)。TOC含量的测定采用Ren等的测定方法[14]。腐殖质组分(HS、HA、FA)的测定参照Zhou等的方法[15]进行,HA与FA之比即为胡富比(H/F)。木质素含量的检测采用van Soest等的测定方法[16]。真菌群落组成的测定由天根生化科技(北京)有限公司完成。
1.4 数据处理
作图使用 Origin 2018 完成,显著性差异分析使用 SPSS 24完成,微生物和环境因子的相关性分析使用R软件(Version2.15.3)5.0 完成。
2 结果与分析
2.1 堆肥过程中理化指标及种子发芽指数的变化
由图1-a可知,各处理的温度变化均经历了升温期、高温期和腐熟期3个阶段,并均在堆肥2 d进入高温期(>50 ℃)。除CK外,其余处理的堆体温度均出现≥70 ℃的现象,在5 d进行翻堆之后,各处理堆体均呈现升温趋势,其中以T1处理最为明显,温度由50 ℃升高至70 ℃,随后在8~28 d温度逐渐降低至环境温度30 ℃左右。堆肥过程中,T1、T2、T3处理的高温期持续时间为6~8 d,符合《粪便无害化卫生要求》[17]。堆体的含水率变化如图1-b所示,0~14 d,各处理含水率整体呈明显下降趋势,后逐渐趋于平缓,至堆肥结束时,CK、T1、T2和T3处理的含水率分别下降至51.16%、38.70%、43.55%、41.10%。
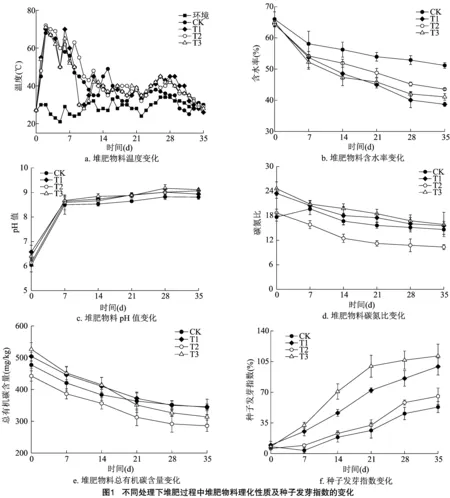
堆肥过程中pH值的变化如图1-c所示。CK、T1、T2和T3处理的初始pH值分别为6.04、6.58、6.14和6.41。在堆肥0~7 d各处理的pH值急剧上升,随后pH值升高速率减缓。堆肥结束时,CK、T1、T2和T3处理的pH值分别上升至8.81、8.93、9.07和9.11,各处理pH值无明显差异,符合堆肥产品呈弱碱性的要求[17]。
堆肥过程中C/N的变化如图1-d所示,CK的C/N呈先上升后下降的趋势,其他处理的C/N呈逐渐下降的趋势。至堆肥结束时,CK、T1、T2和T3处理的C/N分别由堆肥当天的17.67、23.46、18.67和24.61降至14.62、15.56、10.34和15.85。一般认为,堆肥结束时,堆体C/N低于20可确定堆体腐熟[18]。故CK和各处理均达到了腐熟标准。
总有机碳(TOC)含量的变化如图1-e所示。可以看出,0~14 d期间,各堆体的TOC含量明显下降,随后下降趋势趋于平缓。至堆肥结束时,CK、T1、T2、T3处理的TOC含量分别由堆肥当天的477.35、504.21、442.41、526.57 mg/kg下降至343.84、345.34、285.71、313.78 mg/kg,TOC降解率分别为27.97%、31.51%、35.42%和40.41%,与前人的研究结果[19-20]一致。结果表明,与其他处理相比,生物炭与黄孢原毛平革菌的联合添加可有效降解TOC。
堆肥过程中GI的变化如图1-f所示。可以看出,随着堆肥的进行,GI值整体呈上升趋势,堆肥结束时,CK、T1、T2和T3处理的GI分别上升至53.09%、99.32%、65.40%和111.40%。统计分析结果表明,各处理的GI显著高于与CK(P<0.05),一般认为,70%
2.2 堆肥过程中木质素与腐殖质的含量变化
图2为不同处理堆肥过程中木质素的含量变化,整体呈先上升(0~7 d)后下降(7~35 d)的趋势,这与Wang等在猪粪和锯末共堆肥中的研究结果[22]一致。这是由于相较于木质素,堆体中糖类、蛋白质、半纤维素、纤维素等有机化合物更易降解,在堆肥前期可被微生物优先利用[23],加之作为木质素降解主体的真菌在前期高温条件下活性较低[7],进而导致堆肥早期木质素相对富集。木质素下降趋势在堆肥21~35 d更为明显,到堆肥结束,CK、T1、T2和T3处理的木质素含量分别由堆肥当天的52.91%、50.27%、51.34%和52.66%分别下降至44.73%、39.16%、43.08%和37.80%,降解率分别为15.46%、 22.10%、16.09%和28.22%。统计分析结果表明,T3处理的木质素降解率显著高于其他处理,这可能是因为堆肥后期温度下降,以黄孢原毛平革菌为主体的木质素降解真菌在生物炭的促进作用下,丰度和活性得到大幅提升,优先分解木质素的芳基甘油-β-芳基醚键[5],进而加速了木质素的降解进程。

图3为不同处理堆肥过程中HS含量、HA含量、FA含量和H/F的变化结果, 各组的HS含量在0~7 d迅速增加,随后呈下降趋势。堆肥结束时,CK、T1、T2、T3处理的HS含量分别由堆肥当天的30.87、31.05、31.36、31.15 g/kg上升至34.18、36.55、38.22、40.33 g/kg,增幅分别为10.72%、17.71%、21.88%、29.47%。前期HS含量上升是由于堆体中有机质的分解促进了醌类、酚类等HS前体化合物[24-25]的形成,并进一步生成HS,而后期堆体微生物新陈代谢对HS的利用[26]是其含量下降的原因。此外,各组HA含量变化趋势相似,均呈逐步上升趋势,堆肥结束时,CK、T1、T2、T3处理的HA含量分别由堆肥当天的7.83、8.01、8.32、8.11 g/kg 增加至10.29、14.60、18.09、20.49 g/kg,增幅分别为31.42%、82.27%、117.43%、152.65%。说明生物炭和黄孢原毛平革菌的联合添加可以显著促进HA的合成。
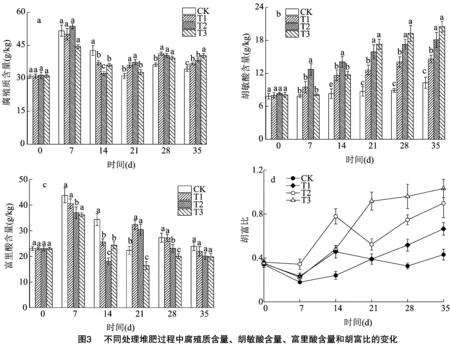
由图3-c可知,各组FA含量均呈先上升后下降趋势。0~7 d内,CK、T1、T2、T3处理的FA含量由初始阶段的23.04 g/kg分别增加到43.79、40.57、37.07、36.24 g/kg。堆肥结束,CK、T1、T2、T3处理的FA含量分别下降至23.89、21.95、20.13、19.84 g/kg,说明生物炭和黄孢原毛平革菌均可减少堆体中的FA含量。H/F是反映腐殖化产物的聚合度和评价堆肥腐熟度的重要指标[27]。由图3-d可知,H/F在35 d内总体呈增加趋势,堆肥结束时,CK、T1、T2、T3处理的H/F分别从堆肥当天的0.35、0.34、0.36、0.35增加到0.43、0.67、0.90、1.03,表明生物炭和黄孢原毛平革菌的联合添加可有效提高堆肥聚合度。
2.3 微生物与理化因子的相关性分析
由图4可知,在门水平上,原始物料中的优势真菌为子囊菌门(Ascomycota)(41.47%),在属水平上为Kazachstania、Diutina。堆肥1 d,T1和T2处理的优势真菌在门水平上为子囊菌门(97.52%和84.62%),在属水平上为莫氏黑粉菌属(Moesziomyces)、Kazachstania、Diutina,这与大多数研究结果一致。研究发现,子囊菌门在牛粪与玉米秸秆堆肥中的相对丰度超过90%[28],在水稻秸秆堆肥中超过77.58%[29];而T3处理的优势真菌为子囊菌门(13.22%)和担子菌门(Basidiomycota)(14.48%),在属水平上为莫氏黑粉菌属(Moesziomyces)、Diutina。堆肥结束时,门水平上,堆体的优势真菌为子囊菌门,在CK、T1、T2和T3处理的占比分别为78.36%、88.09%、46.07%和81.89%;属水平上,堆体的优势真菌为曲霉属(Aspergillus)、微囊菌属(Microascus)、木霉属(Trichoderma)、Kazachstania和Diutina。
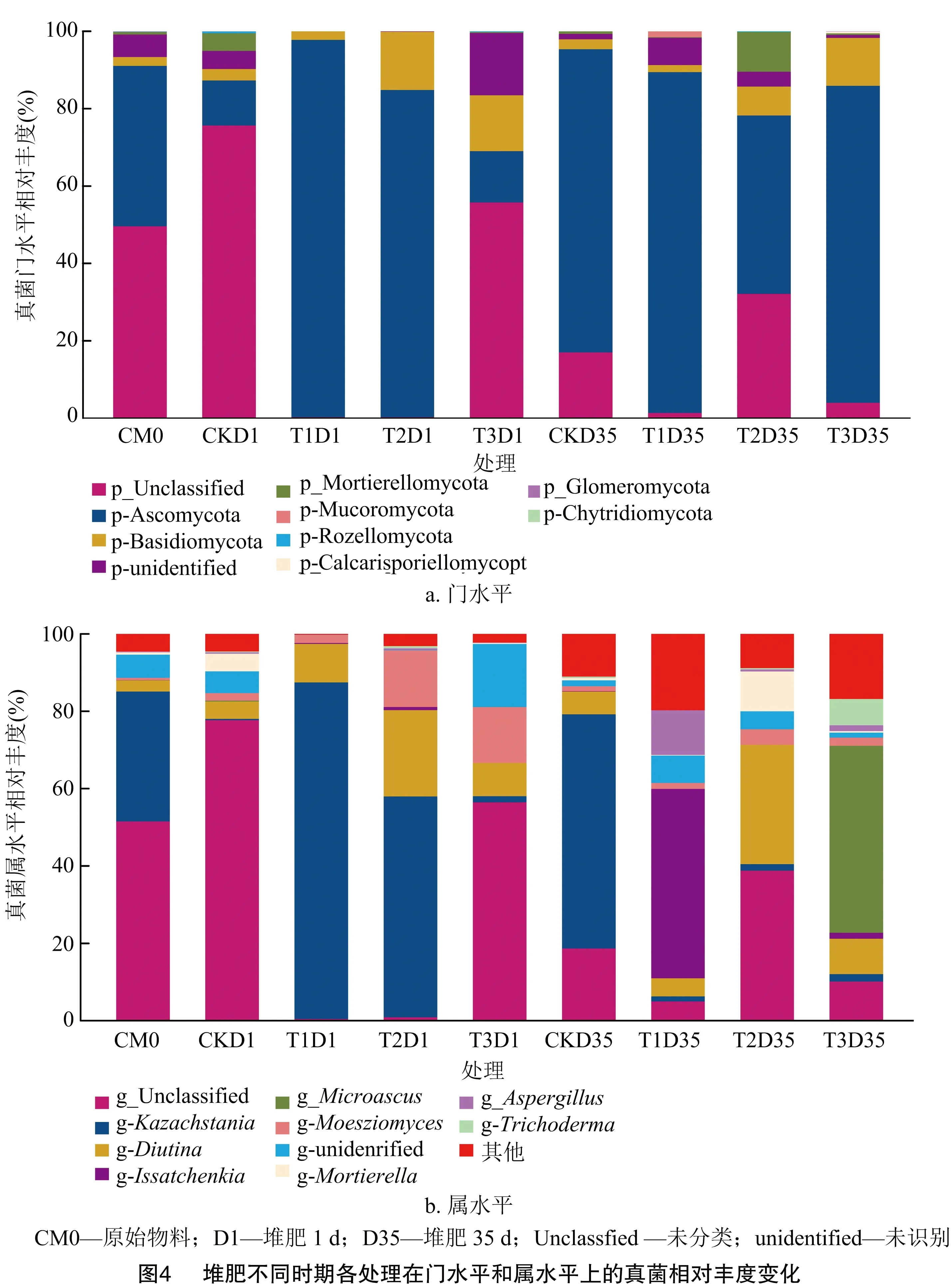
微生物与理化因子的相关性分析(图5)表明,含水率与子囊菌门呈负相关性,子囊菌门与木质素含量呈负相关性,Calcarisporiellomycota与HS含量、HA含量、GI具有正相关性,与H/F具有显著正相关性(P<0.05)。说明含水率的降低可提高子囊菌门的丰度,促进木质素降解;Calcarisporiellomycota丰度的提高可促进HS与HA的形成,提高堆体的H/F和GI。总体而言,微生物因素影响着堆体中的木质素含量,并推动了堆肥的腐殖化进程。

3 讨论
本试验通过设置1个空白对照和3个处理研究发现,生物炭与黄孢原毛平革菌的联合添加是促进木质素降解的最有效方式。试验发现,CK和处理的pH值均在0~7 d呈上升趋势,这主要是因为温度升高致使堆体中部分氮素以铵态氮的形式挥发[30]。7~35 d,由于NH3和CO2的大量释放以及有机质的降解,堆体的pH 值逐渐趋于稳定[30],至堆肥结束时,堆体的pH稳定在8.64~8.90。C/N是反映堆肥腐熟程度的重要指标之一。本试验中,CK的 C/N 呈先上升后下降的趋势,T1、T2和T3处理的 C/N呈逐渐降低的趋势。张鹤等在牛粪与玉米秸秆的堆肥中观察到类似的现象[31],程亚娟等在C/N对鸡粪堆肥腐熟指标的影响研究[32]中也得出相似的结论。至堆肥结束时,CK和处理的C/N降至10.34~15.85,均达到了腐熟标准。TOC含量的变化反映了堆肥中矿化和腐殖化的程度,并显著影响堆肥质量[33]。本试验中所有处理的TOC含量均呈明显下降趋势,这与Ye等在鸡粪堆肥过程中的研究结果[34]一致,Zhang等在鸡粪与玉米秸秆的堆肥试验[35]中也发现类似的结果。 而TOC的降解为HA前体的形成提供了碳源,促进了HA的形成。GI则呈明显上升趋势,且T3处理的GI达到111.40%,显著高于CK。
木质素是一种大量存在于植物维管组织中的芳香族聚合物,由葡萄醇、针叶铁醇和对香豆醇构成。这些单烯醇分别被称为S、G和H单位,通过C—O—C和C—C相互连接[36],是堆肥过程中最难以降解的芳香族化合物之一,故0~21 d堆体的木质素含量下降缓慢,随着堆肥的进行,堆体温度逐渐降低,以子囊菌门为主的真菌代谢逐渐增强,致使木质素的降解速率加快[37],堆肥结束时,T3处理的木质素降解率达到28.20%,显著高于其他处理,说明生物炭和黄孢原毛平革菌的联合添加可有效加快木质素降解。木质素的氧化物通常组成了HS的“核”,是形成HA的重要前体物质[38]。本试验中堆体的HS含量均呈先增加后降低,最后趋于平缓的趋势。早期阶段,HS的增加是由于堆体中有机质组分的降解和腐殖质类物质如醌类和酚类物质的聚集导致的[24],而HS含量在7~14 d内下降的原因是微生物对HS中部分化合物的降解。同时发现,HA含量在0~7 d整体呈逐渐上升趋势,这与Bai等的研究结果[24]一致,其中T2处理的HA含量显著高于其他处理,这可能是因为堆体中被孢霉门(Mortierellomycota)对有机碳的固定作用, 为HA前体的形成提供了碳源,说明堆肥前期单独施用黄孢原毛平革菌对促进HA的形成具有显著作用。14~35 d,所有处理的HA含量逐渐上升,这可能是因为堆肥后期温度降低,微生物的活性增强,提高了堆体中有机质的降解[39]。至堆肥结束时,T3处理的HA含量较堆肥当天提高了152.56%,并高于其他3个处理。FA含量在0~7 d呈上升趋势,后期呈下降趋势,这与Li等在猪粪堆肥过程中的结果[40]一致。前期FA含量的增加是因为毛霉门(Mucoromycota)胞外酶的分泌加快了纤维素与半纤维素的降解[41],进而促进FA的合成[27]。 而后期下降是因为堆体温度降低导致微生物的代谢增强,加快了FA 的降解[42]。
本试验发现,堆肥1 d,门水平上,T1、T2处理的优势真菌为子囊菌门,T3处理的优势真菌为子囊菌门(13.22%)和担子菌门(14.48%),这与Huang等在污泥堆肥中的研究结果[43]一致,Duan等在猪粪堆肥过程中也发现类似的结果[44],子囊菌门和担子菌门产生的孢子具有耐高温的特性,是矿化和降解木质素的关键微生物[45-46],这可能是T3处理的木质素降解率高于CK和其他处理的原因之一。但Wang等研究发现,在牛粪堆肥过程中的优势真菌门为Mycothermus,这可能是肉牛特殊的消化系统导致的[45]。堆肥后期,由于曲霉属分泌具有木质素降解功能的过氧化酶[46],致使木质素降解率提高。值得注意的是,没有分科名称或明确分类信息的真菌在各个时期的真菌群落均占有较大的比例,这与Wang等的研究结果[47]一致,而这些真菌可能与高温期木质素的降解和HA的形成有关[47]。相关性分析表明,含水率的降低可提高子囊菌门的丰度,促进木质素降解;Calcarisporiellomycota丰度的提高可促进HS与HA的形成,提高堆体的H/F和GI。故今后可关于子囊菌门与Calcarisporiellomycota的耦合对堆肥过程中木质素降解、堆肥腐熟度的影响作进一步研究,以期对微生物降解木质素的机制作进一步阐释,提高木质素降解与有机肥的品质。
4 结论
生物炭与黄孢原毛平革菌的联合添加可有效提高TOC的降解率和GI。堆肥结束时,T3处理的TOC降解率(40.41%)和GI(111.40%)最高。
生物炭与黄孢原毛平革菌的联合添加可有效提高木质素的降解率和堆体的腐熟度。堆肥结束时,T3处理的木质素降解率达到28.20%,HS含量提高29.47%,HA含量提高152.65%,均高于其他处理;FA含量降低45.25%;H/F由堆肥当天的0.35上升至1.03。
微生物群落多样性分析表明,子囊菌门是堆肥过程中的优势真菌,含水率的降低可提高子囊菌门的相对丰度,促进木质素的降解;Calcarisporiellomycota丰度的提高可促进HS与HA的形成,提高堆体的H/F和GI。
综合考虑,在鸡粪堆肥中,生物炭和黄孢原毛平革菌联合添加是提高木质素降解率和堆体腐殖质化的合理方法。

