宰后羊肉中环腺苷酸依赖蛋白激酶活性变化和影响因子研究
宋旭博 摆玉蔷 王振宇 李 欣,* 侯成立 方 菲 余群力,* 张德权
(1甘肃农业大学食品科学与工程学院,甘肃 兰州 730070;2中国农业科学院农产品加工研究所/农业农村部农产品质量安全收贮运管控重点实验室 北京 100193)
环腺苷酸依赖蛋白激酶(cAMP-dependent protein kinase,PKA)是催化蛋白质磷酸化反应的重要蛋白激酶之一,通过将三磷酸腺苷(adenosine triphosphate,ATP)或三磷酸鸟苷(guanosine triphosphate,GTP)上的磷酸基团转移到蛋白质特定氨基酸残基上,使蛋白质发生磷酸化修饰[1]。真核细胞中发生磷酸化修饰的位点为丝氨酸、苏氨酸、酪氨酸残基侧链的羟基。研究表明,蛋白质磷酸化主要通过调节酶活性而影响蛋白质降解、宰后糖酵解进程,进而调控肉品质[2-4]。PKA 广泛存在于真核细胞,可催化丝氨酸、苏氨酸发生磷酸化,PKA 全酶是由两个催化亚基和两个调节亚基组成的四聚体,没有催化活性,其活化依赖第二信使环磷酸腺苷(cyclic adenosine monophosphate,cAMP)的催化。PKA 全酶调节亚基上包含两个cAMP 结合位点,当结合cAMP 分子后,其构象发生变化,释放催化亚基,使PKA 具有催化活性。目前已证实哺乳动物有250 多种PKA 磷酸化底物,所有这些蛋白组成了细胞的PKA 信号网络[5]。
PKA 活性受钠离子、cAMP、ATP 影响[6-8]。研究表明,PKA 可催化肌原纤维蛋白发生磷酸化反应[7]。Motoko 等[9]研究发现,饲喂钠盐可显著抑制大鼠肌肉中PKA 等多种激酶活性,降低蛋白质磷酸化水平。此外,氯化钠腌制羊肉后显著降低了PKA 活性及肌肉糖酵解限速酶和骨架蛋白磷酸化水平[6],可见,钠离子是影响PKA 活性的一个重要因素。李常青等[8]发现,外源cAMP 进入细胞内可提高体内cAMP 的浓度并激活PKA,使代谢酶活性增强,底物蛋白质发生磷酸化。可见,cAMP是影响PKA活性的又一重要因素。
通过调控PKA 活性改变肉中蛋白质磷酸化水平,是从分子水平调控肉品质的重要途径。已有研究证实,肌浆蛋白的整体磷酸化水平与肉色稳定性呈负相关关系[10],离体条件下,PKA 影响糖原磷酸化酶的磷酸化水平和活性[11]。此外,PKA可催化µ-钙蛋白酶发生磷酸化反应,其磷酸化反应可正向调控µ-钙蛋白酶的活性[12],蛋白质磷酸化通过影响酶活性和蛋白质结构稳定性而调控宰后肌肉僵直的进程,进而影响肌肉嫩度[13]。研究表明,蛋白质整体磷酸化水平高的肉嫩度低、持水力低、腌制速率慢、食盐使用量高,可见,原料肉蛋白质磷酸化水平是影响腌制效果的重要因素[14-15]。
明确PKA 活性是否随宰后时间变化及其变化在不同品质肉中是否一致对阐明PKA 活性对宰后肉品质的影响有重要意义。但宰后不同时间、不同品质肉中PKA 活性变化以及肉中钠离子、cAMP 等因素对PKA 活性的影响尚不清楚。因此,本研究重点解析不同品质肉中PKA 活性随宰后时间的变化,以期为研发基于PKA活性的生鲜肉品质调控技术提供理论依据。
1 材料与方法
1.1 材料与试剂
蛋白酶抑制剂、磷酸酶抑制剂购自瑞士Roche 公司;Pro-Q Diamond染色液、SYPRO Ruby染色液购自美国Invitrogen公司;三羟甲基氨基甲烷(Tris Base)、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、丙烯酰胺、甲叉双丙烯酰胺、过硫酸铵(ammonium persulfate,APS)、四甲基乙二胺(tetramethylethylenediamine,TEMED)、二硫苏糖醇(dithiothreitol,DTT)、乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)等均为分析纯,购自西格玛奥德里奇(上海)贸易有限公司;ATP含量检测试剂盒购自北京索莱宝生物科技有限公司;环腺苷酸依赖蛋白激酶(PKA)活性检测试剂盒、环磷酸腺苷(cAMP)含量检测试剂盒购自北京金天然科技发展有限公司;BCA Protein Assay Kit 蛋白浓度测定试剂盒购自美国Pierce公司。
1.2 仪器与设备
SparkⓇ多功能微孔板检测仪,瑞士Tecan 公司;Ultra Turrax Dispersen S25 匀浆机,德国IKA 公司;MJ-Ⅱ霉菌培养箱,上海一恒科技有限公司;TS-2 水平脱色摇床,海门市其林贝尔仪器制造有限公司;Mini-PROTEAN Tetra System 电泳设备、ChemiDocTMMP凝胶成像系统,美国Bio-Rad公司;TA-XT2i/5质构分析仪,英国Stable Micro System 公司;CM-600D 色差计,日本柯尼卡-美能达公司。
1.3 试验方法
1.3.1 试验设计 选取64 只6~7月龄,体重为(38.94±2.11)kg的小尾寒羊公羊双侧背最长肌,分装至冻存管中,于4 ℃条件下贮存,在宰后1 h、12 h、1 d、3 d、5 d 时取样,每个时间点的样本,取一部分用于肉品质分析,另一部分经液氮速冻,保存于-80 ℃冰箱,用于生化指标分析。根据宰后1 d的剪切力、a*值和蒸煮损失将样品分为高品质组(剪切力小、a*值大、蒸煮损失低)和低品质组(剪切力大、a*值小、蒸煮损失高),共18只,每组包含9个样本。
1.3.2 剪切力测定 参照《NY/T 1180-2006 肉嫩度的测定 剪切力测定法》[16]测定。将背最长肌剔除筋膜,并沿肌纤维方向修整成6 cm×6 cm×3 cm 的肉块,放入80 ℃恒温水浴锅中加热至肉样中心温度达到70 ℃时,将肉样取出冷却至室温,切成1 cm×1 cm×3 cm 的小块,用质构分析仪垂直于肌肉纤维方向剪切测定其剪切力(N)。探头距离为25 mm,速度为60 mm·min-1。每个样品测定5次。
1.3.3 蒸煮损失测定 蒸煮损失测定参照Honikel等[17]的方法。取羊背最长肌称重并记质量为W1,放入蒸煮袋中封口包装,于80 ℃水浴45 min 后,冷却至室温并置于4 ℃过夜。将肉块取出,用滤纸轻轻吸干表面汁液,再次称重记质量为W2。蒸煮损失计算方法如下:
1.3.4a*值测定 利用色差计测定肉表面色泽,将肉样的新切横断面在室温下氧合30 min,垂直将色差计镜头置于肌肉横断面,镜头紧扣肉面,保证不漏光,随机在每个样品4个不同位置上各测定1次,测定位置均匀分布于肌肉横切面。采用标准光源CIEL*a*b*系统,测定前利用亮度值(L*)=97.59±0.01、红度值(a*)=0.07±0.02、黄度值(b*)=1.60±0.00的白板对色差计进行校正。
1.3.5 PKA 活性测定 称取0.1 g 样品,加入0.9 mL 0.1 mol·L-1的磷酸盐缓冲液(phosphate buffered saline,PBS),冰浴匀浆2 次,2 档,每次15 s,间隔30 s,于10 000 r·min-1(4 ℃)离心30 min,上清液即为所需的样品溶液。根据PKA 活性测定试剂盒说明建立反应体系,充分混合后,在450 nm 处测定吸光度值。根据建立的标准曲线计算PKA活性。
1.3.6 钠离子含量测定 根据《GB 5009.91-2017食品安全国家标准 食品中钾、钠的测定》[18],配制Al(NO3)3/KNO3(0.5 mol·L-1和1.1 mol·L-1)、络合剂NH4HF(300 g·L-1)、Na2SO4标准溶液(0.4 mol·L-1),使用温度滴定法,称取1 g 样品,搅碎备用,分别添加1.0、1.5、2.0、2.5 mL Na2SO4,再加5 mL络合剂和40 mL蒸馏水,用Al(NO3)3/KNO3滴至第一个终点,得到滴定曲线,按照公式计算钠离子含量:
式中,X为样品中元素含量(mg·100g-1);C为测定试样液中元素浓度(µg·mL-1);C0为试剂空白液中元素浓度(µg·mL-1);V为试样液定容体积(mL);f为样品液稀释倍数;m为样品质量(g)。
1.3.7 ATP 含量测定 称取0.1 g 样品,参照ATP含量检测试剂盒说明书,加入1 mL 10 倍体积的提取液,冰浴匀浆2 次,1 档,每次15 s,间隔30 s,于8 000 r·min-1(4 ℃)离心10 min,取上清,加入500 µL氯仿,震荡混匀后10 000 r·min-1离心(4 ℃)3 min,上清液即为所需样品溶液,然后按照说明书建立反应体系,充分混合后,立即测定340 nm下的吸光值(A测定),然后将酶标板放入37 ℃培养箱中反应3 min,立即取出测定340 nm 下的吸光值(A标准),按照公式计算ATP 含量(µmol·g-1):
式中,A测定=A2测定管-A1测定管;A标准=A2标准管-A1标准管;W为样本质量(g)。
1.3.8 cAMP含量测定 称取0.1 g样品,加入0.8 mL 0.1 mol·L-1的磷酸盐缓冲液,冰浴匀浆2次,2档,每次15 s,间隔30 s,于3 000 r·min-1离心(4 ℃)30 min,上清液即为所需样品溶液,根据cAMP 含量测定试剂盒说明建立反应体系,充分混合后,在450 nm 处测定吸光度值。根据建立的标准曲线计算cAMP含量。
1.3.9 肌浆蛋白磷酸化水平测定 肌浆蛋白提取参考Lametsch 等[19]的方法,并略作修改。取-80 ℃冻存的肉样1 g,加入6 倍体积的缓冲液(10 mmol·L-1Tris Base,10 mmol·L-1DTT,蛋白酶抑制剂50 mL,磷酸酶抑制剂50 mL)后冰上高速匀浆2次,每次10 s,间隔30 s,所得的匀浆液于10 000 r·min-1离心(4 ℃)30 min,上清液即为所需肌浆蛋白样品,稀释10倍后按BCA 法测定蛋白浓度,根据测定浓度,调节所需浓度为4 µg·mL-1,与上样缓冲液(10 % SDS、甘油、0.5 mol·L-1Tris,HCl调pH 值到6.8、1 mol·L-1DTT、溴酚蓝)1∶1 混合均匀,100 ℃水浴5 min,分装后保存于-80 ℃冰箱备用。采用10%分离胶和4%浓缩胶,参考Chen 等[20]的方法测定肌浆蛋白磷酸化水平,蛋白上样量为5 µg,电泳初始电压为80 V,待蛋白进入分离胶后调整电压为120 V,至蛋白到达离凝胶底部5 mm 处停止电泳。电泳结束后至成像前所有操作均在摇床上进行。凝胶在固定液(10%乙酸,50%乙醇)中固定(2 次,30 min/次),超纯水洗(3 次,10 min/次),Pro-Q Diamond 染色液避光染色80 min后Pro-Q 脱色液(20%乙腈,50 mmol·L-1乙酸钠,pH 值4.0)脱色(2 次,30 min/次),超纯水洗(3 次,10 min/次),进行磷酸化蛋白染色成像;SYPRO Ruby染色液避光染色4 h,Ruby脱色液(7%乙酸,10%乙醇)脱色(2次,30 min/次),超纯水洗(3次,10 min/次)。
采用ChemiDocTMMP 凝胶成像系统进行图像扫描。Pro-Q Diamond 染色后在激发波长532 nm、发射波长580 nm、分辨率200 mm 的条件下扫描。SYPRO Ruby 染色后在激发波长532 nm、发射波长610 nm、分辨率200 mm的条件下扫描。
运用Quantity One 软件对经荧光染液染色聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrop-horesis,SDS-PAGE)蛋白条带的光密度值进行分析,得到每个条带的磷酸化蛋白染色(Pro-Q Diamond)光密度值(P)和全蛋白染色(SYPRO Ruby)光密度值(T),同一条带的磷酸化蛋白与全蛋白光密度值之比P/T 即为该条带蛋白质磷酸化水平,样品整体磷酸化水平为其泳道上所有蛋白条带的P/T 值之和。
1.4 数据处理
采用Excel 2016软件处理数据,指标均为3次重复3 次平行的测定结果,结果用平均值±标准偏差表示。利用SPSS Statistics 21 软件对试验结果进行双因素方差分析,其中方差分析时选取一般线性模型,品质分组和宰后时间为固定因子,采用最小显著差异法进行显著性分析,显著性水平为P<0.05。
2 结果与分析
2.1 不同品质组肉样宰后1 d的a*值、剪切力、蒸煮损失分析
两个品质组宰后1 d 的a*值、剪切力、蒸煮损失结果表明,高品质组的a*值显著高于低品质组,剪切力、蒸煮损失显著低于低品质组(表1)。
2.2 不同品质组肉样PKA活性随宰后时间的变化
由图1可知,宰后1 h和12 h低品质组的PKA 活性显著高于高品质组(P<0.05),宰后1、3、5 d 高品质组与低品质组PKA 活性差异不显著(P>0.05)。高品质组PKA 活性在宰后1 h、12 h、1 d 时显著低于3、5 d,低品质组中PKA 活性在宰后1 h、12 h、1 d、3 d 时显著低于5 d(P<0.05)。
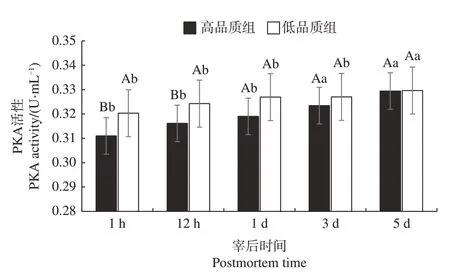
图1 不同品质组肉样中PKA活性随宰后时间的变化Fig.1 Changes of PKA activity in meat samples of different quality groups with postmortem time
2.3 不同品质组肉样ATP含量随宰后时间的变化
由图2 可知,随着宰后时间的延长,不同品质差异组ATP 含量在宰后1 h~3 d 显著降低(P<0.05),3~5 d差异不显著,均在宰后5 d 时ATP 含量趋近于零。宰后1 h 和5 d 时,两个品质组间ATP 含量差异不显著(P>0.05)。高品质组的ATP 含量在宰后12 h 和3 d 显著高于低品质组,在宰后1 d 显著低于低品质组(P<0.05)。
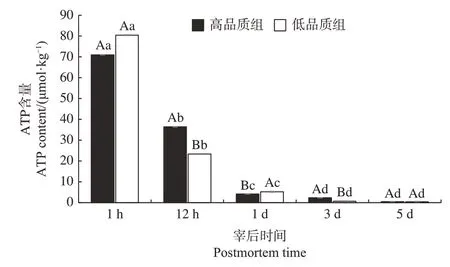
图2 不同品质组肉样ATP含量随宰后时间的变化Fig.2 Changes of ATP content in meat samples of different quality groups with postmortem time
2.4 不同品质组肉样cAMP含量随宰后时间的变化
由表2可知,高品质组cAMP含量显著高于低品质组(P<0.05)。高品质组cAMP 含量在宰后1、12 h显著高于1、3、5 d(P<0.05),不同宰后时间低品质组cAMP含量差异不显著(P>0.05)。
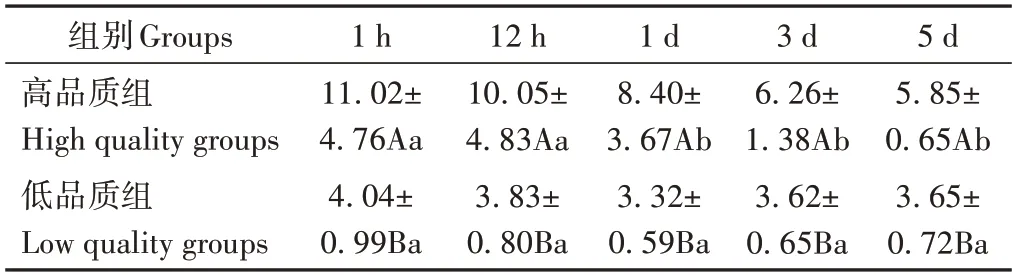
表2 不同品质组肉样cAMP含量随宰后时间的变化Table 2 Changes of cAMP content in meat samples of different quality groups with postmortem time /(nmol·L-1)
2.5 不同品质组肉样钠离子含量随宰后时间的变化
由图3 可知,宰后不同时间高品质组和低品质组中钠离子含量无显著差异,不同品质组样本钠离子含量在宰后不同时间差异不显著(P>0.05)。
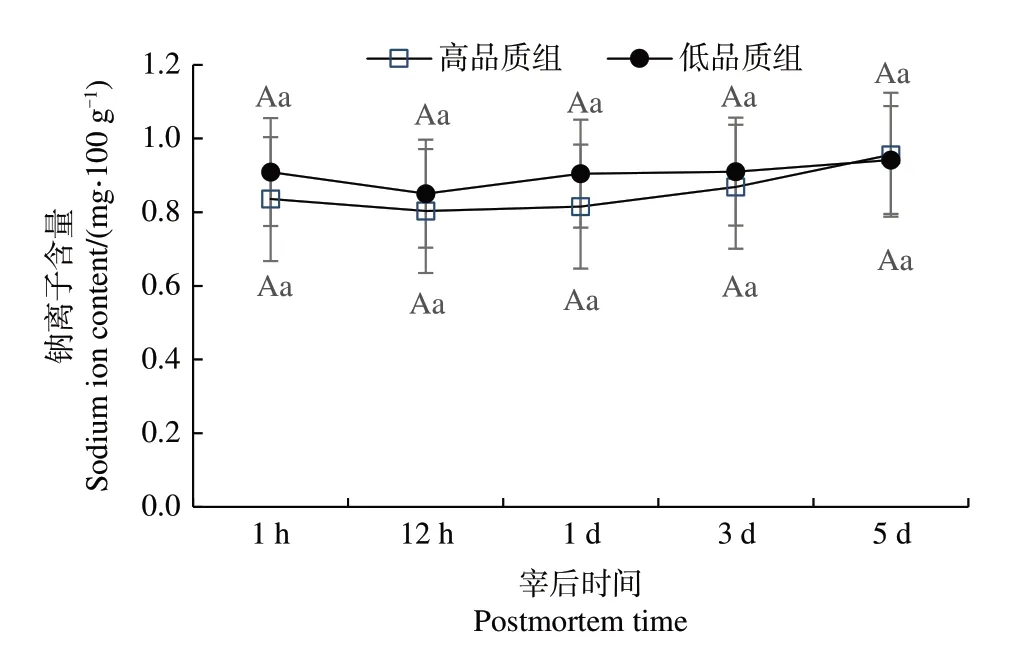
图3 不同品质组肉样钠离子含量随宰后时间的变化Fig.3 Changes of sodium ion content in meat samples of different quality groups with postmortem time
2.6 不同品质组肉样肌浆蛋白磷酸化水平随宰后时间的变化
两个品质组中肌浆蛋白磷酸化水平随宰后时间变化结果如图4所示。图5 是SYPRO Ruby 染色的肌浆全蛋白质。从图中选取24 个较清晰的蛋白质条带进行整体磷酸化水平分析。整体上,在宰后1、3、5 d 时,低品质组肌浆蛋白磷酸化水平显著高于高品质组(P<0.05),且不同蛋白质条带磷酸化水平的影响呈现出差异。两个品质组肌浆蛋白磷酸化水平在宰后1 h 显著高于12 h、1、3、5 d(P<0.05)。
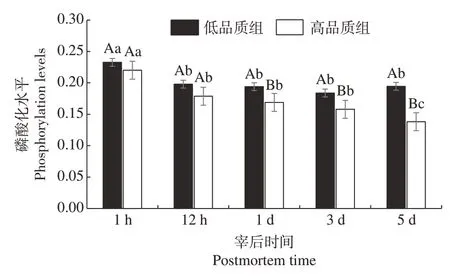
图4 不同品质组肉样肌浆蛋白磷酸化水平随宰后时间的变化Fig.4 Changes of phosphorylation levels of sarcoplasmin in different quality groups with postmortem time
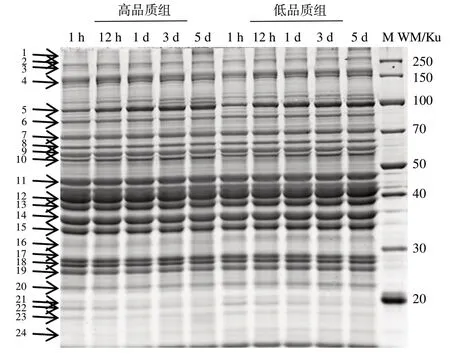
图5 肌浆蛋白SDS-PAGE图谱Fig.5 SDS-PAGE image displaying the sarcoplasmic protein content
2.7 相关性分析结果
PKA 活性与钠离子、cAMP、ATP 含量、肌浆蛋白磷酸化水平的相关性分析结果如表3所示。结果表明,PKA活性与ATP含量(r=-0.73,P<0.05)、cAMP含量(r=-0.84,P<0.05)和肌浆蛋白磷酸化水平(r=-0.80,P<0.05)呈显著负相关;与钠离子含量呈显著正相关(r=0.80,P<0.05)。
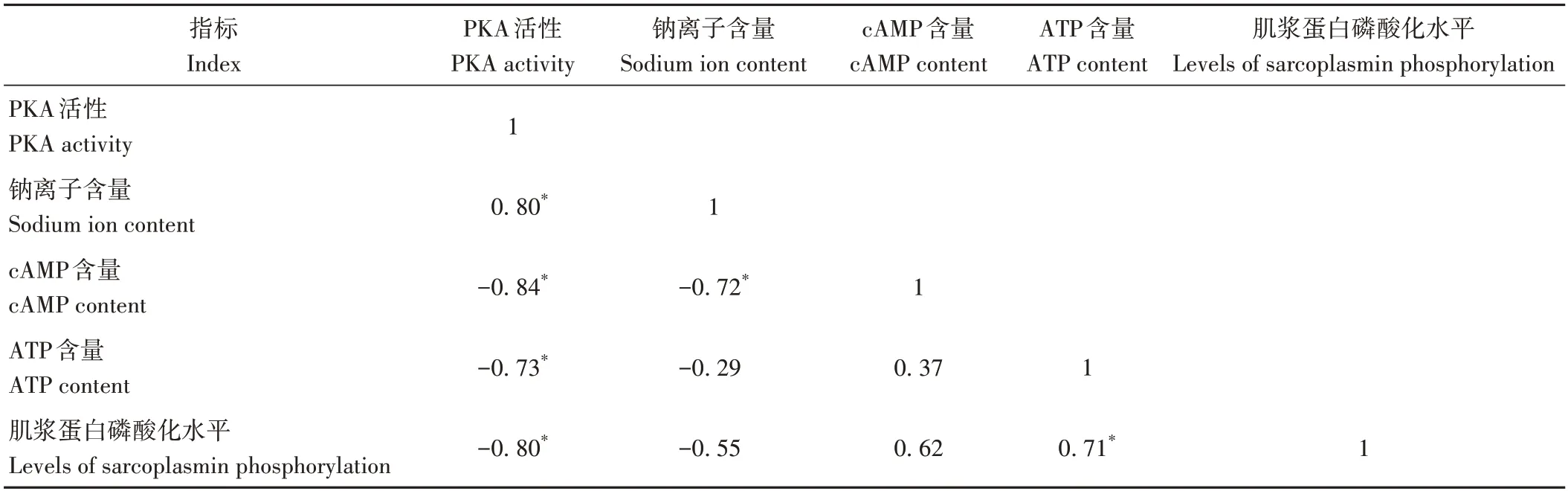
表3 PKA活性与ATP、cAMP、钠离子含量、肌浆蛋白磷酸化水平的相关性分析Table 3 Correlation analysis of PKA activity with ATP,cAMP,sodium content and sarcoplasmic protein phosphorylation
3 讨论
3.1 不同品质组PKA活性随宰后时间变化分析
PKA 活性影响宰后肉蛋白质磷酸化水平,进而影响肉品质。研究表明,肌浆蛋白磷酸化通过调控糖酵解酶活性使宰后pH 值下降,进而间接调控肉色[21]。低肌原纤维蛋白磷酸化水平有助于肌原纤维蛋白被钙蛋白酶降解,减轻肌肉收缩进而改善保水性[22],蛋白质磷酸化可通过调控糖酵解、肌肉收缩等环节影响宰后肌肉嫩度[9]。本研究结果表明,低品质组PKA 活性在宰后1、12 h显著高于高品质组。PKA发挥活性需要ATP 参与,腺苷酸环化酶催化ATP 生成cAMP[14],随着宰后时间延长,高品质组的ATP 消耗缓慢,抑制cAMP的生成,进而影响PKA 活性。两个品质组PKA 活性在宰后1 h、12 h、1 d时显著低于5 d。PKA全酶呈非活性状态,在其调节亚基上有两个cAMP 结合位点,当cAMP 存在时,与调节亚基结合后,调节亚基与催化亚基分离,释放出的催化亚基活化PKA[22]。随着宰后cAMP 与调节亚基结合,cAMP 被消耗,其含量下降,从而激活PKA并使其活性增加。
3.2 肌浆蛋白磷酸化水平分析
蛋白质磷酸化在调节宰后肌肉的生理生化过程,如糖酵解、肌肉收缩、细胞凋亡等过程中起重要作用,可影响肉的嫩度、持水性、肉色稳定性等品质[23]。本研究结果表明,低品质组的肌浆蛋白磷酸化水平在宰后1、3、5 d显著高于高品质组,这与陈立娟[7]的研究结果一致。肌浆蛋白整体磷酸化水平受品质、宰后时间影响[14]。究其原因,第一,根据“磷酸化诱导酶活降低”学说,磷酸化水平越高糖酵解酶活性越低[24-25],因此,在磷酸化作用的影响下,高嫩度组糖酵解酶活性较高、糖酵解速率较快、pH 值较低,更有利于组织蛋白酶释放和激活,促进蛋白质降解,进而有利于肉的嫩化[26]。第二,宰后胴体进行无氧反应产生ATP 的含量不足,而蛋白质磷酸化发生的必要条件是有ATP 提供磷酸基团。ATP作为蛋白质磷酸化反应的介质直接影响蛋白质磷酸化,但随着宰后时间的延长,ATP逐渐被消耗,使磷酸化水平下降,因此,肌浆蛋白磷酸化水平在宰后1、3、5 d 显著低于1 h。研究发现,蛋白质磷酸化影响肉色稳定性、能量代谢等[12,27-28]。蛋白激酶是影响蛋白质磷酸化的重要内源因子[12]。PKA 作为一种蛋白激酶,其作用是催化蛋白质发生磷酸化。本试验结果表明,PKA 活性与肌浆蛋白磷酸化水平呈负相关,这可能是由于PKA 有许多亚型,且各亚型的功能各不相同,本试验仅测定分析了总PKA 活性,而各亚型活性变化还有待继续研究。
3.3 影响PKA活性的因素分析
钠离子含量是影响PKA 活性的重要因素,张彩霞[6]指出食盐显著抑制PKA 活性。本研究结果表明,同一宰后时间不同品质组和同一品质组不同宰后时间钠离子含量均无显著差异,相关性分析发现,PKA活性与钠离子含量呈显著正相关。本研究重点解析宰后肉中所含钠离子对PKA 活性的影响,明确肉中本底钠离子与PKA 活性的关系,研究结果表明,宰后肉中钠离子含量对PKA 活性的影响不随宰后时间与肉品质变化而变化。cAMP 是细胞内最重要的第二信使,细胞内cAMP 浓度的改变影响多种细胞内信号转导途径,从而调控蛋白活性、基因表达等,进而影响细胞代谢、生长和凋亡过程[29]。PKA 的活化主要受胞内cAMP 浓度的影响[30],腺苷酸环化酶与G 蛋白耦联受体结合活化,在质膜内催化ATP合成cAMP,cAMP与PKA的调节亚基结合,可促使其催化亚基释放,催化亚基会进一步作用于cAMP 反应元件结合蛋白(cyclic-AMP response binding protein,CREB),促进其磷酸化为pCREB,pCREB 可以介导神经元对各种神经营养因子包括脑源性神经营养因子、神经生长因子的反应[31-33]。在蛋白质磷酸化反应的过程中,通过消耗生成的cAMP 激活PKA,进而使蛋白质发生磷酸化反应,表现为PKA活性与cAMP含量呈显著负相关,PKA 活性随cAMP含量的降低而逐渐升高。但如何通过钠离子浓度影响PKA活性进而调控肉品质还需进一步深入研究。
4 结论
宰后肉中PKA 活性受宰后时间和肉品质的影响,PKA 活性随宰后时间的延长而升高,且与宰后肉中钠离子含量呈显著正相关,cAMP 通过影响PKA 活性而影响肌浆蛋白磷酸化水平,进而影响肉品质,说明cAMP 含量与钠离子是影响PKA 活性的重要因素。进一步研究重点在于通过改变钠离子浓度影响PKA 活性进而调控肉品质。

