经股动脉经导管主动脉瓣置换术治疗单纯主动脉瓣反流的研究进展
车波 徐承义 徐文杰 鄢华 宋丹
经导管主动脉瓣置换术(transcatheter aortic valve replacement,TAVR)已成为国内外指南推荐治疗老年主动脉瓣狭窄(aortic stenosis,AS)的一线治疗方案,也适用于AS合并不同严重程度主动脉瓣反流(aortic regurgitation,AR)的患者,但在单纯主动脉瓣反流(pure aortic regurgitation,PA R)中却不做常规推荐,传统外科主动脉瓣置换术(surgical aortic valve replacement,SAVR)仍然是治疗PAR的金标准[1-3]。外科手术禁忌或高危PAR患者,常放弃外科手术治疗,选择保守治疗,而后者的死亡率更高[4-5]。欧洲的心脏调查数据显示,在严重的自然主动脉瓣关闭不全、左心室射血分数(left ventricular ejection fractions,LVEF)30%~50%的患者中,仅有21.8%的患者被推荐SAVR治疗;LVEF<30%的患者中,仅有2.7%的患者被推荐SAVR治疗,而保守治疗每年面临近20%的死亡风险[5-6]。
经股动脉经导管主动脉瓣置换术(t r a n sf e m o r a l transcatheter aortic valve replacement,TF-TAVR)为这一类患者提供了一种安全、可行的外科手术替代治疗方案。目前我国仅有经心尖(transapical,TA)路径的J-Valve人工主动脉瓣膜系统被批准用于PAR的TAVR治疗(TA-TAVR),并取得了优异的临床结果,而TF-TAVR治疗PAR国内外证据尚不足,均推荐可在成熟的心脏中心进行探索性尝试[1-3]。其主要原因是PAR患者的主动脉瓣瓣膜常常缺乏钙化,瓣叶较软,且常伴有主动脉瓣环和升主动脉扩张,导致瓣膜类型选择及瓣膜锚定更加困难,使得TAVR在治疗PAR中更具挑战性[4-5]。随着TAVR技术经验积累、新一代瓣膜系统的发展及长期随访数据的反馈,TF-TAVR治疗PAR逐渐被证实是一种安全、可行的替代治疗方式,并获得了较高的手术成功率、可接受的临床疗效及早中期存活率。但其仍面临技术要求高、尚无针对PAR的经股动脉路径瓣膜系统、缺乏术后长期随访和置入瓣膜耐久性的可靠数据等挑战,需要大规模的前瞻性临床研究进一步探索。本文旨在对TF-TAVR治疗PAR的实施要点、临床研究现状以及未来的发展进行综述。
1 TF-TAVR 治疗PAR 实施要点
1.1 患者的筛选
严格的术前患者筛选是TAV R 在PA R中应用的前提。指南推荐对于外科手术禁忌或高危、解剖特点经过术前充分评估适合TAVR、预期治疗后能够临床获益的PA R患者,可尝试TAV R治疗[1-3]。首先需排除左心室内新鲜血栓、左心室流出道(lef t ventricular outf low tract,LVOT)严重梗阻、急性心肌梗死及预期寿命<1年等TAVR绝对禁忌证的患者[1-2]。对于活动性心内膜炎或主动脉夹层导致的急性AR、主动脉根部扩张>55 mm、伴有主动脉夹层高危因素且主动脉根部直径>45 mm、需要行冠状动脉旁路移植术及其他瓣膜或主动脉手术者,均应考虑首选外科手术治疗[7-10]。对于主动脉瘤样扩张、马方综合征及二尖瓣病变导致的AR患者,TAVR术后其主动脉内径仍可能继续增加,TAVR治疗不能有效改善这些患者的预后,不推荐行TAVR[8-9]。
所有患者术前均应行经胸超声心动图和冠状动脉螺旋CT(multi-slice computed tomography,MSCT)检查,超声心动图评估患者心功能、主动脉反流程度、瓣口面积及瓣压差等,通过MSCT结合3Mensio软件对主动脉瓣环平面、瓦氏窦平面、窦管交界平面、LVOT平面和升主动脉平面进行测量分析,并测量左、右冠状动脉窦距主动脉瓣环的高度,评估患者主动脉根部解剖和路径形态,筛选出术后易发生严重并发症的高危患者[11-13](图1)。对于瓣环直径>30 mm或其他平面缺乏锚定的有利因素时,不推荐行TF-TAVR治疗,瓣环直径过大会显著增加瓣膜型号不匹配、瓣膜定位不当、瓣膜移位及瓣周漏等风险[11-13]。LVOT区域是选择瓣膜锚定的关键位置,一般评估瓣环平面下4~6 mm处的LVOT形态和直径,敞口或喇叭口LVOT形态,无法提供足够的支撑力帮助瓣膜锚定,即使LVOT直径不大,瓣周漏及瓣膜移位的风险也会增加,而瓶颈状、直筒状或室间隔局部增厚的LVOT形态,可增加瓣膜的锚定力[11-13]。LVOT直径应<28 mm且具备一定的长度,较瓣环直径略小最为适合,可为瓣膜提供锚定点并降低LVOT梗阻的发生率[11-13]。升主动脉直径应<40 mm或存在其他平面有利于瓣膜锚定的因素,且应测量瓣上约40 mm处的升主平面,因为目前常用的瓣膜花冠高度约40 mm,此平面可辅助瓣膜的锚定[11-13]。窦管交界直径应<40 mm,在35 mm以内最为适宜,较小窦管交界直径可为置入瓣膜的头端冠状设计提供锚定,避免其滑落,窦管交界-升主动脉角度不宜>60°,较大的角度不利于瓣膜系统通过[11-13]。
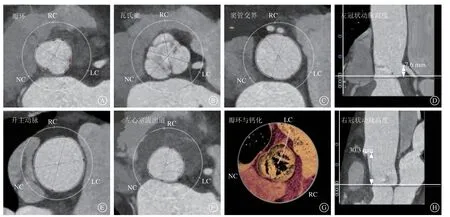
图1 应用MSCT 结合3Mensio 软件评估主动脉根部 A.瓣环平面测量;B.瓦氏窦平面测量;C.窦管交界平面测量;D.左冠状动脉开口高度;E.升主动脉平面测量;F.左心室流出道平面测量;G.瓣环形态及钙化分布;H.右冠状动脉开口高度F igure 1 Assess the aortic root by MSCT and 3Mensio software
11..22 瓣膜系统的选择及临床现状
合适的瓣膜选择是手术成功及减少术后并发症发生的关键。目前尚缺乏针对PAR的TF-TAVR瓣膜系统,仅有JenaValve瓣膜系统和J-Valve瓣膜系统被认证可用于TA-TAVR治疗外科手术禁忌或高危的PAR患者[4]。Webb等[14]认为治疗PAR的理想经导管心脏瓣膜(transcatheter heart valve,THV)系统应具备微创路径、多种瓣膜尺寸可供选择、不依靠钙化和过度扩张进行锚定及瓣膜可以回收并重新定位等特点,以满足PAR患者的病理特点。
AR患者常伴有主动脉瓣环扩张、升主动脉扩张且瓣膜钙化程度低,瓣环及瓣叶不能为THV提供足够的锚定摩擦力,导致瓣膜锚定更加困难,增加了瓣膜移位及瓣周漏的风险,这也是TAVR在PAR中的应用难点,故在选择瓣膜时需基于AR解剖特点,综合考虑瓣膜的类型、大小、结构、释放方式等[15-16]。术前的MSCT检查可为瓣膜选择提供准确的参考尺寸,常倾向于选择比瓣环直径大15%~20%的瓣膜,以获得足够的径向支撑力使瓣膜锚定更加稳定,但不应超过20%,这会增加瓣环破裂和输送系统异常的风险,可参考计算公式瓣膜超大指数=[(设备标称周长/面积)/(CT测量的环周/面积)-1]×100,而对于主动脉瓣二瓣化或者钙化严重的瓣环,可选择较测量直径偏小的支架瓣膜[17-20]。
选用 第二代瓣膜系统(new-generation devices,NGD)是必要的(图2)。NGD具有优化径向力的新形状、瓣膜裙边设计改进、可提供自我定位、可回收并重新定位锚定等优点,可根据术中情况回收并调整瓣膜释放位置,术中瓣膜释放更加准确,瓣膜与左心室和瓣环之间贴合更加稳定,且由于NGD主要固定在主动脉瓣环,可减少因升主动脉扩张带来的患者筛选限制,使更多的患者有接受TAVR治疗的可能,获得了较高的手术成功率,减少了主动脉瓣环破裂、瓣膜移位及瓣周漏等发生风险并可保护冠状动脉不被阻挡[4,11,21-23]。Yoon等[24]一项纳入331例有严重症状PAR患者接受TAVR治疗的研究报告中,使用NGD与早期瓣膜系统(early-generation devices,EGD)相比,其设备成功率显著提高(81.1%与61.3%;P<0.001),两组患者术后30 d主要终点事件发生率比较,差异无统计学意义,随访1年的全因死亡率分别为9.4%和13.4%、心血管死亡率分别为8.5%和11.8%,前者并发症的发生率也较低。Takagi等[21]Meta分析纳入11项研究,共计911例患者。结果分析显示手术成功率80.4%(NGD 90.2%,EGD 67.2%;P<0.001),中度及以上瓣周漏7.4%(NGD 3.4%,EGD 17.3%;P<0.001),30 d全因死亡率9.5%(NGD 6.1%,EGD 14.7%;P<0.001);中期(4个月~1年)全因死亡率18.8%(NGD 11.8%,EGD 32.2%;P<0.001),危及生命/重大出血并发症发生率5.7%(NGD 3.5%,EGD 12.4%;P=0.015),主要血管并发症发生率3.9%(NGD 3.0%,EGD 6.2%;P=0.041),差异均有统计学意义。

图2 代表性第二代瓣膜系统 A.JenaValve,JenaValve 科技,德国(https://jenavalve.com);B.J-valve,苏州杰成医疗,中国(https://www.jiechengmedical.com);C.Sapien 3,爱德华生命科学,美国(https://www.edwards.com);D.Evolut PRO+,美敦力,美国(https://europe.medtronic.com);E.ACURATE neo2,波士顿科学,美国(https://www.bostonscientif ic.com);F.Lotus Edge,波士顿科学,美国(https://www.bostonscientif ic.com);G.Silara(Driect Flow),成都赛拉诺医疗,中国(http://www.silaragroup.com);H.VenusA-Plus,杭州启明医疗,中国(https://www.venusmedtech.com);I.VitaFlow Liberty,上海微创心通,中国(https://www.microport.com.cn);J.TaurusElite,苏州沛嘉医疗,中国(https://www.peijiamedical.com)Figure 2 Representative of the second-generation devices
1.3 路径的选择
目前有多种TAVR路径用于PAR患者的治疗,包括经股动脉路径、经颈动脉路径、经锁骨下路径、经心尖路径等,现临床中多采用的是经心尖路径和经股动脉路径[25]。由于PAR患者的病理特点,常需要较大尺寸的THV,早期受到THV输送系统的限制,TA-TAVR是治疗PAR患者的首选路径,通过左胸小切口经心尖开展,使得入口与瓣膜理想位置之间的距离缩短且置入瓣膜与输送系统具有良好的同轴性,并取得了良好的临床结果[1-2,26-27]。但经心尖路径常面临着更高程度的心肌损伤以及并发症的发生风险,如胸腔积液、心房颤动、出血、LVEF降低等,这可能与较长时间插管、心肌撕裂、路径止血困难有关,相对于经外周血管路径,这种路径创伤更大,预后较差[28-30]。随着经导管瓣膜输送系统的持续更新,经股动脉路径逐渐在各心脏中心被尝试,其创伤更小,进一步减少了对左心室的损伤,术后患者恢复更快、LVEF改善更可观、机械通气时长更短、并发症发生率及死亡率也更低[7,14,30]。由于高危PAR患者的病情需求和使用非专用于PAR患者经股动脉路径设备的经验积累,TFTAVR将是治疗PAR患者未来发展的理想首选路径。
2 TF-TAVR 治疗PAR 临床结果现状
多项研究结果已证实TF-TAVR治疗PAR是一种安全、有效的替代治疗选择,获得了较高的手术成功率、可接受的临床疗效及早中期存活率。Schäfer等[31]和Hensey等[32]分别报道了人类首例使用JenaValve瓣膜和J-Valve瓣膜,并采用TF-TAVR治疗PAR患者的经验。患者术后30 d均无残余AR及瓣周漏等严重并发症发生,纽约心脏病协会(New York Heart Association,NYHA)心功能分级Ⅱ级,取得了良好的早期临床结果。Stachon等[7]研究分析了2008—2015年德国范围内使用SAVR和TAVR治疗的11 252例PAR患者的情况。其中SAVR组10 528例、TF-TAVR组476例、TA-TAVR组248例,三组患者的年龄分别为(60.9±14.1)岁、(77.9±8.6)岁、(75.4±9.5)岁;L o g is t i c E u r oSCO R E 评分分别为(4.5%±4.9%)、(17.3%±13.3%)、(15.7%±12.2%);脑卒中发生率分别为3.97%、1.47%、1.82%;出血发生率分别为21.20%、6.93%、8.87%;机械通气超过48 h分别为14.31%、6.51%、8.87%;住院死亡率SAVR为4.71%,TF-TAVR 2011年为15.2%、2015年为2.8%,TA-TAVR 2012年为17.7%、2015年为5.0%。可见在患者选择方面,接受TAVR治疗的PAR患者年龄更大、手术风险更高,这表明TAVR可能是最终的选择,与TAVR治疗PAR的患者筛选也相吻合。接受TFTAVR和TA-TAVR治疗的PAR患者的住院死亡率随着时间的推移而下降,但SAVR组的住院死亡率并没有下降,TFTAVR组显示出了更低的并发症发生率和更好的临床结果,这与TF-TAVR技术经验积累以及THV系统更新有合理的联系[33]。Purita等[34]纳入了欧洲13家中心在2016—2018年接受TAVR治疗的24例严重PAR患者,中位年龄为79.4岁,EUROSCORE Ⅱ评分平均为5%,术后30 d NYHA心功能分级Ⅰ级或Ⅱ级患者与基线资料(91.6%比4.1%,P<0.001)相比,差异有统计学意义。早期安全性为91.6%,全因死亡率和心血管死亡率均为4.1%,无脑卒中发生,术后1年全因死亡率为11.7%,这一研究结果表明TF-TAVR治疗PAR具有良好的可行性、早中期安全性及有效性。
Ussia等[35]一项纳入了意大利13家中心663例接受TAVR治疗的患者研究中,24例患者由于置入瓣膜位置不佳造成瓣周漏而行同期瓣中瓣置入术。结果显示术后1年标准TAVR组和瓣中瓣组主要不良心脑血管事件发生率(4.5%比14.1%,P=0.158)与全因死亡率(4.5%比13.7%,P=0.230)比较,差异均无统计学意义。Stundl等[36]比较了226例患者因中度及以上瓣周漏行球囊后扩张和瓣中瓣置入术的效果差异。结果显示瓣中瓣置入术可有效减少瓣周漏,球囊后扩张患者在术后1年内全因死亡、心脑血管事件发生率比较,差异均无统计学意义。对于严重瓣周漏患者,瓣中瓣置入术是合理的补救方式,目前尚无研究证据表明瓣中瓣置入术纠正瓣周漏会影响PAR患者的远期预后[35-36]。
3 挑战与展望
PAR患者常伴有更严重的左心功能不全症状和心脏结构改变,部分患者即使在TAVR治疗后也可能无法逆转,预后往往较差[5,37]。目前PAR患者接受TAVR的比例相当低,仅为1%~2%,只有通过特定筛选的PAR患者才有可能接受TAVR治疗,因为这类患者手术难度较大,发生严重并发症风险更高[15-16]。一旦发生重度瓣周漏及瓣膜脱位等严重并发症时应及时考虑中转外科SAVR治疗,故TF-TAVR治疗PAR技术应在成熟的心脏中心且有强大的心脏外科团队支持下才能考虑开展,以保证患者的安全[1-2]。基于CT的建模技术,3D打印技术可对患者的主动脉解剖情况进行个体化模拟,为患者的瓣膜系统和手术策略选择提供更精确的参考,也可以利用3D打印模拟器推演术中严重并发症出现后如何及时应对和补救,已在结构性心脏病的治疗中取得了良好的效果[38-39]。现可用的THV系统并不是针对PAR患者病理解剖特点设计,瓣膜的选择尚无统一的标准,需要进一步开发专用于PAR患者的设备,并在这一人群中建立瓣膜系统尺寸参考标准,积累手术程序和术中实施要点经验,以在未来提供更好的TF-TAVR程序指导[7,24]。
目前关于TF-TAVR治疗PAR的临床经验仅局限于小样本的病例系统回顾和荟萃分析,其术后对主动脉根部及心脏结构功能,包括对心室重构、LVEF、二尖瓣和三尖瓣结构功能的影响尚不明确[40]。缺乏术后长期随访及瓣膜耐久性的可靠数据,其安全性和有效性仍需要大规模的前瞻性研究和更长的随访周期来证实[7,11]。随着TF-TAVR在PAR患者中应用的经验积累、针对PAR病理特点设计的瓣膜以及更精确的术前检查工具的发展,TF-TAVR将是未来治疗高危PAR患者的理想首选方法。
4 总结
TF-TAVR是治疗高危PAR患者的一种安全、可行的替代治疗方案。术前筛选特定的患者、全面的术前评估及应用NGD是TF-TAVR手术成功和术后获得良好效果的关键。尽管仍面临技术要求高、缺乏大规模临床试验及长期随访数据等挑战,但随着TAVR技术的经验积累、新一代瓣膜系统的更新及长期数据的反馈,TF-TAVR在PAR患者中的应用将在未来几年继续扩大并更加安全可靠。
利益冲突所有作者均声明不存在利益冲突

