经导管主动脉瓣置换术保护装置致急性心肌梗死救治1例
韩晓荣 周杰 原子英 段晴晴 崔述 霞 刘松
1 临床资料
患者 女,76岁。因“劳累时胸闷、憋气10个月余”于2022年3月9日入住青岛大学附属医院。患者10个月余前出现劳累时胸闷、憋气、乏力不适,休息后可缓解,平素无咳嗽、咳痰、咯血,夜间平卧入睡无憋醒,可从事轻度体力活动。曾于2021年11月17日就诊于当地医院,行超声心动图、心电图检查,诊断为冠心病、主动脉瓣关闭不全(中度)。规律服用吲哚布芬(100 mg、每日2次)、沙库巴曲缬沙坦钠(100 mg、每日2次)、硝苯地平(30 mg、每日1次)、氯吡格雷(75 mg、每日1次)、阿托伐他汀(40 mg、每晚1次)、螺内酯(20 mg、每日2次)、托拉塞米(20 mg、每日2次),效果一般。后于2021年11月28日就诊于当地医院行冠状动脉支架置入术,效果尚可,上述症状较前稍有缓解,仍有活动后胸闷、憋气。为进一步诊治,于2022年3月7日就诊于青岛大学附属医院门诊。患者既往高血压病病史半年,血压最高170/100 mmHg(1 mmHg=0.133 kPa),口服沙库巴曲缬沙坦钠(100 mg、每日2次)、硝苯地平(30 mg、每日1次),血压控制良好。手术史:半年前因冠心病行冠状动脉支架置入术(右冠状动脉近段),术后恢复尚可。入院体格检查:体温36.4 ℃,脉搏63次/分,呼吸20次/分,血压158/53 mmHg;神志清晰,双肺呼吸音粗,未闻及明显干湿性啰音;无心前区隆起,相对浊音界向左下扩大,心率63次/分,律齐,心音正常,主动脉瓣听诊区可闻及舒张期叹息样杂音,双下肢无水肿。超声心动图示:主动脉瓣病变,重度主动脉瓣反流(aortic regurgitation,AR),左心房、左心室扩大,升主动脉扩张(轻度);心脏瓣膜退行性病变,二尖瓣反流(轻度),三尖瓣反流(轻度);左心室舒张功能减低。欲行外科手术收入心外科。入院主要诊断:心脏瓣膜病(重度AR),冠心病冠状动脉支架置入术后,纽约心脏病协会心功能分级Ⅲ级,高血压病2级(极高危)。
2022年3月9日进行术前评估。实验室检查示:肝肾功能、电解质、血脂均在正常范围;N末端B型脑钠肽前体579 pg/ml,高敏肌钙蛋白T 0.013 μg/L。心电图示:窦性心律,多导联ST-T改变(图1)。颈部血管超声示:双侧颈动脉内-中膜增厚并斑块形成,右侧颈内动脉中度狭窄。胸主动脉CT血管造影(CT angiography,CTA)示:胸部动脉粥样硬化。腹主动脉CTA示:腹主动脉粥样硬化表现,腹主动脉下端局部穿透性溃疡可能性大,右侧髂总动脉局部稍增粗。冠状动脉CTA示:左前降支、左回旋支均起自左冠状动脉窦;左前降支近段及左回旋支近段多发局限性钙化斑块,局部管腔轻-中度狭窄;右冠状动脉近段支架置入术后(图2)。主动脉根部CT示:三叶式主动脉瓣,瓣叶少许增厚;主动脉瓣瓣环直径22.3 mm,左心室流出道直径23.8 mm,主动脉窦结构直径分别为28.8 mm(左冠状动脉窦)、24.4 mm(右冠状动脉窦)、25.6 mm(无冠状动脉窦),窦管交界直径25.2 mm,升主动脉直径33.6 mm;左回旋支高度6.9 mm,右冠状动脉高度13.4 mm;心脏呈横位,角度约56°(图3)。患者年龄大,心功能差,是外科手术高危人群,综合以上情况,符合经导管主动脉瓣置换术(transcatheter aortic valve replacement,TAVR)适应证。

图1 2022 年3 月9 日术前心电图Figure 1 Preoperative electrocardiogram on March 9, 2022

图2 左前降支、左回旋支均起自左冠状动脉窦Figure 2 Left circumflex artery and left anterior descending originated from left coronary sinus
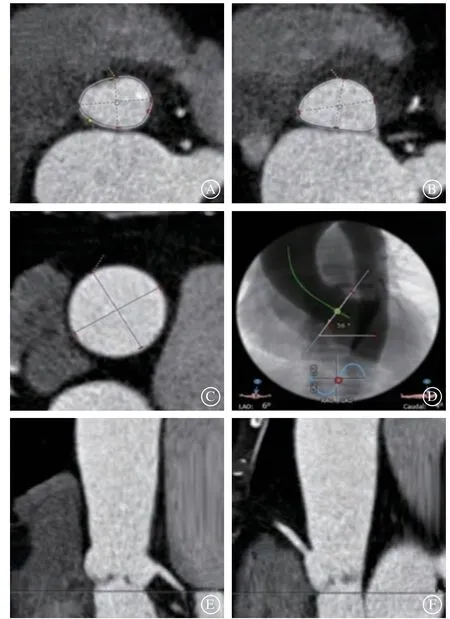
图3 患者术前CT 血管成像检查结果 A.主动脉瓣瓣环;B.左心室流出道;C.升主动脉;D.主动脉根部角度;E.左回旋支开口距离瓣环高度;F.右冠状动脉开口距离瓣环高度Figure 3 Anatomy of aortic valve annulus
患者于2022年3月15日在气管插管全身麻醉下行冠状动脉造影及TAVR。麻醉时患者突发心搏骤停,给予心脏按压(持续时间约1 min)后恢复窦性心律,约70次/分。麻醉满意后穿刺左侧、右侧股动脉分别置入6 F血管鞘。经左侧股动脉鞘管由超滑导丝引导猪尾导管至主动脉窦底,造影见重度AR。经右侧股动脉鞘管,导丝引导猪尾导管经过自体主动脉瓣至左心室。冠状动脉造影见左、右冠状动脉显影良好,左回旋支粗大、中段弯曲。患者既往右冠状动脉支架置入术后,冠状动脉CTA示血管狭窄且左冠状动脉开口位置相对较低,被人工瓣膜阻塞风险大,考虑患者心功能差且存在左冠状动脉口被遮挡风险,为改善心功能、保护冠状动脉,决定预埋导管进行冠状动脉保护。送Launcher EBU 3.5指引导管(美国美敦力公司)至左回旋支开口处,将Runthrough NS导丝(日本泰尔茂公司)送至左回旋支开口处,送Guidezilla导管(波士顿科学公司)至左回旋支开口处,留置备用。经右侧猪尾导管将超硬导丝送至左心室,结合术前CTA及术中测量,决定置入26 mm Venus-A Plus瓣膜(杭州启明医疗器械股份有限公司)。选用合适工作体位,沿超硬导丝导入人工瓣膜输送系统,到达预定位置后,快速起搏,逐步释放支架瓣膜,瓣膜释放过程中发作心室颤动,经电除颤及心脏按压操作后恢复窦性心律,人工瓣膜释放完毕。造影见人工瓣膜位置满意,形态良好,未见明显瓣周漏。造影见左回旋支轻度对比剂滞留,心肌梗死溶栓治疗试验(thrombolysis in myocardial infarction,TIMI)血流分级Ⅲ级无明显狭窄,撤出冠状动脉保护装置(图4A)。经食管超声心动图示:人工瓣膜位置满意,形态良好,舒张期未见明显瓣周漏。
术后拔除右侧股动脉鞘管,使用预置缝合器缝合右侧股动脉穿刺处,造影后见右侧股动脉形态良好,血流通畅,未见明显狭窄。缝合后无渗血,拔除左侧股动脉鞘管,两侧足背动脉搏动好,加压包扎,手术顺利。术后患者生命体征稳定(血压128/64 mmHg),自觉仍有胸闷,术后第3天患者诉胸闷、头晕较前加重,并伴有血压下降(血压88/53 mmHg)。急查高敏肌钙蛋白T为1.71 μg/L;心电图示左束支传导阻滞难以判断有无心肌缺血(图5);床旁超声心动图示左心室射血分数(left ventricular ejection fraction,LVEF)降至42%,左心室壁整体运动幅度减低,以侧壁、下壁更为显著。考虑急性心肌梗死可能性大。遂行急诊冠状动脉造影术,反复将EBU 3.5、3.0指引导管无法送至左回旋支开口处,更换6 F JL 3.5指引导管(美国Cordis公司)经人工瓣膜送至左冠状动脉开口处,左主干缺如,左回旋支、左前降支均起自于左冠状动脉窦,左回旋支狭窄90%(TAVR术中冠状动脉保护时Guidezilla导管头端放置处,图4B)。将BMW导引导丝(美国雅培公司)送至左回旋支远段,另一根BMW导引导丝送至左回旋支病变远端,以2.5 mm×12 mm乐普球囊预扩张[10 atm(1 atm=101.325 kPa)持续10 s]后,置入2.5 mm×13 mm Firebird 2支架(上海微创医疗器械集团有限公司)1枚,多体位投照病变处,残余狭窄<10%,TIMI血流分级Ⅲ级。术中患者无不适,拔除鞘管,局部加压包扎,返回病房。术后给予常规心电监护示频发长间歇伴血压下降,完善动态心电图示窦性停搏(RR间期最长达3 891 ms),患者术中麻醉时发生窦性停搏结合术后动态心电图考虑病态窦房结综合征。

图4 冠状动脉造影 A.TAVR 当日左回旋支显影良好;B.TAVR 术后第3 天可见左回旋支狭窄90%(箭头所示)Figure 4 Coronary angiography(arrow)

图5 经导管主动脉瓣置换术术后第3 天心电图Figure 5 Electrocardiogram on the 3rd day after transcatheter aortic valve replacement
待患者急性心肌梗死恢复后,于2022年4月2日在局部麻醉下行永久性起搏器植入术,手术顺利,术后10余天后顺利出院。患者术后无活动后胸闷、憋气再发。2022年8月8日门诊随访超声心动图示:人工主动脉瓣功能正常,未见明确瓣周漏,LVEF 55%。
2 讨论
本文报道1例单纯AR行TAVR的病例。多项指南和共识[1-2]推荐,症状性单纯重度AR的标准治疗为外科主动脉瓣置换术,如果患者适合行外科手术则不推荐TAVR。本例患者高龄、合并症多,为外科手术的高危人群,拟经股动脉行TAVR。AR是常见的瓣膜疾病,是由于主动脉瓣膜本身病变、主动脉根部疾病所致,因心脏的代偿机制,疾病早期可无症状,LVEF维持正常,随着疾病进展,逐渐出现心悸、心力衰竭和胸痛等不适。一旦症状出现,病情便迅速恶化,心绞痛者5年内死亡率为50%,严重左心衰竭者2年内死亡率50%[1]。
TAVR创伤小、恢复快,已逐渐成为合并症多、病情复杂老年患者的首选治疗方案。随着TAVR应用于更多人群,TAVR术后的并发症越发受到重视,急性冠状动脉闭塞是一种少见但致命的并发症,主要发生机制为自体瓣膜上翻堵住冠状动脉开口[3],一般认为发生在瓣膜展开后的几秒钟或几分钟。急性冠状动脉闭塞发生率低,如无预设保护措施,一旦发生,器械不易短时间内到位,可导致循环崩溃,死亡率极高。术前应用CTA评估主动脉根部解剖及瓣膜钙化程度至关重要,其主要危险因素包括:冠状动脉开口低(10 mm以内);各瓣叶长度大于各冠状动脉开口距瓣环的距离;瓣叶上有粗大钙化斑块;主动脉瓣球囊扩张时主动脉根部造影示冠状动脉开口受压[4]。对于这类患者术中应采取相应保护策略,如提前在冠状动脉放置导丝或球囊[5]。因此细致全面的术前评估、术中有效的预防措施及强大的心脏科团队为此类患者带来希望和曙光。另外值得注意的是,冠状动脉保护装置的选用及放置要充分考虑冠状动脉血管条件。
本例患者具有以下特点。(1)因患者左回旋支风险较大,术中将冠状动脉保护装置放置在左回旋支,术中左、右冠状动脉显影良好,术后第3天患者发生冠状动脉闭塞。术后分析原因考虑是由于Guidezilla导管放在左回旋支血管较为弯曲处,心脏按压与电除颤也许是刺激导管移位同时造成血管夹层的因素。因人工瓣膜的阻碍,支撑力较强的EBU指引导管在人工瓣膜内不易展开、难以到位,普通导管为较好选择。如使用外径5 F的Guidezilla导管,其头端应避开左主干及分支血管的弯曲处,以避免导管头端在意外操作下造成冠状动脉血管损伤。(2)本例患者年龄较大且合并症多,或许先前已存在窦房结功能低下,全身麻醉时心率降至40次/分后突发心搏骤停,经过心脏按压(持续时间约1 min)恢复窦性心律,约70次/分。心搏骤停考虑是综合原因导致,包括高龄、基础心脏疾病以及缺氧。在释放瓣膜时患者发生心室颤动,原因如下:①患者本身心功能较差快速起搏可能导致心肌缺血诱发心室颤动;②释放瓣膜时瓣膜展开挤压Guidezilla导管,导管前冲撕裂血管导致恶性心律失常的发生。(3)临床工作中需警惕高龄患者可能同时合并心脏瓣膜、冠状动脉及心脏传导系统的问题。
总而言之,约0.22%接受TAVR的患者会出现迟发性冠状动脉闭塞,其中47.4%发生于24 h内,36.8%发生在TAVR 7 d后[6]。临床医师应意识到,冠状动脉闭塞可发生在TAVR术后。当患者出现持续性低血压、心电图改变或室性心律失常时,术者不仅要考虑到严重瓣周漏及心包积液的可能[7],也需考虑冠状动脉闭塞。因一旦发生冠状动脉闭塞,除原生瓣膜可对冠状动脉再介入造成阻碍,置入的瓣膜支架结构也会进一步提升冠状动脉再介入的手术难度[8],另外该患者左冠状动脉双开口进一步加大了介入的难度。
利益冲突所有作者均声明不存在利益冲突

