丁苯那嗪调节TH 和突触囊泡转运改善HD 的机制研究
王如意,范晶菁,李洪林,王 蕊
(华东理工大学药学院, 上海市新药设计重点实验室, 上海 200237)
亨廷顿舞蹈症(Huntington's disease, HD)作为神经退行性疾病中最主要的单基因遗传病,主要由基因突变引起[1]。其临床症状表现为舞蹈症、肌张力障碍、认知功能减退及抑郁等[1]。亨廷顿蛋白(Htt)参与囊泡转运动力学、突触传递和自噬调节等[2],在神经系统的胚胎形成、神经元存活和信号转导等方面发挥重要作用。研究表明,突变的Htt 蛋白(mHtt)诱导纹状体神经元损伤,导致神经元丢失。神经元的丢失使得纹状体中多巴胺(DA)水平紊乱[3],进而破坏大脑中所有神经递质的平衡,导致纹状体功能障碍[4],最终引起运动损伤[5]。3-硝基丙酸(3-NP)通过血脑屏障,结合并抑制线粒体上琥珀酸脱氢酶的催化位点,抑制三羧酸循环,从而选择性损伤纹状体神经元,使动物表现出与HD 相似的病理改变和运动症状[6]。因此,3-NP 诱导的HD 大鼠模型被广泛用于该疾病的研究。
丁苯那嗪(TBZ)是一种非典型抗精神病药,具有降低单胺类神经递质的作用[7-8],已被广泛用于治疗精神病、运动障碍以及中枢功能障碍等疾病[9-10]。据报道,TBZ 对舞蹈样症状具有暂时的抑制作用[11],然而,其对3-NP 诱导的HD 样症状及病理改变的作用机制尚未完全揭示。
本文通过建立3-NP 诱导的HD 大鼠模型,证实了TBZ 可缓解3-NP 引起的大鼠体重下降和运动功能障碍,并着重研究了其改善舞蹈样症状的机制。实验结果表明,TBZ 通过降低囊泡单胺转运体2(VMAT2)的表达和对突触的保护作用调节DA 的突触囊泡转运过程,减少纹状体中DA 的转运和释放。同时,TBZ 通过抑制酪氨酸羟化酶(TH)的表达降低DA 在纹状体中的合成。通过上述两种作用共同减少纹状体中DA 水平,减少神经元损伤,保护纹状体正常功能,从而改善HD 样症状。本文通过对TBZ 治疗3-NP 诱导的HD 大鼠模型的药效及机制研究,验证了其治疗HD 的可行性,研究结果为HD 的治疗策略提供了新的方向。
1 实验部分
1.1 试剂和药物
3-NP(N5636-1G,纯度≥97%)购自美国Sigma-Aldrich 公司,溶于生理盐水中,用NaOH 调节pH 至7.4;TBZ(T2839-200MG,纯度99%)购自日本TCL 公司;Htt 抗体和突触素(SYN)抗体均购自美国Millipore公司;TH 抗体购自美国Cell Signaling Technology 公司;VMAT2 抗体和甘油醛-3-磷酸脱氢酶(GAPDH)抗体均购自美国Proteintech 公司;免疫组化二抗试剂盒和二喹啉甲酸(BCA)蛋白定量试剂盒均购自武汉赛维尔有限公司;荧光二抗IgG、蛋白酶抑制剂和化学发光试剂盒(ECL)均购自Thermo Scientific 科技(中国)有限公司;DA 检测试剂盒和HVA检测试剂盒购自中国Cusabio 公司;尼氏染色试剂盒和苯甲基磺酰氟(PMSF)购自上海碧云天生物科技有限公司。
1.2 实验方法
1.2.1动物模型建立 雄性Wistar 大鼠,200~300g,购自上海西普尔必凯实验动物有限公司。
将大鼠随机分为3 组:生理盐水组;3-NP组(注射剂量20mg/kg[12]);3-NP+TBZ 组(3-NP、TBZ 注射剂量分别为20、3mg/kg[13])。实验流程如图1 所示。预给药1 周后,腹腔注射3-NP 或生理盐水,连续5d。5d 后进行行为学测试。1.2.2 体重测量 每天在给药前,于同一时间称取大鼠的体重并记录,按体重计算每日给药量,取第1 d 和最后1 d 的体重计算其体重变化率。体重变化率(Δmw)计算公式如下:
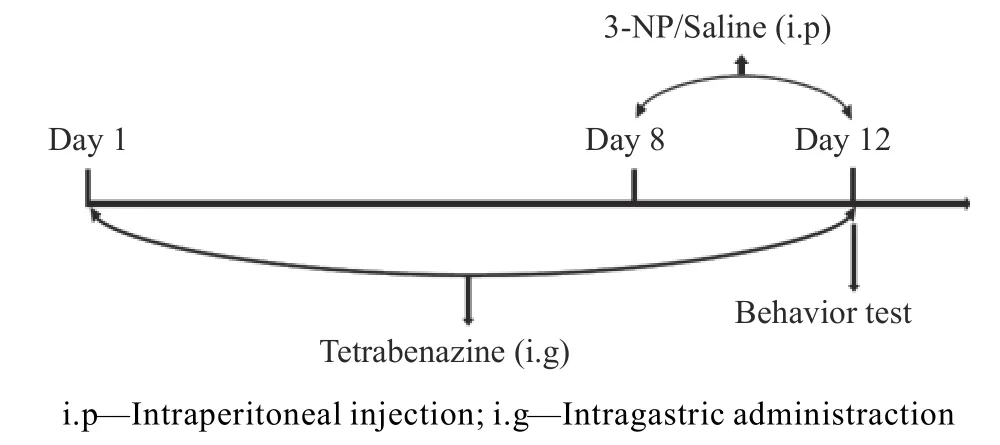
图1 实验流程示意图Fig.1 Experimental flow chart
其中,m'、m1分别为最后1 d 和第1 d 的体重。
1.2.3转棒实验 通过转棒实验测试大鼠的平衡能力。在实验第12d 进行转棒实验,正式测试之前,所有大鼠接受为期3d 的训练,转棒转速为4r/min,每天3 次,每次训练3min。正式实验中,转棒从4r/min到20r/min 加速旋转,记录大鼠从转棒上掉落的时间,重复3 次,取平均值用于比较分析。
1.2.4强迫游泳实验 转棒实验结束后,将大鼠置于安静的环境中休息3h,以消除对后续实验的干扰。随后进行强迫游泳实验,将大鼠分别放入直径25cm、水深30cm 的有机玻璃桶中,水温为(25±3)℃,让其游泳6min,记录后5min 大鼠的不动时间。当动物停止挣扎,仅为了保持平衡或漂浮而运动时,就认为其处于不动状态。
1.2.5Westernblot 实验 大鼠处死后解剖、分离其纹状体。在含有PMSF和蛋白酶抑制剂的裂解缓冲液中裂解组织。提取后的蛋白用BCA 试剂盒进行蛋白定量。在100 V 电压下,经过φ=10%的分离胶分离,并转膜至PVDF 膜上。封闭2 h 后,将条带分别与Htt 抗体(体积比1∶1000)、TH 抗体(体积比1∶1000)或VMAT2 抗体(体积比1∶1000)于4 ℃下过夜孵育;洗膜,室温下与GAPDH 抗体(体积比1∶10000)孵育2 h。通过化学发光检测液显色,于化学发光成像仪(Tanon 5200s 型)下曝光显影。用ImageJ软件对条带进行定量。
1.2.6尼氏染色 大鼠麻醉后依次经心脏灌注50mL生理盐水和100mLφ=4%的多聚甲醛,分离脑组织保存于φ=4%的多聚甲醛中。酒精梯度脱水,石蜡包埋,以4μm厚度切片。切片脱蜡后于尼氏染色液中孵育10min,酒精梯度脱水,二甲苯脱色后用中性树脂封片。
1.2.7免疫组化 石蜡切片脱蜡,于柠檬酸抗原修复液中热修复,φ=3%的过氧化氢中孵育25min 以去除内源性过氧化物酶。切片于φ=5%山羊血清中封闭30min,加入Htt 抗体(体积比1∶1000)或TH 抗体(体积比1∶3000)于4℃条件下过夜孵育。磷酸盐缓冲液(PBS)洗涤3 次后,将切片与生物素标记的羊抗兔IgG 或羊抗鼠IgG 于37℃孵育1h。二氨基联苯胺(DAB)工作液进行显色,观察到阳性位置出现棕黄色后,用PBS 结束显色。酒精梯度脱水后,浸入二甲苯中使其透明。稍晾干,中性树脂封片。
1.2.8免疫荧光 一抗孵育前步骤与免疫组化相同,加入突触素SYN 抗体(体积比1∶200)于4℃中避光过夜孵育。洗涤3 次,室温下加入AlexaFluor®568山羊抗鼠(体积比1∶100)避光孵育2h。加入4',6-二脒基-2-苯基吲哚(DAPI)染色液孵育1min。PBS冲洗后,使用尼康共聚焦显微镜(Nikon-csu-w1sora型)观察切片,设置激光波长为(405~561)nm。使用imageJ 软件统计荧光强度。
1.2.9酶联免疫吸附实验(ELISA)
(1)样品制备 取适量纹状体组织,PBS 冲洗血迹。加PBS 研磨至匀浆状,于−20℃条件下放置过夜。反复冻融2 次以破坏细胞膜,在5000g,2~8℃条件下离心5min,分离上清。
(2)DA 水平检测 用DA 检测试剂盒检测纹状体中的DA 水平。加入标准品或样品,于37℃孵育2h,弃液。每孔加入生物素标记抗体工作液,于37℃孵育1h,洗涤。每孔加入辣根过氧化物酶标记亲和素工作液,于37℃孵育1h,弃液,洗涤。依次加入底物溶液,于37℃避光孵育15~30min。加入终止液停止反应。用酶标仪于450nm 下测定各孔的光密度。使用BCA 试剂盒蛋白定量进行归一化处理。
(3)HVA 水平检测 用HVA 检测试剂盒检测纹状体中HVA 水平。加入标准品或测试样品,立即添加抗体工作液,于37 ℃孵育40 min。洗涤,加入酶结合物工作液,于37 ℃ 温育30 min。洗涤,每孔加入底物溶液,于37 ℃避光显色20 min。依次加入终止溶液终止反应。用酶标仪于450 nm 处测量各孔的光密度值。使用BCA 试剂盒蛋白定量进行归一化处理。
1.2.10数据分析和统计 数据处理及作图采用GraphPadPrism8.0,统计分析采用IBMSPSSStatistics 25,结果以平均值±标准差表示。采用单因素方差分析进行组间差异性比较,其中“*”和“#”分别表示与模型组3-NP 和对照组相比;P<0.05 表示有显著性差异;*表示P<0.05,**表示P<0.01,***表示P<0.001,#表示P<0.05,##表示P<0.01,###表示P<0.001;n表示每组样本数。
2 结果与讨论
2.1 TBZ 逆转3-NP 诱导的体重减少和异常行为表现
体重和行为学变化被用来评估动物模型是否成功。结果表明,经3-NP 诱导后,动物体重较对照组显著下降(P<0.001,图2(a)),这可能与代谢紊乱、神经元变性以及双侧纹状体损伤有关[14],伴随着体重下降会出现一些运动行为表型的改变[15-18];在行为学实验中,大鼠从转棒上掉落的时间显著减少(P<0.001,图2(b)),在水中不动时间显著增加(P<0.001,图2(c)),表明运动能力受损,表现出HD 样症状,这些变化可能与3-NP 损伤纹状体功能有关[19]。与3-NP 单独处理组相比,经3-NP+TBZ(3 mg/kg,P<0.001)处理的大鼠从转棒上掉落的时间显著增加,且在杆上运动时四肢更有力,而3-NP 处理组动物则表现出跛行状态。此外,TBZ 减少了动物在水中的不动时间 (P<0.001)。上述结果表明,TBZ 改善了大鼠的运动协调能力和游泳能力,表明TBZ 可以缓解3-NP 诱导的HD 样症状。
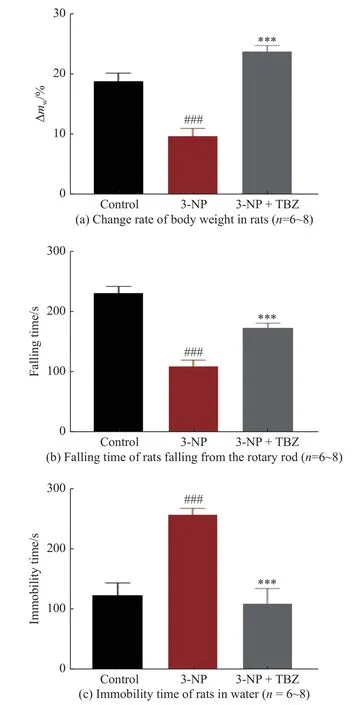
图2 TBZ 逆转3-NP 诱导的体重减少和异常行为Fig.2 TBZ reversed 3-NP induced weight loss and abnormal behavior
2.2 TBZ 减轻3-NP 诱导的Htt 蛋白水平的升高
mHtt 蛋白在多种细胞中广泛表达,可引起细胞毒性[20],但HD 病变主要发生在纹状体[21]。本研究通过Western blot 和免疫组化对动物纹状体中Htt 的表达进行研究,结果如图3 所示。与对照组相比,3-NP 处理组大鼠的纹状体中Htt 水平显著升高(P<0.05,图3(a)、3(b)),这与HD 应有的病理特征相吻合。而TBZ 治疗可以明显逆转Htt 水平的升高趋势(P<0.01)。如图3(c)显示,纹状体Htt 阳性信号呈棕黄色,与对照组相比,经3-NP 诱导的大鼠纹状体中阳性信号密度与强度均明显增加,表明Htt 水平升高。而加入TBZ 可逆转这一趋势,提示TBZ 能降低Htt 的表达,该结果与Western blot 保持一致(图3(c))。上述结果验证了TBZ 可减轻3-NP 诱导的Htt 蛋白水平的升高。
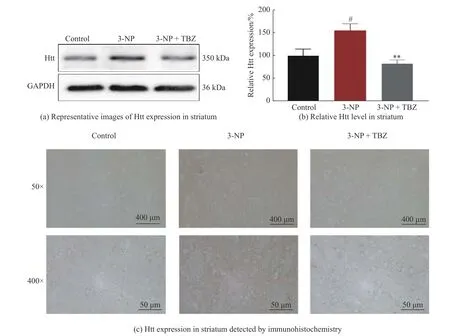
图3 TBZ 减轻3-NP 诱导的Htt 蛋白水平的升高Fig.3 TBZ reverses 3-NP-induced Htt protein upregulation
2.3 TBZ 提高3-NP 诱导的大鼠纹状体和黑质中神经元的存活
mHtt 可能引起兴奋性谷氨酸中毒,并破坏附近神经元或神经胶质细胞的功能,从而损伤神经元[22]。为了验证TBZ 对纹状体神经元的影响,采用尼氏染色法对大鼠纹状体神经元进行形态学分析并计数。如图4 所示,对照组中神经元形态正常且分布均匀,无明显肿胀和核固缩。经3-NP 诱导的大鼠纹状体中神经元数量较对照组减少(P<0.01),且神经元分布不均,胞体呈现皱缩状,且仁不清。经TBZ 治疗后,神经元数量增加(P<0.01),形态趋于正常(图4(a)、4(b))。mHtt 在疾病早期对纹状体神经元造成深度损伤,随后影响大脑其他区域的神经元[23-24],因此,本研究进一步对黑质神经元的损伤情况进行评估。与纹状体相似,3-NP 处理组中大鼠黑质神经元的数目明显减少(P<0.01),而3-NP+TBZ 组中大鼠黑质神经元的数量明显增加(P<0.05,图4(c))。3-NP 引起神经元丢失和死亡,而TBZ 可减轻3-NP 引起的神经毒性,表明该化合物对3-NP 诱导的HD 大鼠模型具有神经保护作用。
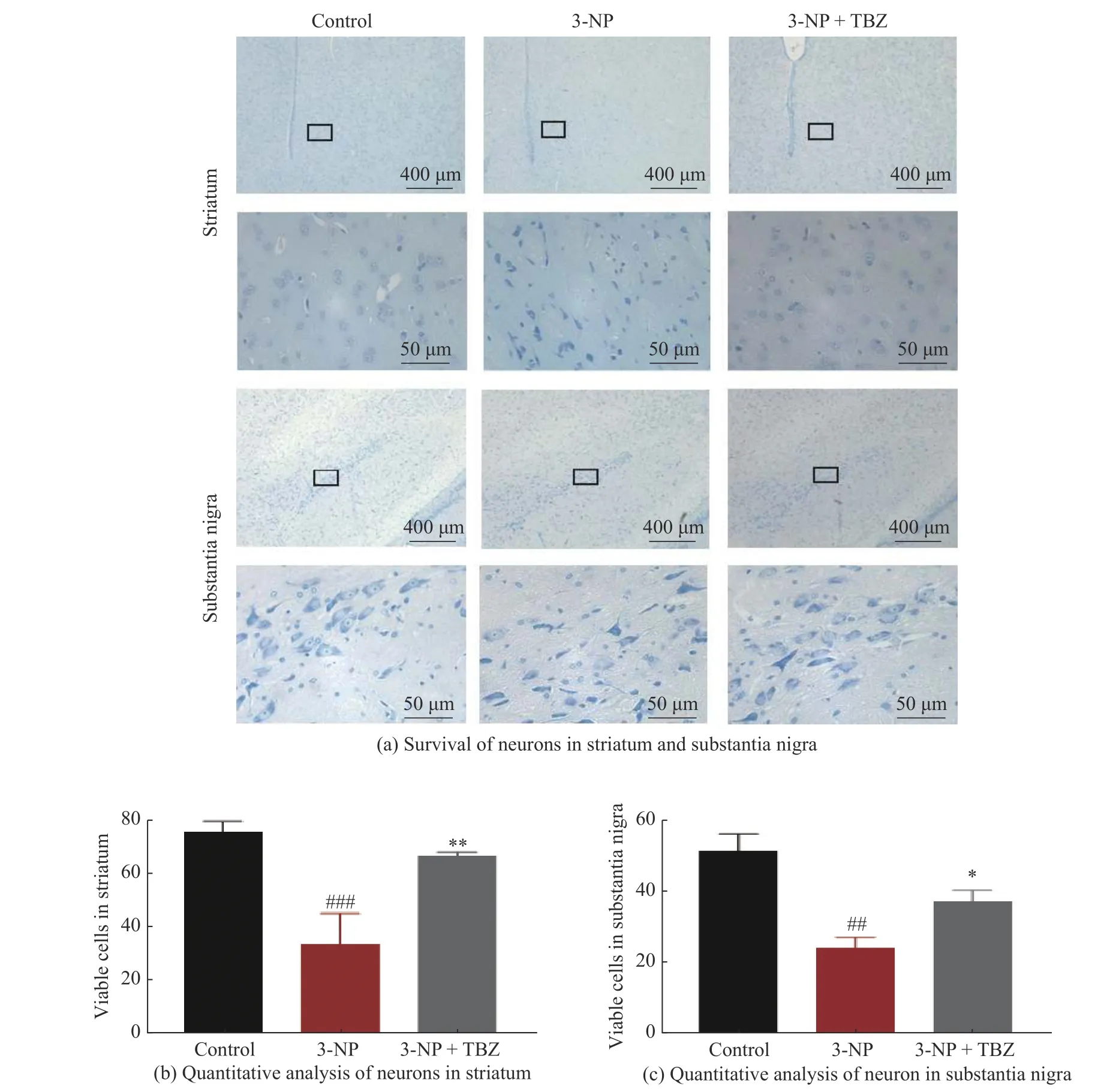
图4 TBZ 提高3-NP 诱导的大鼠纹状体和黑质中神经元的存活Fig.4 TBZ improved 3-NP - induced neuronal survival in striatum and substantia nigra
2.4 TBZ 影响纹状体中DA 及其代谢物的水平
纹状体中神经递质水平的改变已被证明对HD的病理生理基础和疾病的发展有重要贡献[25-26]。本文采用ELISA 法测定动物纹状体中DA 及其代谢物的浓度,验证了TBZ 对神经递质水平的影响。如图5(a)所示,3-NP 诱导的大鼠纹状体中DA 水平显著升高(P<0.05),而其代谢产物高香草酸(HVA)水平明显下降 (图5(b)),提示该动物模型中DA 及其代谢物水平紊乱,表明3-NP 处理组大鼠出现运动障碍可能与引起上述神经递质水平的改变有关。而TBZ处理的大鼠纹状体中DA 水平(P<0.01)较模型组显著下降,HVA 水平明显升高(P<0.05),表明TBZ 可以逆转3-NP 导致的纹状体神经递质紊乱。这可能是TBZ 改善3-NP 诱导的HD 大鼠异常行为表型的原因之一。
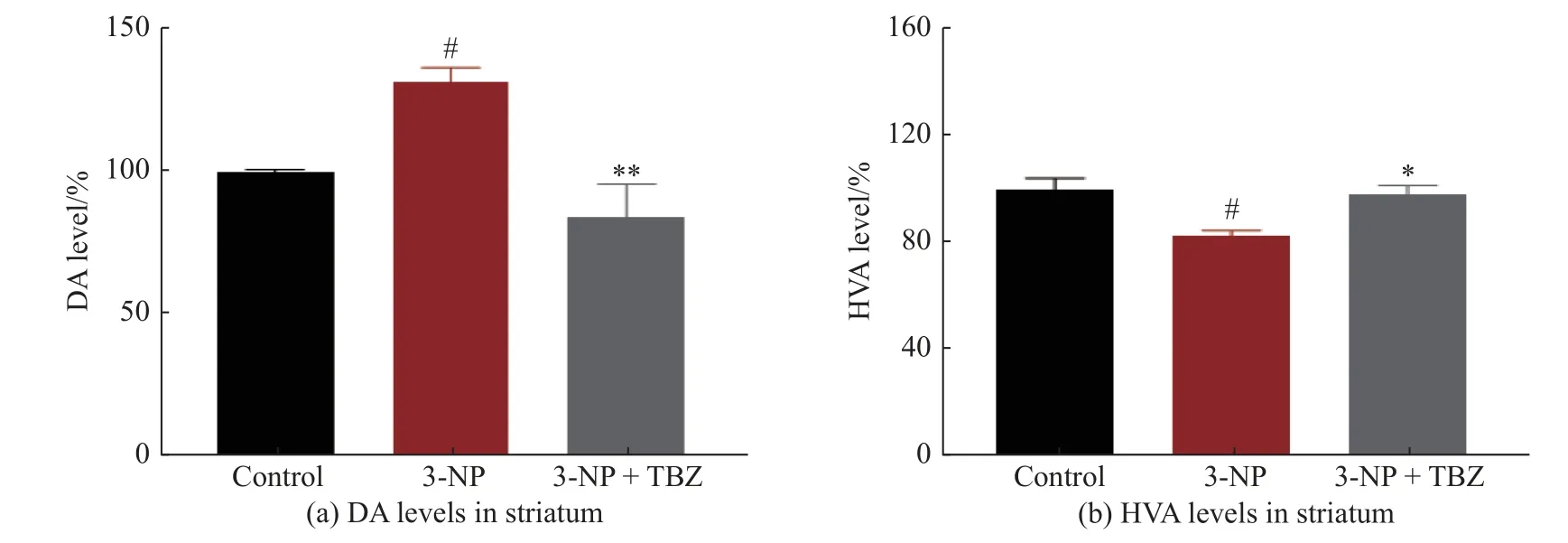
图5 TBZ 影响多巴胺及其代谢物的水平Fig.5 TBZ affects the levels of DA and its metabolite
2.5 TBZ 调节TH 的表达水平
采用Western blot 和免疫组化方法检测纹状体中TH 的表达水平。如图6(a) 所示,纹状体的TH 阳性信号为黑质DA 神经元投射的神经末梢,组化染色显示各组均可见棕黄色阳性纤维。与对照组相比,注射3-NP 的大鼠纹状体中TH 阳性纤维密度和信号强度均明显升高。与此相反,TBZ 治疗后纹状体阳性纤维密度降低且信号减弱。统计分析结果显示,3-NP 诱导的动物纹状体中TH 水平高于对照组,但TBZ 处理组大鼠TH 水平显著下降(P<0.01,图6(b))。Western blot 的结果与上述结果一致(图6(c))。因此,TBZ 可调节纹状体中TH 的表达,使其恢复到正常水平。TH 是参与DA 合成的限速酶,抑制TH 可以大大降低DA 的生成[27-29]。TBZ 可能通过抑制纹状体中TH 的表达来降低DA 及其代谢物的含量,从而影响运动表型。
2.6 TBZ 抑制3-NP 诱导的突触损伤并调节VMAT2的表达水平
mHtt 对突触功能具有明显的毒性,如干扰突触囊泡的运输、破坏突触囊泡的结构、抑制神经递质的摄取和释放、影响突触蛋白的表达或转译后修饰[30]。为了验证TBZ 能否通过调节突触囊泡影响中枢神经系统中神经递质的正常释放,本文研究了纹状体中SYN 和VMAT2 的表达。采用免疫荧光法对大鼠纹状体切片进行处理,采用共聚焦显微镜拍摄图像(图7(a))。图7(b)表明3-NP 降低了大鼠纹状体中SYN 水平(P<0.01),说明其对突触具有损伤作用;而TBZ 逆转了3-NP 对突触的损伤(P<0.01),表明TBZ具有选择性地结合并抑制VMAT2 的功能,可以减少囊泡对单胺类神经递质的作用[31]。由图7(c)、7(d)可见,3-NP 处理组中动物纹状体的VMAT2 水平显著高于对照组(P<0.01),而TBZ 能改善这一异常现象(P<0.05),且其改变VMAT2 水平的趋势与改变DA 水平趋势保持一致,表明TBZ 可能通过调节VMAT2 水平影响纹状体DA 的转运和释放。因此,TBZ 可能通过保护突触水平及功能,并调节VMAT2蛋白的表达,恢复纹状体中DA 的含量,其对DA 的调节作用进一步保护了神经元,从而恢复纹状体正常功能,最终缓解了3-NP 诱导的HD 样症状,详细机制过程见图8。
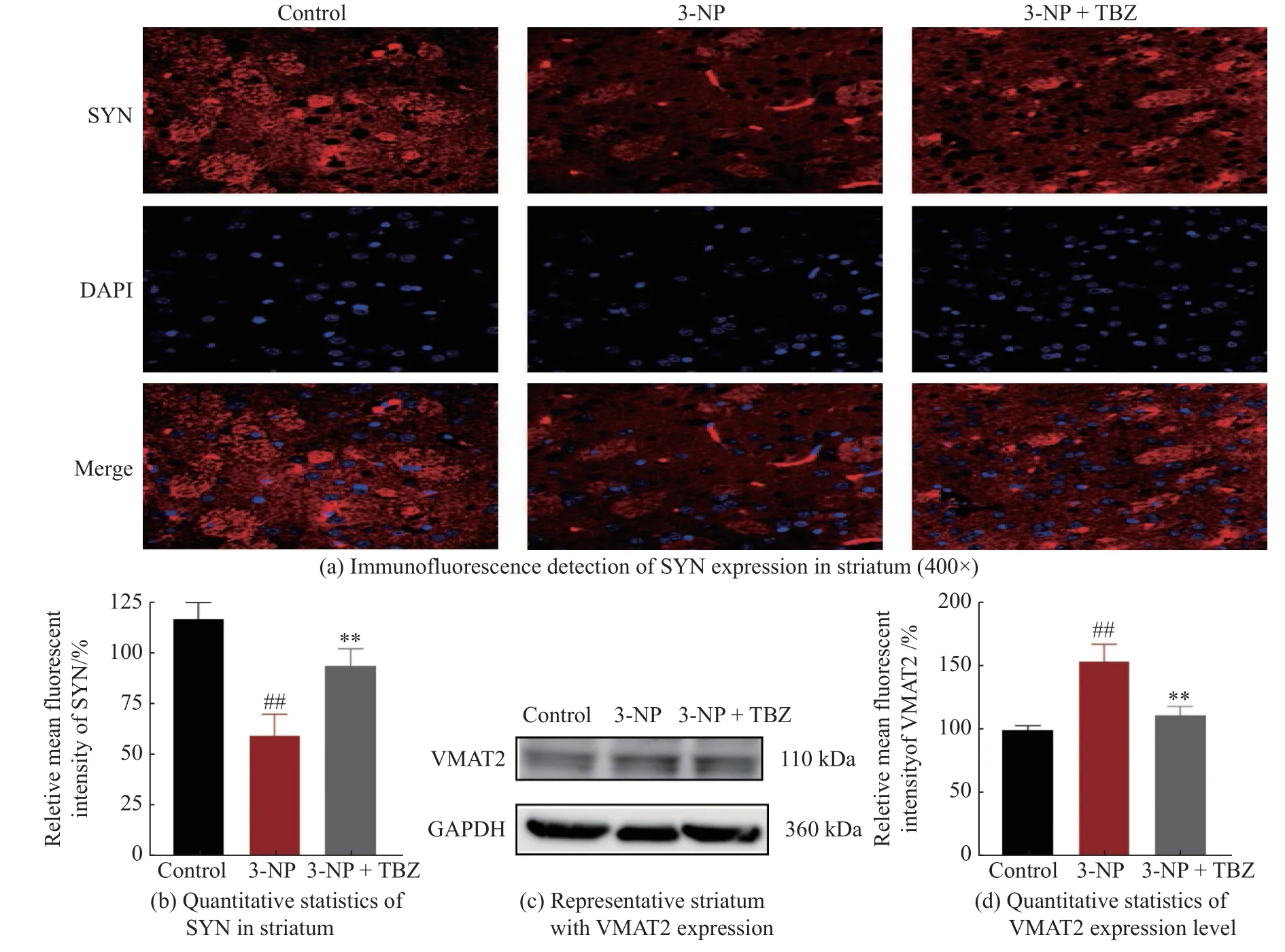
图7 TBZ 抑制3-NP 诱导的突触损伤并调节VMAT2 的表达水平Fig.7 TBZ inhibited 3-NP induced synaptic damage and regulated VMAT2 expression
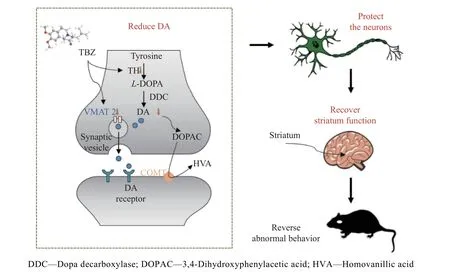
图8 TBZ 改善HD 样症状的机制示意图Fig.8 Schematic diagram of mechanism of TBZ ameliorating HD-like symptoms
3 结 论
本文验证了TBZ 对3-NP 诱导的HD 大鼠模型的治疗作用,并证实TBZ 可以恢复该动物模型纹状体中发生的DA 及其代谢产物HVA 水平的紊乱,以及降低VMAT2 的蛋白表达,保护突触功能,进而减少单胺类神经递质的转运和释放,调节纹状体中DA 的含量。此外,TBZ 还可以作用于DA 合成路径中的合成限速酶TH,通过抑制该蛋白的表达减少DA 在纹状体中的合成。这些作用共同导致TBZ 降低纹状体中DA 水平,防止DA突触后神经元的过度刺激,减少纹状体功能损伤,从而改善HD 样症状。这可能为TBZ 治疗HD 的机制提供了新的解释。

